取出乳房植入体的物理性能分析
2022-07-21谢胜芬刘珍珍肖燕萍广东省医疗器械质量监督检验所广东广州510080
谢胜芬 刘珍珍 肖燕萍 广东省医疗器械质量监督检验所 (广东 广州 510080)
内容提要: 乳房植入体作为植入性高风险医疗器械,直接关系到患者的身心健康和生活质量。这类产品属于长期植入器械,且涉及面广,其有效性和安全性一直受到社会的密切关注,产品植入人体后,乳房植入物会随着植入时间的延长,逐渐老化,各项力学性能指标会存在性能降低的现象,破裂发生率也将增大,加大了硅凝胶填充物从外壳渗出进入人体组织的风险。乳房植入物破裂、渗漏会给患者带来非常大的伤害。文章对医院取出的硅凝胶填充乳房植入体的物理性能进行测试,与现行标准进行对比,进行风险分析,并提出相关建议。
乳房植入物是一种带有壳体的用于增加乳房体积或置换乳房的植入物,可以由制造商或者外科医生向壳体内填充物体[1]。常用的假体为硅凝胶假体和盐水假体,其中硅凝胶假体使用占有率为80%以上。硅胶假体置入术与其他隆乳手术方法相比,因其效果好且并发症相对较少,对人体伤害小、容易取出的特点,现已成为国内外临床首选隆乳手术方式,也是当今安全系数最高的隆乳方式[2]。乳房植入物在我国的医疗器械管理类别中被划归为Ⅲ类,类别代号为13-09整形及普通外科植入物,属于高风险医疗器械,其质量优劣直接影响患者身体健康及生命安全。国家对其生产至经营各环节都进行了严格的监管。本文通过介绍产品现状及对医院取出的硅凝胶填充乳房植入体的物理性能变化进行分析,与产品现行标准指标对比差异,分析风险。
1.产品概述
1.1 国内外现行标准
国家药品监督管理局于2008年4月25日发布了行业专用标准YY 0647-2008《无源外科植入物 乳房植入物的专用要求》[1](2009-12-01实施),该行业标准等同采用国际标准ISO 14607:2007Non-active surgical implants-Mammary implants-Particular requirements为现行标准,将于2022年12月1日作废。新的标准YY/T 0647-2021《无源外科植入物 乳房植入物的专用要求》,该标准已于2021年12月6日发布,将于2022年12月1日实施。现行的YY 0334-2002《硅橡胶外科植入物通用要求》和YY 0484-2004《外科植入物 双组份加成型硫化硅橡胶》,YY/T 1457-2016《无源外科植入物 硅凝胶填充乳房植入物中寡聚硅氧烷类物质测定方法》,YY/T 1555.1-2017《硅凝胶填充乳房植入物专用要求硅凝胶填充物性能要求 第1部分:易挥发性物质限量要求》、YY/T 1555.2-2018《硅凝胶填充乳房植入物专用要求 硅凝胶填充物性能要求 第2部分:可浸提物质限量要求》也与该产品相关联。国际标准化组织于2018年发布了ISO 14607:2018Non-active surgical implants-Mammary implants-Particular requirements美国材料试验协会于2018年发布了ASTM F703-18Standard Specification for Implantable Breast Prostheses。
1.2 产品注册要求
2007年4月11日,原国家食品药品监督管理局发布了《关于硅橡胶充填式人工乳房产品注册有关问题的通知》[3],为进一步规范乳房植入物注册管理工作,加强对产品上市后的监督管理,对该产品的注册工作提出了新的规定,要求企业参照国际标准ISO 14607,对所有已批准上市的硅橡胶充填式人工乳房产品的生产企业(境内外),立即开展对相关产品有效性、安全性的再评价工作,并对涉及产品性能的技术资料、申报资料进行补充完善;包括:抗冲击试验、疲劳试验、耐磨试验、老化试验、内容物的扩散试验、小分子及低分子物质的限定、生物相容性评价资料、临床随访资料等。目前国内企业所生产的乳房植入物产品均按照该要求注册,并进行生产和管理。
1.3 产品生产情况
据调查统计,国内生产企业产品壳体的原材料供应商均为美国Nusil公司的进口专用材料,而对于内容填充物凝胶,国内生产企业则基本由自己合成。国内生产企业与国外企业的生产工艺基本相同,产品性能略有差异,在质量方面没有实质性的差别。截止日前,国家药品监督管理局批准的国内生产企业有6家,国内企业分布在广东(1家)、浙江(1家)、上海(4家)。进口代理公司有5家,代理公司均分布在江苏(1家)、上海(4家)。乳房植入物产品的详细注册信息见表1和表2。
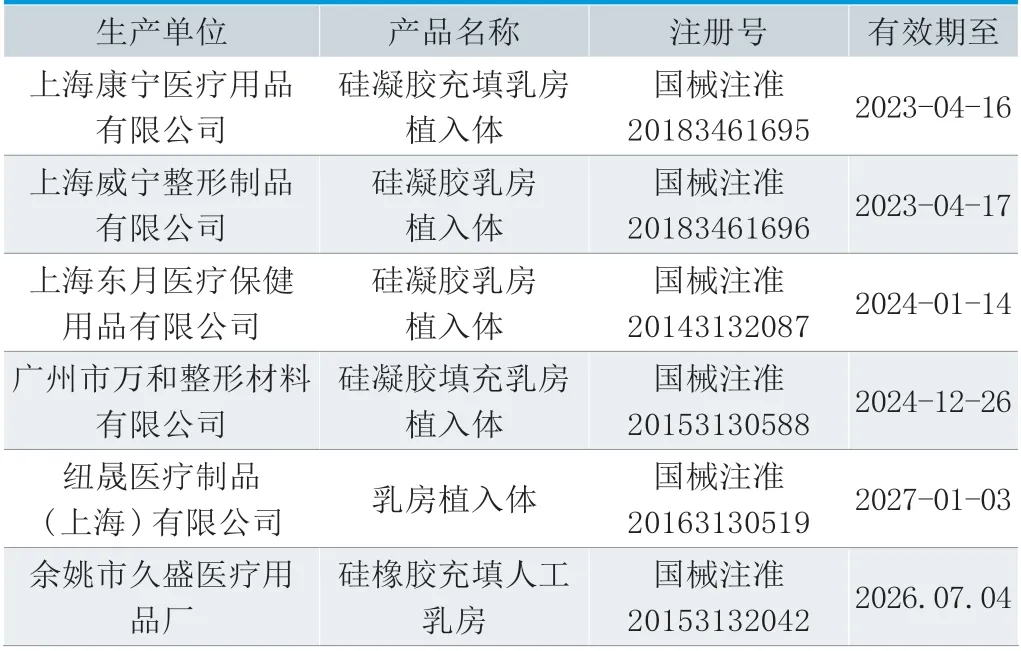
表1.国内产品注册信息

表2.进口产品注册信息
2.试验部分
此次共收到医院取出的样品合计21个,该样品为长时间植入达到置换要求从人体取出的样品,包含了第二代和第三代乳房植入物。其中一个样品为破裂污染状态,作弃样处理,从中随机选取11个完好样品分组进行物理性能的相关测试。测试前将样品按照GB/T 25440.1-2010《外科植入物的取出与分析 第1部分:取出与处理》中的胸部假体清洗方法进行高压水漂洗,然后再进行消毒灭菌处理。
本次研究项目共7项,研究的依据主要参考现行的强制性行业标准YY 0647-2008《无源外科植入物 乳房植入物的专用要求》。通过静态力学试验,考察乳房植入物植入人体,置换取出后其承受静态力的能力。试验项目及试验方法见表3。

表3.试验项目及试验方法
3.结果与分析
3.1 检验结果
乳房植入物测试结果统计见表4。
测试仅对样品进行研究,不对结果进行判定,物理性能的统计结果表明,样品在长时间植入达到置换要求从人体取出后,进行物理性能测试(见表4),部分样品低于现行标准要求。
3.2 结果分析
测试失败图例详见图1。乳房植入物属于长期植入高风险产品,随着植入时间的延长,假体的壳体会在体内出现老化、降解现象,材料各项性能也随之下降,假体破裂或渗漏的发生率变高。而假体破裂主要与假体质量差、假体老化因素有关。
乳房植入物壳体破裂,硅凝胶便可渗入到乳腔,从而进入组织,分布到局部或全身,铂和硅氧烷从硅凝胶乳房假体中渗漏出并在假体周围组织中蓄积,并存在引发人体组织产生病理改变的可能[4]。假体破裂、渗漏会给患者带来非常大的伤害。
4.小结
每年全球假体植入约有150万例,在中国乳房植入物用于隆胸或修复重建也已经有几十年的时间。目前国内乳房植入物生产厂家年产量约在10万只。它属于长期植入高风险医疗器械,涉及面广,其有效性和安全性一直受到社会的密切关注。
假体隆胸常见的并发症有包膜挛缩、乳房疼痛、乳头血肿及假体移位等,产品历经三代,在材料及结构上进行了诸多技术改进。且现行标准对扯断伸长率、拉伸永久变形、连接/接缝或封口的强度、撕裂强度、硅凝胶的内聚力、抗冲击试验、渗出试验、静态破裂试验、耐磨性试验、疲劳试验、生物学评价和降解研究试验等有严格的要求。本次探索性研究目的是通过测试人体取出的乳房植入物,对乳房植入物植入人体后主要的物理性能指标进行评价。此次研究考察的部件包含了壳体和内容物,可以通过研究结果综合地评价所测样品植入后物理性能的变化。所选的11个样本的分析结果表明,所选测试样品在长时间植入人体后,部分样品的物理性能(见表4)低于现行标准要求。

表4.测试结果统计表
5.思考和探讨
乳房植入物是国家重点监管的医疗器械品种之一,作为长期植入的医疗器械,它的有效性及安全性直接关系到患者的身心健康和生活质量,由于产品质量对原材料和生产工艺都有极高的要求,企业在各个生产环节对产品进行了非常严格的控制,但产品植入人体后,随着植入时间的延长,乳房植入物会逐渐老化,各项力学性能指标均会存在性能降低的现象,增加破裂发生率,加大了硅凝胶填充物从外壳渗出进入人体组织的风险。因此仅从产品注册标准或行业标准难以有效评价其在临床使用带来的风险,生产企业在评价乳房植入物产品的有效性、安全性时,需全面考虑,并建立一个完善和严谨的体系(包含植入时间、性能变化等)。
使用者在术前应详细了解产品,知晓长期风险,术后定期复查并密切关注身体状况。医院及企业应妥善保存溯源数据,对使用者进行病情跟踪,在使用时间定期随访并密切关注其并发症。管理部门应充分利用企业随访数据综合评价产生上市后的风险。
