NSPs在系统性红斑狼疮患者血清中的表达及临床意义①
2022-07-21姜蓉琼杨桂钊袁国华
姜蓉琼 杨桂钊 冯 丹 刘 静 王 丹 陈 勇 袁国华
(川北医学院附属医院风湿免疫研究所,南充 637000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种好发于育龄期女性的慢性自身免疫性疾病,临床表现复杂多变,累及几乎所有系统、器官,包括皮肤、关节、肾、肺、神经系统、浆膜、消化、血液和(或)其他组织器官,轻者仅有轻度关节痛和皮肤受累,重者可出现重要内脏器官受累,甚至危及生命[1]。SLE 发病机制复杂,目前研究认为其特征性免疫学改变为体内产生多种自身抗体,抗原抗体形成免疫复合物沉积于组织引起组织器官损伤。中性粒细胞丝氨酸蛋白酶(neutrophil serine proteases,NSPs)是主要在中性粒细胞中表达的蛋白水解酶,主要包括中性粒细胞弹性蛋白酶(neutrophil elas⁃tase,NE)、组织蛋白酶G(cathepsin G,CG)、蛋白酶3(proteinase 3,PR3)。DAI 等[2]研究发现,雌激素诱导的B6 小鼠和自发性狼疮易感小鼠(MRL-LPR、B6-LPR 和NZB/WF1 小鼠)中,NE、CG、PR3 表达上调,认为NSPs 参与自身免疫过程。另有研究表明,NSPs通过促进IL-1β产生和水解内皮细胞参与中性粒细胞介导的炎症性血管疾病发生发展,且抑制NSPs 可能成为该病治疗靶点[3-4]。诸多研究表明NSPs在自身免疫性疾病中发挥重要作用。近年研究显示,NSPs可能成为自身抗原,产生自身抗体,可能与SLE 发生发展密切相关[5]。为研究NSPs 是否参与SLE 发生发展过程,本研究拟采用ELISA 法检测SLE患者血清NSPs水平,并探究其与SLE的关系。
1 资料与方法
1.1 资料
1.1.1 研究对象 选取2020年12月至2021年5月川北医学院附属医院风湿免疫科就诊的SLE 患者66例,其中男性0例,女性66例,年龄20~46岁,平均年龄(32.3±6.5)岁,病程1~172 个月,中位病程31 个月。所有患者均符合1997 年ACR SLE 的诊断分类标准[6]或2019 年EULAR/ACR SLE 的诊断分类标准[7],排除合并急性或慢性炎症疾病、急性肝肾损伤、恶性肿瘤、血液系统疾病、严重心、肺、脑、肾等原发性疾病及其他自身免疫性疾病患者,排除14岁以下患儿,近期无怀孕、生育或流产情况,且近3个月未使用大剂量糖皮质激素。详细收集临床和实验室资料,按照文献[8]判定病情活动度积分(SLEDAI)。选择同期39 例健康体检者作为健康对照组,年龄18~41 岁,平均年龄(31.8±5.9)岁,两组年龄、性别差异无统计学意义(P>0.05)。本研究遵循人体受试者道德伦理学标准,研究方案经川北医学院附属医院医学伦理委员会批准,所有受试者知情同意。
1.1.2 主要试剂及仪器 人NE(ELA2)ELISA试剂盒(武汉博士德生物工程有限公司);人CG(cath-G)、人PR3 ELISA 试剂盒(武汉华美生物工程有限公司);ADVIA Centaur XP 全自动化学发光免疫分析系统(SIEMENS)。
1.2 方法
1.2.1 ELISA 测定血清NE 水平 采集受试者晨起外周静脉血5 ml,室温凝固2 h,1 000 g 离心15 min,取血清按1∶4 稀释。取300 µl 重组人ELA2 标准液进行倍比稀释,取100µl 标准液或待测血清加入预包被抗人ELA2 抗体的96 孔板(每例均设复孔)37 ℃温育90 min,弃孔中液体,加入100µl生物素标记的抗人ELA2 抗体工作液37 ℃温育60 min,1×洗涤缓冲液洗板3 次,加入100µl 亲和素-过氧化物酶复合物(ABC)工作液37 ℃温育30 min,1×洗涤缓冲液洗板5次,加入90 µl TMB底物溶液37 ℃避光显色15 min,100 µl/孔加入终止液,酶标仪测定450 nm处吸光度。空白对照以样品稀释液代替待测血清。
1.2.2 ELISA 测定血清CG、PR3 水平 取250 µl CG(PR3)标准液进行倍比稀释,取100µl 标准液或待测血清加入预包被抗人CG(PR3)抗体的96 孔板(每例均设复孔)37 ℃温育120 min,弃孔中液体,加入100 µl 生物素标记的抗人CG(PR3)抗体37 ℃温育60 min,1×洗涤缓冲液洗板3 次,加入100 µl HRP-亲和素37 ℃温育60 min,1×洗涤缓冲液洗板5 次,加入90 µl TMB 底物溶液37 ℃避光显色20 min,50µl/孔加入终止液,酶标仪测定450 nm 处吸光度。空白对照以样品稀释液代替待测血清。
1.2.3 血清NE、CG、PR3 水平与临床特征相关性分析 将SLE 组血清NE、CG、PR3 浓度≥健康对照组血清NE、CG、PR3浓度P95(即116.6、81.2、2.2 ng/ml)定义为表达升高,SLE 患者白细胞减少或血小减少定义为血液学异常。SLE患者出现下列任意一项表现者定义为肾损伤:①尿蛋白定量>0.5 g/24 h,或随机尿检查尿蛋白+++,或尿蛋白/肌酐比>500 mg/g(50 mg/mmol);②细胞管型包括红细胞管型、血红蛋白管型、颗粒管型、管状管型或混合管型;③活动性尿沉渣(除外尿路感染,尿白细胞>5个/HPF,尿红细胞>5 个/HPF),或红细胞管型,或白细胞管型;④肾组织活检显示为免疫复合物介导的肾小球肾炎。患者主要采用糖皮质激素(本研究中患者使用的糖皮质激素剂量均<15 mg/d)、羟氯喹和免疫抑制剂治疗,后者包括环磷酰胺(cyclophosphamide,CTX)、硫唑嘌呤(azathioprine,AZA)、吗替麦考酚酯(myco⁃phenolate mofetil,MMF)、他克莫司(tacrolimus,TAC)、甲氨蝶呤(methotrexate,MTX)。分别统计血清NE、CG、PR3 水平正常组和升高组SLE 患者临床表现、实验室检查结果和治疗情况。
1.3 统计学分析 采用SPSS23.0软件进行统计学分析。正态分布计量资料以±s表示,组间比较采用t检验;非正态分布计量资料以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验;计数资料以百分比(%)表示,组间比较采用χ2检验。计量资料关系评估采用Pearson 或Spearman 相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 SLE 组和健康对照组受检者血清NE、CG、PR3水平比较 SLE 组血清NE 水平[98.7(66.1,128.9)ng/ml]显著高于健康对照组[51.3(33.7,78.9)ng/ml],差异有统计学意义(Z=-3.487,P<0.001,图1A);SLE 组血清CG 水平[108.9(53.9,134.6)pg/ml]显著高于健康对照组[38.7(36.1,40.9)pg/ml],差异有统计学意义(Z=-6.360,P<0.001,图1B);SLE 组血清中PR3 水平[2.6(2.1,3.6)ng/ml]高于健康对照组[1.1(1.0,1.6)ng/ml],差异有统计学意义(Z=-7.037,P<0.001,图1C)。

图1 SLE组和健康对照组血清NE、CG、PR3水平比较Fig.1 Comparison of serum NE,CG,PR3 levels between SLE group and healthy control group
2.2 SLE 患者血清NE、CG、PR3 水平与SLEDAI 相关性分析 相关性分析结果显示,血清NE、CG、PR3水平与SLEDAI 均呈显著正相关(r=0.420,0.269,0.475,P<0.05,图2)。

图2 SLE患者血清NE、CG、PR3水平与SLEDAI评分相关性分析Fig.2 Analysis of correlation between serum levels of NE,CG,PR3 and SLEDAI score in patients with SLE
2.3 SLE患者血清NE、CG、PR3水平与临床特征的关系 血清NE水平升高的SLE患者C4水平明显低于未升高者(t=-3.022,P=0.004),SLEDAI 评分升高(Z=-2.892,P=0.004),且抗核小体抗体阳性率(χ2=4.261,P=0.039)和抗核糖体P 蛋白抗体阳性率(χ2=8.542,P=0.003)升高,而皮肤黏膜损伤、关节炎、肾损伤、血液学异常发生率及抗dsDNA 抗体阳性率有升高趋势,C3 水平更低,但差异无统计学意义(P>0.05);不同血清NE 水平组糖皮质激素、硫酸羟氯喹、免疫抑制剂使用情况差异无统计学意义(P>0.05,表1)。血清CG 水平升高的SLE 患者更易发生肾损伤(χ2=4.062,P=0.044),血液学异常发生率明显升高(χ2=4.692,P=0.030),且C3(t=-2.964,P=0.004)、C4(t=-2.969,P=0.004)水平更低,SLE⁃DAI 评分更高(Z=-2.197,P=0.028),同时抗dsDNA抗体(χ2=4.243,P=0.039)和抗核小体抗体(χ2=3.993,P=0.046)阳性率升高,其他临床表现、实验室检查指标及糖皮质激素、硫酸羟氯喹、免疫抑制剂使用情况差异无统计学意义(P>0.05,表2)。血清PR3 水平升高的SLE 患者更易发生关节炎(χ2=3.948,P=0.047),其他临床表现、实验室检查指标,如皮肤黏膜损伤、肾损伤、血液学异常发生率及抗dsDNA 抗体阳性率有升高趋势,C3、C4 水平更低,SLEDAI 评分更高,但无统计学意义(P>0.05),治疗情况差异无统计学意义(P>0.05,表3)。
表1 不同血清NE水平SLE患者临床表现、实验室检查结果和治疗情况比较[±s,M(Q1,Q3),例(%)]Tab.1 Comparison of clinical manifestations,laboratory results and treatment in SLE patients with different serum NE levels[±s,M(Q1,Q3),n(%)]

表1 不同血清NE水平SLE患者临床表现、实验室检查结果和治疗情况比较[±s,M(Q1,Q3),例(%)]Tab.1 Comparison of clinical manifestations,laboratory results and treatment in SLE patients with different serum NE levels[±s,M(Q1,Q3),n(%)]
Items Female/Male Age/year Course of disease/month Skin and mucosa damage Arthritis Kidney damage Hematological abnormalities Anti-nuclear antibody Anti-dsDNA antibody Anti-Sm antibody Anti-nRNP antibody Anti-SSA antibody Anti-SSB antibody Anti-nucleosome antibody Anti-ribosomal P protein antibody C3 level/(mg·L-1)C4 level/(mg·L-1)SLEDAI score Glucocorticoid Hydroxychloroquine Immunosuppressant Different NE levels groups/(ng·ml-1)≥116.6(n=23)23/0 33.7±6.8 40(19,67)5(26.1)6(26.1)5(21.7)15(65.2)23(100)13(56.5)5(21.7)12(52.2)19(82.6)8(34.8)9(39.1)13(56.5)623.9±175.6 118.5±59.2 6(4,9)16(69.6)20(87.0)22(95.7)<116.6(n=43)43/0 32.2±6.5 26(16,40)6(11.6)6(14.0)6(14.0)20(46.5)43(100)14(32.6)9(20.9)21(48.8)30(69.8)6(14.0)7(16.3)9(20.9)712.3±181.2 173.2±75.2 3(2,6)22(51.2)41(95.3)38(88.4)χ2/t/Z-0.314-1.521 1.335 0.779 0.214 2.105-3.560 0.000 0.067 1.292 2.744 4.261 8.542-1.907-3.022-2.892 2.078 0.547 0.282 P>0.05 0.755 0.128 0.248 0.377 0.644 0.147 NS 0.059 1.000 0.796 0.256 0.098 0.039 0.003 0.061 0.004 0.004 0.149 0.460 0.595
表2 不同血清CG水平SLE患者临床表现、实验室检查结果和治疗情况比较[±s,M(Q1,Q3),例(%)]Tab.2 Comparison of clinical manifestations,laboratory results and treatment in SLE patients with different serum CG levels[±s,M(Q1,Q3),n(%)]
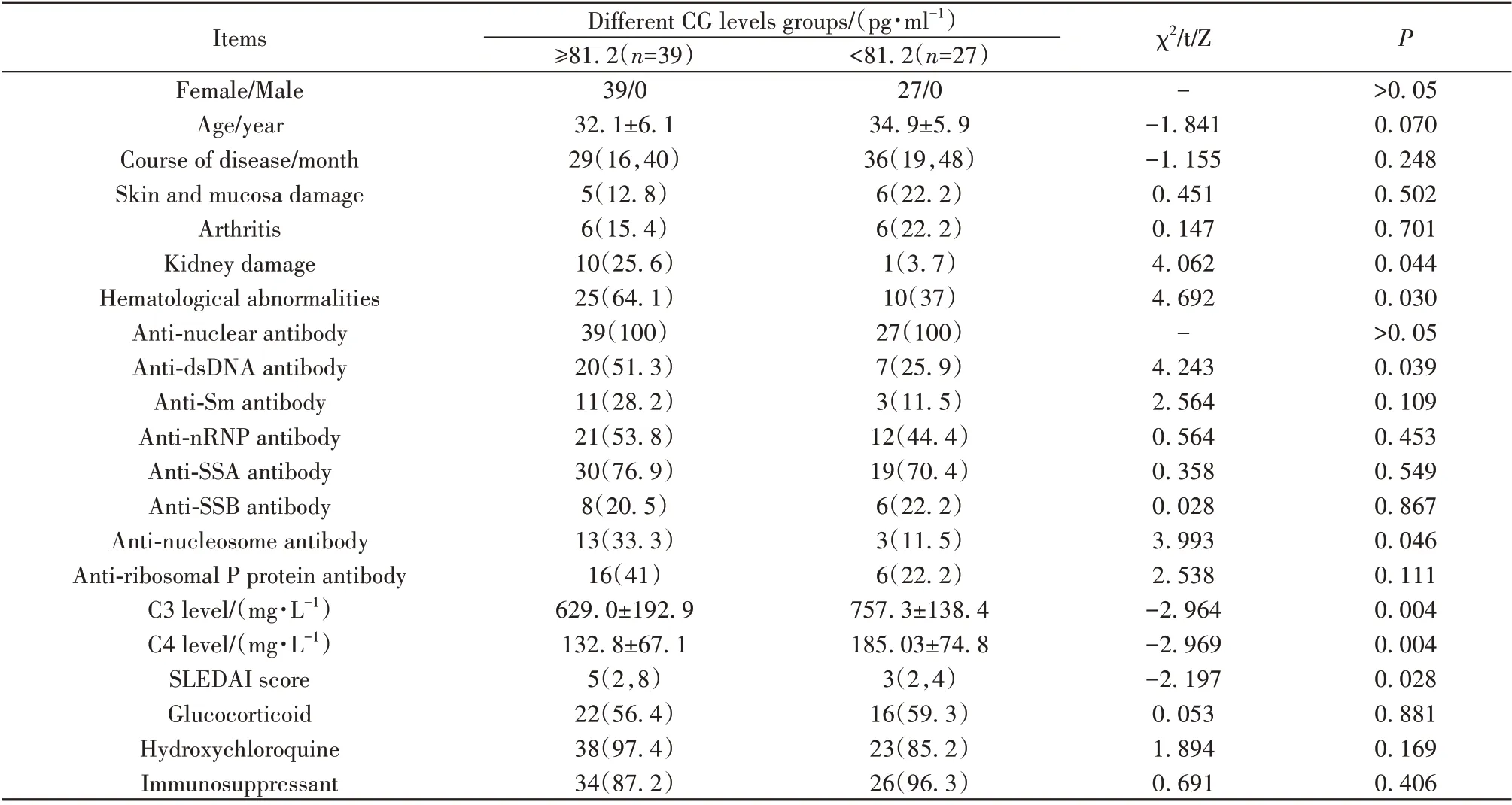
表2 不同血清CG水平SLE患者临床表现、实验室检查结果和治疗情况比较[±s,M(Q1,Q3),例(%)]Tab.2 Comparison of clinical manifestations,laboratory results and treatment in SLE patients with different serum CG levels[±s,M(Q1,Q3),n(%)]
Items Female/Male Age/year Course of disease/month Skin and mucosa damage Arthritis Kidney damage Hematological abnormalities Anti-nuclear antibody Anti-dsDNA antibody Anti-Sm antibody Anti-nRNP antibody Anti-SSA antibody Anti-SSB antibody Anti-nucleosome antibody Anti-ribosomal P protein antibody C3 level/(mg·L-1)C4 level/(mg·L-1)SLEDAI score Glucocorticoid Hydroxychloroquine Immunosuppressant Different CG levels groups/(pg·ml-1)≥81.2(n=39)39/0 32.1±6.1 29(16,40)5(12.8)6(15.4)10(25.6)25(64.1)39(100)20(51.3)11(28.2)21(53.8)30(76.9)8(20.5)13(33.3)16(41)629.0±192.9 132.8±67.1 5(2,8)22(56.4)38(97.4)34(87.2)<81.2(n=27)27/0 34.9±5.9 36(19,48)6(22.2)6(22.2)1(3.7)10(37)27(100)7(25.9)3(11.5)12(44.4)19(70.4)6(22.2)3(11.5)6(22.2)757.3±138.4 185.03±74.8 3(2,4)16(59.3)23(85.2)26(96.3)χ2/t/Z--1.841-1.155 0.451 0.147 4.062 4.692-4.243 2.564 0.564 0.358 0.028 3.993 2.538-2.964-2.969-2.197 0.053 1.894 0.691 P>0.05 0.070 0.248 0.502 0.701 0.044 0.030>0.05 0.039 0.109 0.453 0.549 0.867 0.046 0.111 0.004 0.004 0.028 0.881 0.169 0.406
表3 不同血清PR3水平SLE患者临床表现、实验室检查结果和治疗情况比较[±s,M(Q1,Q3),例(%)]Tab.3 Comparison of clinical manifestations,laboratory results and treatment in SLE patients with different serum PR3 levels[±s,M(Q1,Q3),n(%)]

表3 不同血清PR3水平SLE患者临床表现、实验室检查结果和治疗情况比较[±s,M(Q1,Q3),例(%)]Tab.3 Comparison of clinical manifestations,laboratory results and treatment in SLE patients with different serum PR3 levels[±s,M(Q1,Q3),n(%)]
Items Female/Male Age/year Course of disease/month Skin and mucosa damage Arthritis Kidney damage Hematological abnormalities Anti-nuclear antibody Anti-dsDNA antibody Anti-Sm antibody Anti-nRNP antibody Anti-SSA antibody Anti-SSB antibody Anti-nucleosome antibody Anti-ribosomal P protein antibody C3 level/(mg·L-1)C4 level/(mg·L-1)SLEDAI score Glucocorticoid Hydroxychloroquine Immunosuppressant Different PR3 levels groups/(ng·ml-1)≥2.2(n=48)48/0 31.7±6.1 30(15,40)9(18.8)12(25)10(20.8)29(60.4)48(100)22(45.8)9(18.8)23(47.9)37(77.1)13(27.1)15(31.3)17(35.4)673.4±186.8 152.1±74.1 5(3,8)28(58.3)44(91.7)44(91.7)<2.2(n=18)18/0 34.2±7.4 39(21,67)2(11.1)0(0)1(5.6)6(33.3)18(100)5(27.8)5(27.8)10(55.6)12(66.7)1(5.6)1(5.6)5(27.8)703.1±175.5 159.6±76.9 3(2,4)10(55.6)17(94.4)16(88.9)χ2/t/Z--1.396-1.383 0.137 3.948 1.238 3.855-1.765 0.212 0.306 0.298 2.456 3.411 0.344-0.584-0.359-1.307 0.041 0.000 0.000 P>0.05 0.168 0.167 0.711 0.047 0.266 0.050>0.05 0.184 0.645 0.580 0.585 0.117 0.065 0.558 0.561 0.721 0.191 0.839 1.000 1.000
3 讨论
SLE 是常见的自身免疫性疾病,其病因尚不清楚,发病机制极为复杂,尚未阐明。通常认为具有遗传背景的个体在环境、性激素及感染等因素共同作用下引起机体免疫功能异常、诱导T 细胞及B 细胞异常分化、自身抗体产生、免疫复合物形成及其在各组织沉积,导致SLE 发生和进展。近年研究显示NSPs可能作为自身抗原产生自身抗体,以及通过介导多种炎症因子促进炎症性病变,参与SLE 病理过程。
NSPs是主要表达于中性粒细胞的蛋白水解酶,正常生理情况下储藏于胞质颗粒,包括NE、CG、PR3以及中性粒细胞丝氨酸蛋白酶4(neutrophil serine proteases 4,NSP4)。NSP4 是继NE、CG 及PR3 之后在中性粒细胞中发现的第4 种丝氨酸蛋白酶,于2012 年由PERERA 等[9]发现并命名,由于其含量极少,约为CG含量的5%,相关报道极为少见且不易检测,故本研究仅探讨NE、CG和PR3。NSPs的重要生物学功能一直被认为是降解组织和杀灭微生物,但生化技术的发展有助于识别新的NSPs 底物和途径,新近发现NSPs 介导的功能范围非常广泛,在自身免疫、代谢和癌症中也起重要作用[5]。
本研究显示,SLE患者血清NE、CG、PR3水平均显著高于健康对照组,表明NSPs在SLE 中具有重要意义。NE 在SLE 中的作用与中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)密切相关。NETs由中性粒细胞产生,由染色质及附着其上的颗粒蛋白组成网状结构。大量研究显示,SLE 患者体内NETs 生成更多,不仅作为自身抗原的重要来源之一产生自身抗体,还可刺激低密度粒细胞(low density granulocytes,LDG)、内皮细胞和浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)等细胞产生炎症因子,从而参与SLE 发病过程[10-11]。而NE是NETs 中第二丰富的蛋白。中性粒细胞一旦激活,NE 就会从嗜天青颗粒中逃逸出来,移位至细胞核,部分降解特定的组蛋白,从而促进染色质解聚,解聚的染色质与颗粒蛋白构成网状结构,即为NETs,提示NE 对NETs 形成至关重要[12]。NE 抑制剂,如SLPI 和Serpin B1,在体外和体内均会限制NETs 生成,间接说明NE 对NETs 形成至关重要[13-14]。除在NETs 形成中的积极作用外,NE 还可装饰NETs,并在这种环境中具有蛋白水解活性。此外,NE 对中性粒细胞效应功能非常重要,可直接介导中性粒细胞脱颗粒时的组织损伤[5]。因此,NE 及NE依赖的NETs生成和中性粒细胞效应功能可改变SLE 免疫系统组成或病理过程,在SLE 发生发展中起重要作用。但NE 在SLE 发生发展中的具体机制尚不明确。如一项动物实验中,敲除SLE 的MRL.Faslpr小鼠模型NE 基因后,NE 减少,进而发展为NE依赖的NETs缺乏,但SLE的肾炎、皮疹、抗自身抗体或免疫成分并未受影响[15]。与既往对NE、NETs 和中性粒细胞在SLE 中的致病作用的认识不符,其作用机制有待深入研究。TAMIYA 等[16]研究发现,活动期SLE 患者血清CG 水平明显高于非活动期患者和健康对照组,糖皮质激素治疗后迅速下降,与本研究结论一致。Papillon-Lefévre 综合征患者中,组织蛋白酶C(CTSC)基因突变导致中性粒细胞中大量表达,负责NSPs 激活的CTSC 活性完全丧失,NSPs 活动停止,无法产生NETs,表明CG 对NETs 形成是必要的[17]。CG 在SLE 中也可通过NETs发挥作用。研究表明,CG在部分自身免疫性疾病发生发展中起重要作用。虽然具体作用需进一步阐明,但可能涉及免疫细胞激活和免疫应答,通过诱导淋巴因子产生促进T细胞依赖的细胞免疫和抗原特异性抗体产生[18]。推测CG 在SLE 中也可能通过上述机制发挥作用。PR3 在NSPs 中有一定特异性,作为抗中性粒细胞胞质抗体(antineutrophil cytoplasmic anti⁃body,ANCA)的主要靶抗原之一,参与ANCA 相关性血管炎发病机制,尤其中性粒细胞通过与PR3-ANCA相互作用产生的自身免疫激活在肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)中起核心作用[19]。SLE中的ANCA 多为MPO-ANCA 低滴度阳性,偶有SLE 中PR3-ANCA 阳性的报道[20-21]。NETs可能参与SLE 患者PR3-ANCA 生成,但PR3-ANCA在SLE 患者中的致病作用尚未阐明,进一步研究PR3-ANCA 与SLE 的关系可能有助于阐明其在结缔组织疾病中的作用机制。
SLEDAI评分是判断SLE严重程度的有效指标。本研究显示,SLE患者体内3种NSPs水平均与SLEDAI评分呈正相关,因此推测NSPs 与SLE 严重程度相关。进一步分析不同血清NE、CG、PR3 水平SLE 患者的临床表现、实验室检查结果和治疗情况发现,血清NE 水平升高的SLE 患者C4 水平更低,SLEDAI评分更高,抗核小体抗体及抗核糖体P 蛋白抗体阳性率升高;血清CG水平升高的SLE患者更易发生肾损伤,血液学异常发生率明显升高,SLEDAI 评分更高,C3、C4 水平更低,同时抗dsDNA 抗体和抗核小体抗体阳性率升高;血清PR3 水平升高的SLE 患者更易发生关节炎。SLE 患者中升高的NSPs 与SLE患者临床表现、自身抗体、疾病活动度评分密切相关,进一步说明NSPs在SLE 发生和病情进展中具有重要作用。值得一提的是,虽然3 组不同NSPs 水平SLE 患者对比中,部分临床表现和重要自身抗体阳性率虽有升高趋势,但差异无统计学意义,可能与样本量限制有一定关系,且为排除大剂量皮质激素对中性粒细胞的影响,本研究中SLE 患者疾病活动度评分偏低,无法排除其对结果产生一定影响。此外,本研究未收集到肺、浆膜、神经系统、消化等有关系统受累的病例,SLE 患者NSPs 水平与SLE 临床特征的关系需进一步研究。
综上所述,SLE 是一种育龄期高发的自身免疫性疾病,NSPs 在SLE 发病机制中的作用不容忽视,了解NSPs 和免疫功能相互作用的生理学过程可能为SLE 治疗提供新的途径。本研究提示SLE 患者NSPs 水平升高,且与疾病活动度相关。在此基础上,课题组将进一步研究SLE 患者体内NSPs增加的原因,以及增加的NSPs如何参与SLE病理过程。