白细胞介素37 过表达促进急性心肌梗死患者外周血内皮祖细胞的增殖和迁移①
2022-07-21李传荣赵子明董加建崔留义
李传荣 赵子明 陈 俭 董加建 崔留义
(郑州市第七人民医院,郑州市心血管病医院心内科,郑州 450000)
世界卫生组织数据显示,心血管疾病在全球均是致死的主要原因。在欧洲,每年有超过400 万人因心血管疾病死亡,约占所有死亡人数的45%,其中冠心病占20%[1]。在美国,2015 年有超过270 万人死于心血管疾病,其中44%死于冠心病[2]。在中国大陆,2015 年冠心病的病死率为110/100 000,且此比例仍在逐年上升[3]。急性心肌梗死(acute myocardial infarction,AMI)是冠心病中最危险和最致命的一种类型[4]。发生AMI后骨髓中的内皮祖细胞(endothelial progenitor cells,EPCs)会动员至外周血,然后外周血EPCs向缺血心脏归巢并分化为成熟的内皮细胞,启动血管新生过程来修复损伤[5]。已有研究显示,与健康人相比,AMI 患者EPCs 的增殖和迁移能力减弱,提高EPCs的增殖和迁移能力能够改善梗死后的血管新生和心肌功能[6-7]。白细胞介素(interleukin,IL)-37 是重要的抗炎因子,其在冠心病患者血清中表达升高,且表达量与疾病的严重程度呈正相关[8]。但IL-37 与AMI 患者EPCs 的关系目前尚无相关报道。因此,本研究探究IL-37 对AMI患者外周血EPCs 增殖和迁移的影响和可能的分子机制。
1 资料与方法
1.1 资料
1.1.1 纳入对象 收集2019 年3 月在郑州市第七人民医院新确诊的6 例AMI 患者外周静脉血各10 ml,患者年龄为30~67 岁。患者纳入标准:既往具有冠心病史,冠脉造影检查至少具有1 支冠脉的狭窄程度>50%;具有典型的胸痛史,胸痛至少持续15 min;心电图检查具有2个或2个以上的相邻导联ST 段抬高或压低、出现病理性Q 波;肌酸激酶同工酶、肌钙蛋白等血清心脏标志物活性较正常值至少增加2倍。排除指标:3周内接受过大手术或受过外伤;心力衰竭和严重的心脏瓣膜疾病;严重的全身性疾病、慢性肾病、肝病、恶性肿瘤、炎症性疾病;既往有精神疾病病史、认知功能障碍。另外收集同期进行体检的年龄、性别和身体质量指数差异均无统计学意义的6例健康志愿者的外周静脉血各10 ml。
1.1.2 主要试剂 Ficoll Paque PLUS 淋巴细胞分离液购自美国GE 公司;胎牛血清、人纤维连接蛋白、青霉素/链霉素、胰蛋白酶购自美国Gibco 公司;内皮细胞培养基购自美国Life technology;CCK-8 试剂盒、ECL 试剂和RIPA 裂解液购自上海碧云天;BCA 蛋白浓度测定试剂盒、辣根过氧化物酶标记的二抗和1,1'-双十八酯基-3,3,3,3,四甲基-吲哚碳菁高氯酸盐标记的乙酰化低密度脂蛋白(DiI-labeled acetylated low-density lipoprotein,DiI-Ac-LDL)购自北京索莱宝科技有限公司;RNAiso plus 购自大连宝生物工程有限公司;HiFiScript 快速去基因组cDNA第一链合成试剂盒和RealSYBR Mixture 试剂盒购自北京康为世纪;Lipofectamine3000 转染试剂、IL-37兔抗人多克隆抗体(1∶1 000)和荧光标记荆豆凝集素Ⅰ[fluorescein-labelled ulex europaeus agglutininⅠ(UEAⅠ),FITC-UEA-Ⅰ]购自美国Thermo Fisher Scientific 公司;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)兔多克隆抗体、基质金属蛋白酶(matrix metalloproteinase,MMP)9 兔多克隆抗体、磷酸化Akt(phospho-Akt,p-Akt)兔单克隆抗体、Akt 兔单克隆抗体、磷酸化mTOR(p-mTOR)兔单克隆抗体、mTOR 兔单克隆抗体、磷酸化p70S6K 兔单克隆抗体(p-p70S6K)、p70S6K 兔单克隆抗体、磷酸化ERK1/2(p-ERK1/2)兔单克隆抗体和ERK1/2兔单克隆抗体购自美国Cell Signaling Technology 公司。
1.2 方法
1.2.1 EPCs 的分离和培养 根据文献[9]中的方法,从外周血单个核细胞中分离EPCs。使用Ficoll分离液将单个核细胞从AMI 患者和健康志愿者外周静脉血中分离出来。无菌磷酸盐缓冲液洗涤3次后300 g 离心10 min。将收集的细胞接种至包被有10 mg/L人纤维连接蛋白的60 mm 细胞培养皿,加入5 ml 内皮细胞培养基(含5 mmol/L D-葡萄糖、20%胎牛血清、3.0 mg/L 内皮细胞生长补充剂、100 kU/L青霉素和100 mg/L 链霉素)。在37 ℃、5%CO2细胞培养箱中培养4 d,去除未贴壁细胞并换成新鲜的细胞培养液,然后置于细胞培养箱中继续培养,每3 d换1 次培养基。待细胞达到80%左右融合时,胰蛋白酶消化后按1∶3 比例传代。参考文献[10],用DiI-Ac-LDL 和FITC-UEA-Ⅰ免疫荧光双标鉴定培养的细胞为EPCs。后续实验选择第3~6代细胞。
1.2.2 AMI患者外周血EPCs的分组和处理 将接种后充分贴壁的AMI 患者外周血EPCs 随机分为3 组:对照组、pcDNA3.1 组和IL-37 组。其中对照组不进行任何处理,pcDNA3.1 组和IL-37 组分别使用Lipofectamine3000 试剂转染pcDNA3.1 质粒和构建的pcDNA3.1-IL-37质粒。
1.2.3 细胞活性检测 将2×103个AMI 患者外周血EPCs 接种于96 孔板,待细胞充分贴壁后,根据
1.2.2 方法将细胞分组,分别在转染0 h、24 h、48 h和72 h时每孔加入10µl CCK-8溶液,37 ℃培养2 h。用酶标仪检测各孔吸光度值,波长设置为450 nm。
1.2.4 细胞迁移检测 使用24孔板的Transwell小室进行EPCs 的迁移检测。胰蛋白酶消化未转染或转染pcDNA3.1/pcDNA3.1-IL-37 质粒24 h 的EPCs,并将2×104个细胞接种于上室,加入200µl不含血清的内皮细胞培养基;下室加入600µl 含20%胎牛血清的内皮细胞培养基。在细胞培养箱中孵育48 h,用棉签将膜上表面未迁移的细胞擦去,多聚甲醛固定30 min,结晶紫染色10 min。显微镜拍摄迁移过膜的细胞,并计算各组细胞数目。
1.2.5 RNA 提取和qRT-PCR 转染72 h 后,按照RNAiso Plus 说明书提取各组细胞总RNA。取1 µg总RNA 去除基因组DNA,逆转录为cDNA。以1 µl cDNA 为模板,设置25 µl qRT-PCR 反应体系:正反向引物各1µl,12.5µl RealSYBR Mixture,ddH2O 补足至25 µl。按照以下程序进行PCR 反应:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火和延伸1 min,共40 个循环。IL-37 正向引物:5'-GCTTAGAAGACCCGGCTGGAAG-3',反向引物:5'-GCAAAGAA⁃GATCTCTGGGCGTA-3';MMP9 正向引物:5'-TTC⁃CAAACCTTTGAGGGCGA-3',反向引物:5'-CTGTA⁃CACGCGAGTGAAGGT-3'。GAPDH 正向引物:5'-CACGGATTTGGTCGTATTGGGC-3',反向引物:5'-CTGATTTTGGAGGGATCTCGCC-3'。以GAPDH 为内参,使用2-ΔΔCt计算目的基因的相对表达量。
1.2.6 Western blot 蛋白检测 收集各组细胞,用含1 mmol/L PMSF 的RIPA 裂解液提取细胞总蛋白,BCA 试剂盒测定蛋白浓度。取等量各样品总蛋白行SDS-PAGE 分离不同分子量的蛋白,然后转移至PVDF 膜。5%脱脂奶粉封闭2 h 后加入一抗,包括IL-37(1∶1 000)、PCNA(1∶1 000)、MMP9(1∶1 000)、p-Akt(1∶800)、Akt(1∶1 000)、p-mTOR(1∶800)、mTOR(1∶800)、p-p70S6K(1∶800)、p70S6K(1∶800)、p-ERK1/2(1∶1 500)和ERK1/2(1∶1 500),4 ℃过夜孵育,然后加入二抗室温孵育1 h。最后进行ECL显色。Image J 软件分析条带的净光密度值,以β-actin为内参,计算目的蛋白相对表达量。
2 结果
2.1 IL-37 在AMI 患者外周血EPCs 中高表达 荧光显微镜观察所分离培养的细胞,发现细胞呈现出DiI-Ac-LDL 和FITC-UEA-Ⅰ双阳性(图1A),表明成功分离并培养出了EPCs。检测IL-37在健康志愿者和AMI患者外周血EPCs中的表达,结果见图1B、C:与健康志愿者相比,IL-37 mRNA 和蛋白水平在AMI患者EPCs中均升高(P<0.01)。
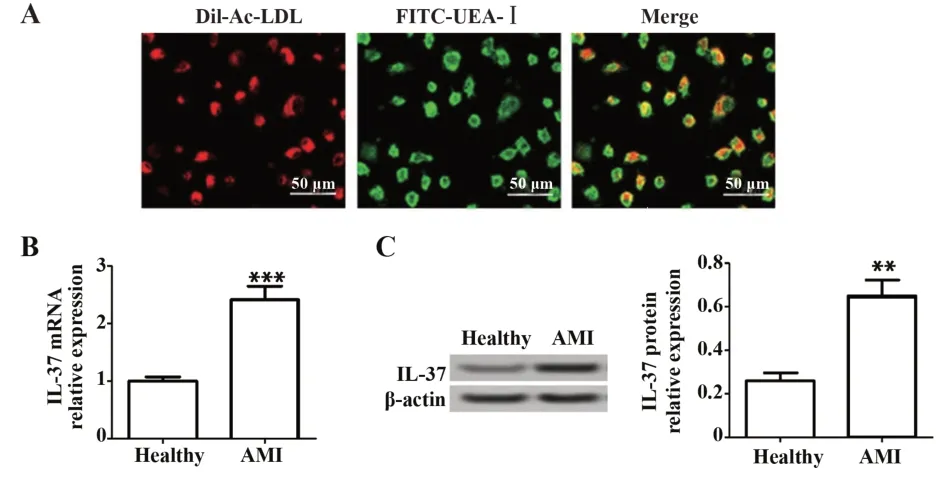
图1 IL-37在AMI患者外周血EPCs中高表达Fig.1 IL-37 expression was elevated in peripheral blood EPCs in patients with AMI
2.2 IL-37 过表达可促进AMI 患者EPCs 增殖Western blot 结果表明,与对照组相比,IL-37 在IL-37 组中表达升高(P<0.001),在pcDNA3.1 组中表达差异无统计学意义(P>0.05),见图2A、B;与对照组相比,IL-37 组中PCNA 蛋白表达增加(P<0.001),pcDNA3.1组中PCNA 表达差异无统计学意义(P>0.05),见图2A、C。CCK-8 检测细胞活力,结果见图2D,与对照组相比,IL-37 组中细胞活力增加(P<0.01),pcDNA3.1 组中细胞活力差异无统计学意义(P>0.05)。
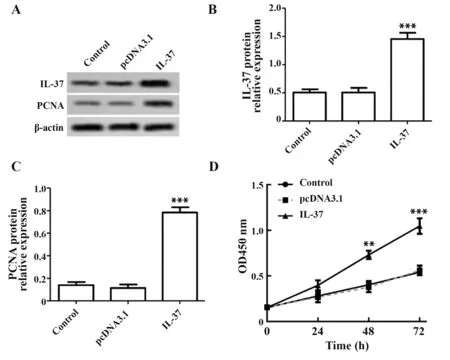
图2 IL-37过表达可促进AMI患者EPCs增殖Fig.2 IL-37 overexpression promotes proliferation of EPCs from patients with AMI
2.3 IL-37过表达可促进细胞迁移 Transwell检测各组细胞迁移,结果见图3A,与对照组相比,IL-37组中迁移细胞数目增加(P<0.001),pcDNA3.1 组中迁移细胞数目差异无统计学意义(P>0.05);检测MMP9 蛋白和mRNA 表达,结果见图3B、C,与对照组相比,IL-37 组中MMP9 蛋白和mRNA 表达均上调(P<0.001),pcDNA3.1 组中MMP9 蛋白和mRNA 表达差异无统计学意义(P>0.05)。
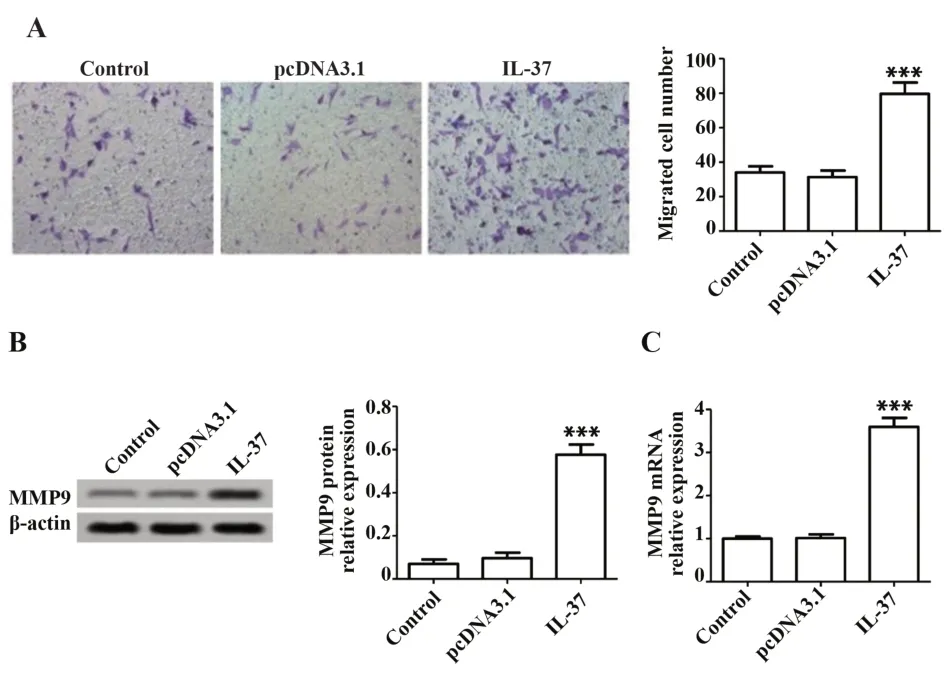
图3 IL-37过表达可促进AMI患者EPCs迁移Fig.3 IL-37 overexpression promotes migration of EPCs from patients with AMI
2.4 IL-37过表达对Akt/mTOR 和ERK1/2通路的影响 Western blot 检测Akt/mTOR 和ERK1/2 通路相关蛋白表达,结果如图4 所示:与对照组相比,IL-37组中p-Akt/Akt、p-mTOR/mTOR 和p-p70S6K/p70S6K均增加(P<0.05 或P<0.01),pcDNA3.1 组中以上指标差异无统计学意义(P>0.05);与对照组相比,p-ERK1/2/ERK1/2在IL-37组和pcDNA3.1组中差异均无统计学意义(P>0.05)。
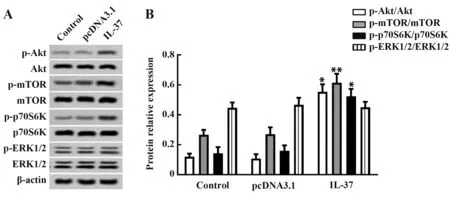
图4 IL-37过表达对Akt/mTOR和ERK1/2通路的影响Fig.4 Effect of IL-37 overexpression on activation of Akt/mTOR and ERK1/2 signaling pathways
3 讨论
IL-37是IL-1家族成员,在许多炎症性疾病中发挥抗炎作用[11-12]。IL-37 在动脉粥样硬化斑块中表达增加,过表达IL-37 可减少动脉粥样硬化斑块扩张[13]。研究报道IL-37 在心衰、动脉粥样硬化和急性冠状动脉综合征患者血清中的表达均增加[12]。XU 等[14]的研究显示,在AMI 小鼠中过表达IL-37 可通过减少左室短轴缩短率改善心肌功能。但目前IL-37与AMI患者EPCs的关系尚未见相关报道。本研究发现,与健康志愿者相比,IL-37 在AMI 患者外周血EPCs 中表达上调,表明IL-37 与AMI 患者的EPCs可能存在某种联系。
近年来,心血管疾病的相关研究越来越多的聚焦于EPCs。心血管疾病中EPCs 的增殖和迁移能力受损,因此,如何增加其增殖和迁移能力是治疗心血管疾病的一个重要方向[6,15]。AMI患者EPCs的增殖和迁移能力减弱,因此提高此类型患者EPCs的增殖和迁移能力为AMI 的治疗提供了方向。本研究发现过表达IL-37能增加AMI患者外周血EPCs的细胞活力。PCNA 是协助DNA 复制的DNA 滑动钳家族成员,是细胞增殖的标志物之一[16]。本研究结果显示,过表达IL-37 明显增加了EPCs 中PCNA 的蛋白表达。Transwell 实验发现IL-37 过表达显著增加了EPCs 迁移细胞数目。MMPs 是锌离子依赖的蛋白酶家族,至少包括20 个成员,能够降解所有已知的细胞外基质成分,可调节细胞迁移。MMP9 是MMPs 家族成员,在组织缺血后表达上调,且在缺血条件下可通过促进细胞迁移启始血管生成[17]。本研究进一步探究了IL-37对MMP9表达水平的影响。结果显示IL-37 过表达明显增加了MMP9 mRNA 和蛋白表达,表明IL-37 过表达能增强AMI 患者外周血EPCs的增殖和迁移。
Akt/mTOR和ERK1/2通路被普遍认为是细胞增殖和迁移的启动因子,EPCs的增殖和迁移也与这两条通路的活化有关[15,18-19]。已有研究显示IL-37在肝癌中通过抑制Akt/mTOR 通路从而抑制肝癌细胞生长[20],但IL-37 通过激活Akt 通路促进骨髓间充质干细胞的成骨分化[21],表明IL-37 在不同疾病中对Akt通路的作用不同。此外,IL-37 可抑制ERK1/2 通路缓解尘螨诱导的小鼠慢性过敏性哮喘[22]。因此,本研究中进一步探究了IL-37 与Akt/mTOR 和ERK1/2通路的关系。结果显示,IL-37 过表达明显增加了Akt 和mTOR 的磷酸化以及mTOR 下游p70S6K 的磷酸化,但对ERK1/2 的磷酸化水平影响不大。提示在AMI 患者外周血EPCs 中,IL-37 过表达可激活Akt/mTOR通路,但对ERK1/2通路没有影响。总之,本研究表明IL-37 过表达能够增加AMI 患者外周血EPCs 的增殖和迁移,这可能是通过激活Akt/mTOR通路发挥作用的。在探究IL-37 的作用时,本文仅从IL-37 过表达的角度探究了IL-37 对AMI 患者外周血EPCs 增殖和迁移的影响,而未考虑下调IL-37表达的影响,这是本研究的一个不足之处,课题组将对其进行进一步研究。
