基于“部位扣除”的黄芪温热效应导致“上火”反应的物质基础及机制研究
2022-07-21曹丽珑赵婷婷于子涵吴陈成邵翔宇张朔生王颖莉胡美变
曹丽珑,裴 科*,刘 瑞,宁 燕,赵婷婷,于子涵,吴陈成,邵翔宇,张朔生,王颖莉,胡美变,蔡 皓
• 药理与临床 •
基于“部位扣除”的黄芪温热效应导致“上火”反应的物质基础及机制研究
曹丽珑1,裴 科1*,刘 瑞1,宁 燕2,赵婷婷1,于子涵1,吴陈成1,邵翔宇1,张朔生1,王颖莉1,胡美变1,蔡 皓3*
1. 山西中医药大学中药与食品工程学院,山西省现代中药工程实验室,山西 晋中 030619 2. 浙江中医药大学药学院,中药炮制研究中心,浙江 杭州 310053 3. 南京中医药大学药学院,国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023
探讨黄芪温热效应引起“上火”反应的物质基础及机制。对黄芪水煎液中黄酮和皂苷部位进行分离,采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱对已分离部位进行成分鉴别;将SD大鼠随机分为8组,分别给予蒸馏水及相应药物。以《中国药典》规定的日服剂量的4倍进行ig给药,连续30 d。观察大鼠状态,测定肛温、摄食量、粪便量、粪便含水量和唾液量;测定炎症因子、甲状腺功能、肾上腺功能与能量代谢的相关指标;检测各组肝脏中单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase,)、过氧化物酶体增殖激活受体辅助活化因子-1α(peroxisome proliferator-activated-recptor-γ coactivator-1α,)、核呼吸因子1(nuclear respiratory factor 1,)、线粒体转录因子A(mitochondrial transcription factor A,)的mRNA和蛋白表达量。多糖、黄酮和皂苷部位的分离度良好,多糖质量分数大于50%,皂苷、黄酮部位质量分数均大于80%,共鉴别出21种黄酮类成分和6种皂苷类成分。给药后与对照组相比,各组别大鼠体质量无显著差异;全成分组肛温明显升高(<0.05);全成分组、多糖组粪便含水量显著降低(<0.05、0.01),缺皂苷组粪便含水量显著升高(<0.001);第28天唾液量多糖组、皂苷组、缺黄酮组显著降低(<0.001);全成分组、多糖组、皂苷组和缺多糖组肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平显著升高(<0.05、0.01、0.001),多糖组白细胞介素-6(interleukin-6,IL-6)水平显著升高(<0.01),全成分组IL-1β水平显著升高(<0.05);各组17-羟皮质类固醇(17-hydroxycorticosteroid,17-OHCS)含量均有上调趋势,其中全成分组、多糖组、皂苷组、缺多糖组和缺黄酮组有显著性差异(<0.05、0.01);全成分组、缺皂苷组与缺黄酮组的Ca2+, Mg2+-ATP酶活力与Na+, K+-ATP酶活力升高,全成分组和多糖组琥珀酸脱氢酶(succinate dehydrogenase,SDH)活力显著增加(<0.05、0.01)。各组对、、、的mRNA和蛋白表达水平均有上调趋势,其中全成分组和多糖组的上调趋势优于其余各组。过量食用黄芪导致“上火”可能与多糖及皂苷部位引起的炎症反应、能量代谢增强有关,其机制与AMPK介导的PGC-1α/NFR1通路相关,其中多糖的影响较大。
黄芪;“上火”反应;超高效液相色谱-四极杆-静电场轨道阱高分辨质谱;能量代谢;单磷酸腺苷活化蛋白激酶通路
“上火”是中医学的一种俗称,其基本病机为阴阳失调,阳胜则热。中医学认为“上火”是在机体受到“邪气”侵袭后,引起机体出现一系列以“热证”为表现的症状。咽喉肿痛、目赤干涩、牙龈发炎、口腔溃疡、小便短赤、大便秘结等为“上火”的典型症状[1]。
黄芪为豆科植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao或膜荚黄芪(Fisch.) Bge.的干燥根,其味甘,性温,归肺、脾经。黄芪作为一种大宗药材和人们经常以各种方式食用的保健品,具有广泛的应用前景和药理活性[2-3],但长期过量食用黄芪产生的不良反应少被讨论。由于黄芪性温热,过量进补黄芪可能会导致“上火”症状,且黄芪常用来构建“上火”或实热动物模型[4]。由于“上火”缺乏客观量化的诊断指标,因此应用现代技术揭示“上火”的生物学标志及导致“上火”的物质基础具有重要意义[5]。本研究在中医对“上火”认识的基础上,运用现代生物学技术,开展对过量食用黄芪引发“上火”的机制研究,拟为黄芪保健品的开发提供参考依据。
中药中化学成分复杂,同类的不同成分之间在体内也可能存在相互转化的现象,因此通过成分“敲除”的方法来进行功效的验证难以达到理想的效果。基于此,本研究以黄芪为例,进行了某个“部位”即某类成分的“扣除”,目的是排除“成分敲除”时结构相近的成分在体内转化造成的影响,通过“部位扣除”并结合单个部位给药进行黄芪温热效应引起“上火”的物质基础验证。黄芪主要含有多糖类、皂苷类、黄酮类等成分[6]。本研究首先对黄芪水煎液进行了部位分离,运用醇沉法分离多糖。由于黄酮类成分含量相对较低,且黄酮部位和皂苷部位极性非常相近,加大了分离的难度[7]。本研究根据文献报道的树脂分离技术[8-9],比较了2种方法对黄芪水煎液中黄酮类和皂苷类成分的富集和分离程度,建立了1种快速有效的部位分离方法,并且采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)对所分离的2个部位中化学成分进行鉴别。最后将分离所得各个部位ig给药,从大鼠的一般状态、炎症、甲状腺和肾上腺功能、能量代谢和单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)通路等方面进行指标检测,为揭示黄芪导致“上火”的物质基础和通路机制提供参考。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(150±10)g,4周龄,购自斯贝福(北京)生物技术有限公司,实验动物许可证编号SCXK(京)2019-0010,合格证号No.110324210103867371。环境温度保持在(23±2)℃,相对湿度保持在40%~70%。动物实验经山西中医药大学实验动物伦理委员会批准(批准号AWE202103001)。
1.2 药材
黄芪药材(批号200802)购自山西维康堂中药饮片有限公司,经山西中医药大学中药与食品工程学院山西省现代中药工程实验室张朔生教授鉴定为豆科植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao的干燥根。
1.3 药品与试剂
对照品黄芪甲苷(批号ST00160120,质量分数98%)、芒柄花苷(批号ST08800120,质量分数98%)、芒柄花素(批号ST00260120,质量分数98%)、毛蕊异黄酮葡萄糖苷(批号ST08820120,质量分数98%)均购自上海诗丹德标准服务技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号202108)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(批号202108)、IL-6 ELISA试剂盒(批号202108)、三碘甲腺原氨酸(triiodothyronine,T3)ELISA试剂盒(批号202108)、四碘甲状腺原氨酸(tetraiodothyronine,T4)ELISA试剂盒(批号202108)、大鼠血清促甲状腺素(thyroid stimulating hormone,TSH)ELISA试剂盒、大鼠血清促甲状腺激素释放激素(thyrotropin-releasing hormone,TRH)ELISA试剂盒(批号202108)、17-羟皮质类固醇(17-hydroxycorticosteroid,17-OHCS)ELISA试剂盒(批号202108)均购自上海泛柯实业有限公司;超微量Na+, K+-三磷酸腺苷(adenosine triphosphate,ATP)酶测试盒(批号20210830)、超微量Ca2+, Mg2+-ATP酶测试盒(批号20210830)、糖原测定试剂盒(批号20210827)、丙酮酸测试盒(批号20210826)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)试剂盒(批号20210830)、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(批号20210827)均购自南京建成生物工程研究所;AMPK抗体(批号ab32047)、磷酸化AMPK(phosphorylated AMPK,p-AMPK)抗体(批号ab133448)、过氧化物酶体增殖激活受体辅助活化因子-1α(peroxisome proliferator-activated-recptor-γ coactivator-1α,PGC-1α)抗体(批号ab188102)、核呼吸因子1(nuclear respiratory factor 1,NRF1)抗体(批号ab175932)、β-actin抗体(批号ab8227)均购自英国Abcam公司;线粒体转录因子A(mitochondrial transcription factor A,TFAM)抗体(批号8076)购自美国CST公司;HRP标记的羊抗兔二抗(批号A0208)购自上海碧云天生物技术有限公司;乙腈、甲醇均为质谱纯,水为超纯水,其余试剂均为分析纯。
1.4 仪器
UltiMate 3000型超高效液相色谱仪和Q-Exactive型四级杆-静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司);SpectraMax 190型全波长酶标仪(美国Molecular Devices公司);RIGOL Ultra-3660型紫外分光光度计(北京普源科技有限公司);ABI-7300型qRT-PCR仪(美国ABI公司);TG-16M型低温冷冻离心机(上海卢湘仪离心机仪器有限公司);Mini Protean 3 Cell电泳仪、TE77XP型电转仪(美国Bio-Rad公司);Tanon 5200型发光成像系统(上海天能科技有限公司);EX225D型十万分之一电子天平[奥豪斯仪器(上海)有限公司];HC-2518型高速离心机(安徽中科中佳科学仪器有限公司);XW-80A型旋涡混合器(海门市其林贝尔仪器制造有限公司);循环水式真空泵(巩义市予华仪器有限责任公司);旋转蒸发器(上海亚荣生化仪器厂);KQ2200E型超声波清洗器(昆山市超声仪器有限公司)。
2 方法
2.1 部位拆分工艺研究
2.1.1 黄芪提取液的制备 称取黄芪药材50 g,加8倍量水煎煮,4层纱布滤过,滤渣加6倍量水煎煮,合并2次滤液。减压浓缩至生药质量浓度为0.5 g/mL,用于2种方法的分离效果比较。称取一定量黄芪药材,按照比较所得的最优方法进行提取分离制得各个部位,用于ig给药。
2.1.2 对照品溶液的制备 分别精密称取黄芪甲苷、芒柄花苷、芒柄花素、毛蕊异黄酮葡萄糖苷对照品适量于10 mL量瓶中,加质谱级甲醇溶解并定容,制成质量浓度分别为0.26、0.22、0.23、0.18 mg/mL的储备液,将各储备液稀释100倍后经13 000 r/min离心15 min,取上清液,即得对照品溶液。
2.1.3 色谱条件 Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm)色谱柱,流动相为乙腈(A)-0.05%甲酸水溶液(B),梯度洗脱:0~0.5 min,5% A;0.5~1.5 min,5%~15% A;1.5~4.5 min,15%~30% A;4.5~7.0 min,30%~60% A;7.0~11.0 min,60%~70% A;11.0~12.0 min,70%~100% A;12.0~13.0 min,100% A;13.0~13.5 min,100%~5% A;13.5~16.0 min,5% A;体积流量为0.3 mL/min;进样量为1 μL;柱温为40 ℃。
2.1.4 质谱条件 采用电喷雾离子源(ESI),正、负离子同时采集。正离子模式下喷雾电压3.2 kV,鞘气流速为40 arb,辅助气流速为5 arb,辅助气加热温度350 ℃;负离子模式下喷雾电压2.5 kV,鞘气流速为38 arb,辅助气流速为10 arb,辅助气加热温度300 ℃。毛细管温度320 ℃,高压环形离子导入装置电压(S-Lens RF Level)为50。检测模式采用全扫描/数据依赖二级扫描(Full MS/dd-MS2),扫描范围为/100~1000,一级质量分辨率为70 000 FWHM,二级分辨率17 500 FWHM,碰撞能量为30 eV。
2.1.5 树脂的筛选与部位的拆分 首先通过醇沉得到多糖。将提取液减压浓缩后加入乙醇,依据参考文献方法[10-11]及后续分离实验中多糖、黄酮和皂苷的含量比较,最终调节乙醇体积分数至70%,于4 ℃静置12 h,分离上清液备用,沉淀恒温干燥后待测。比较聚酰胺树脂结合D101树脂法(方法1)和D101大孔树脂结合溶剂萃取法(方法2)对成分富集和分离的效果。
(1)方法1:将上清液采用聚酰胺树脂进行上样,上样后依次采用5倍和2倍柱体积的蒸馏水和5%乙醇进行洗脱,收集洗脱液备用(用于D101树脂上样),之后采用5倍柱体积的80%乙醇进行洗脱,收集洗脱液,浓缩干燥后得粉末,作为聚酰胺树脂的黄酮富集部位,即黄酮部位A。将备用洗脱液浓缩后采用D101树脂上样,上样后先用4倍柱体积蒸馏水进行除杂,继以80%乙醇进行洗脱,收集洗脱液,浓缩干燥后得到皂苷部位A。
(2)方法2:将上清液经D101大孔树脂上样后,依次用10倍柱体积蒸馏水洗脱糖类成分,再以5倍柱体积0.1% NaOH洗脱,继以5倍柱体积20%乙醇除色素,最后以5倍柱体积80%乙醇洗脱,收集洗脱液,经浓缩干燥后得粉末,作为大孔树脂的富集部位。精密称定100 mg该富集部位的粉末,蒸馏水溶解,按照体积比1∶5分别用醋酸乙酯、正丁醇萃取,萃取液浓缩蒸干后,分别得到黄酮部位B和皂苷部位B。
2.2 黄芪各部位纯度的测定
2.2.1 对照品溶液的制备 精密称定干燥至恒定质量的葡萄糖对照品适量,置于10 mL量瓶中,用蒸馏水溶解并稀释至刻度,定容,得质量浓度为0.115 mg/mL的葡萄糖对照品溶液。
精密称定干燥至恒定质量的黄芪甲苷对照品适量,置于10 mL量瓶中,甲醇溶解并稀释至刻度,定容,得质量浓度为0.70 mg/mL的黄芪甲苷对照品溶液。
精密称定干燥至恒定质量的毛蕊异黄酮葡萄糖苷对照品适量,置于10 mL量瓶中,甲醇溶解并稀释至刻度,定容,得质量浓度为0.14 mg/mL的毛蕊异黄酮葡萄糖苷对照品溶液。
2.2.2 标准曲线的制备 精密量取葡萄糖对照品溶液0.2、0.3、0.4、0.5、0.6 mL于刻度试管中,每管加入蒸馏水使其体积成为1 mL,滴加浓硫酸5 mL和5%苯酚溶液1 mL,充分振荡摇匀,待冷却至室温后于490 nm处测定吸光度(),以对照品质量浓度为横坐标(),为纵坐标(),绘制标准曲线。
精密量取黄芪甲苷对照品溶液0、0.1、0.2、0.3、0.4、0.5 mL,分别置于具塞玻璃试管中,水浴蒸干溶剂,加入0.2 mL 5%香草醛-冰醋酸溶液和0.8 mL高氯酸溶液,摇匀,置60 ℃水浴加热20 min,取出立即至冰水浴中冷却,加入5 mL冰醋酸溶液。以相应试剂空白随行测定,在560 nm处进行测定。以对照品质量浓度为横坐标(),为纵坐标(),绘制标准曲线。
精密量取毛蕊异黄酮葡萄糖苷对照品溶液0.1、0.2、0.3、0.4、0.5 mL,置于10 mL量瓶中,以甲醇为空白,在260 nm处进行测定。以对照品质量浓度为横坐标(),为纵坐标(),绘制标准曲线。
2.2.3 总多糖、总皂苷和总黄酮的含量测定 称取“2.1.5”项下得到的多糖部位、黄酮部位A、皂苷部位A、黄酮部位B、皂苷部位B粉末适量,精密称定,分别置于10 mL量瓶中,用甲醇溶解并稀释至刻度。分别按照“2.2.2”项下的方法,测定总多糖、总皂苷、总黄酮的质量浓度,并计算含量。
含量=浓度×稀释倍数/称样量
2.2.4 总黄酮部位和总皂苷部位成分的鉴别 通过TCMSP数据库以及CNKI、PubMed等网站查询国内外文献,根据XCalibur 4.0软件的精确相对分子质量、保留时间(R)、准分子离子峰及二级碎片离子信息进行鉴定,实际测得的相对分子质量与理论相对分子质量偏差应小于5×10−6。
按照上述最优方法拆分得到的黄酮部位和皂苷部位,称各部位取粉末适量,精密称定,置于10 mL量瓶中,用质谱级甲醇溶解并定容,得到质量浓度分别为2.86、2.31 mg/mL的总黄酮和总皂苷样品储备液,将储备液各稀释100倍后于13 000 r/min离心15 min,取上清液于进样小瓶中按照“2.1.3”和“2.1.4”项下方法进行测定。
2.3 动物实验
2.3.1 动物分组及给药 大鼠随机分为8组,每组12只。分别为对照组、黄芪水煎液全成分组、黄芪多糖组、黄芪皂苷组、黄芪黄酮组、缺多糖组、缺皂苷组和缺黄酮组。各组大鼠自由饮水及进食。黄芪水煎液全成分组按照《中国药典》2020年版规定的成人日服最高剂量的4倍量进行给药(即生药量为120 g/70 kg);黄芪水煎液全成分组按照“2.1.1”项中的方法提取,减压浓缩至生药质量浓度为1 g/mL。按照等效剂量系数折算,给药剂量如下:黄芪水煎液全成分组为按照黄芪生药量计算得10.8 g/(kg·d),黄芪多糖组为按照黄芪多糖获得量和得率计算得1.08 g/(kg·d),黄芪皂苷组为按照黄芪总皂苷量获得量和得率计算得0.11 g/(kg·d),黄芪黄酮组按照黄芪总黄酮量获得量和得率计算得0.05 g/(kg·d),缺多糖组(黄芪皂苷+黄芪黄酮)给予黄芪黄酮与黄芪皂苷共0.16 g/(kg·d),以此类推,缺皂苷组给予黄芪黄酮与黄芪多糖共1.13 g/(kg·d),缺黄酮组给予黄芪皂苷与黄芪多糖共1.19 g/(kg·d)。各组ig相应药物(10 mL/kg),对照组给予等体积蒸馏水,1次/d,连续30 d。
2.3.2 指标测定 给药期间,每日观察大鼠精神状态、进食饮水、毛色、大便等一般状态。定时记录大鼠摄食量。给药1 h后测定肛温,记录给药第14天与给药第28天的肛温情况。给药1 h后测定大鼠的唾液量,将已称定质量的干棉球放入大鼠口腔内计时3 min后取出并称定质量,记录大鼠唾液量情况,每周测定1次,连续3周(分别于第14、21、28天)。末次给药后,更换垫料并收集粪便,记录24 h各组大鼠的粪便量并测定粪便含水量。给药结束后,大鼠ip 2%戊巴比妥钠(2 mL/kg)麻醉后腹主动脉取血,3000 r/min离心10 min后,收集上清,分装后于−80 ℃冻存。分离肝脏,分装后于液氮速冻。按照ELISA试剂盒说明书测定血清中TNF-α、IL-1β、IL-6、T3、T4、TSH、TRH和17-OHCS水平。按照试剂盒说明书测定肝组织中Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶、SDH、LDH活性以及糖原、丙酮酸含量。
2.3.3 黄芪各给药组对大鼠肝组织、、和mRNA表达的影响 提取各组肝组织的总RNA,合成DNA并进行qRT-PCR分析。引物序列:上游引物5’-GTGGCTTATCA- TCTCATCATTG-3’,下游引物5’-ATTTGGGCTT- AGTTGTGTTG-3’,引物长度217 bp;上游引物5’-GGGCACATCTGTTCTTCC-3’,下游引物5’-TCCCGTAGTTCACTGGTC-3’,引物长度197 bp;上游引物5’-AGACGACGCAAGCATC- AGAGG-3’,下游引物5’-GCGGCAGCTTCACTGT- TAAGG-3’,引物长度124 bp;上游引物5’-GGGATTGGGCACAAGAAG-3’,下游引物5’-GCATTCAGTGGGCAGAAG-3’,引物长度127 bp;上游引物5’-CGGTCAGGTCATCACTATC-3’,下游引物5’-CAGGGCAGTAATCTCCTTC-3’,引物长度229 bp。
2.3.4 黄芪各给药组对大鼠肝组织AMPK、PGC-1α、NRF1和TFAM蛋白表达的影响 将各组肝组织剪成细小的碎片,按20 mg组织加入150~250 μL裂解液提取蛋白,并用BCA法进行蛋白浓度测定。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转至PVDF膜,加入5%脱脂奶粉,室温封闭1 h,分别加入AMPK、PGC-1α、NRF1、TFAM和β-actin抗体,4 ℃孵育过夜;TBST洗涤3次,每次5 min;按照1∶1000稀释HRP标记的羊抗兔二抗,室温孵育1 h,TBST洗涤后,加入ECL发光液,将其放入成像系统中进行扫描。
3 结果
3.1 拆分工艺研究
3.1.1 色谱条件 按“2.1.3”及“2.1.4”项下的色谱条件和质谱条件经UHPLC-Q-Orbitrap HRMS进行测定,对照品黄芪甲苷、芒柄花苷、芒柄花素、毛蕊异黄酮葡萄糖苷的色谱图见图1,R分别为8.05、6.68、8.17、5.05 min。
3.1.2 2种方法的拆分效果比较 精密称取“2.1.5”项下2种方法富集的部位各3 mg,对黄酮部位A、B和皂苷部位A、B中主要的黄酮类和皂苷类化合物进行寻找和鉴别,并对峰面积进行比较,对2个部位的分离程度进行可视化分析,结果见图2。结果表明,方法1黄酮类成分和皂苷类成分有交叉,皂苷部位A未得到有效富集,依旧留在黄酮部位A,分离效果较差。方法2各部位相应成分含量差异较大,黄酮和皂苷分离结果较好。因此后续纯度测定,以及部位成分分析均选择方法2所得到的黄酮部位和皂苷部位。
3.1.3 总黄酮部位和总皂苷部位的纯度测定 葡萄糖、黄芪甲苷、毛蕊异黄酮葡萄糖苷的标准曲线的见图3。标准曲线的回归方程、相关系数(2)分别为=0.082 7-0.038 6、2=0.999 2,=0.011 8+0.114 6、2=0.999 2,=0.055 9+0.105 3、2=0.999 4。
经计算得总多糖质量浓度为7.371 0 μg/mL,质量分数为51%;总皂苷质量浓度为4.083 6 μg/mL,质量分数为83%;总黄酮质量浓度为3.985 2 μg/mL,质量分数为81%。该提取纯化工艺操作简单、易行,大孔树脂具有选择性好、性能稳定、可循环利用的优势,可为黄芪部位的富集纯化提供依据。
3.2 成分鉴别
分离得到的黄酮部位与皂苷部位的总离子流图见图4。
3.2.1 黄酮类成分鉴别 通过XCalibur软件对黄酮部位进行分析鉴别,结果见表1(F1~F21)。通过与对照品R及二级碎片对比,成分F4~F6分别被鉴定为芒柄花苷、芒柄花素和毛蕊异黄酮葡萄糖苷。以部分黄酮类化合物为代表说明化合物的裂解规律,黄酮类化合物是常见的发生Rretro-Diels-Alder(RDA裂解)的一类化合物。芒柄花苷的二级碎片检测到有主要碎片离子峰/269、253。根据裂解规律能够推测出,芒柄花苷失去1分子葡萄糖(/162)形成了芒柄花素(/269),苷元通过脱羟基产生了/253的碎片离子[14]。成分F6的二级碎片离子/270、253比母离子少15和32,推测是由母离子失去1个CH3和CH3OH形成。
表1 黄芪黄酮和皂苷的UHPLC-MS/MS分析结果
Table 1 UHPLC-MS/MS analysis of flavonoids and saponins in Astragali Radix
编号tR/min化合物m/z误差/(×10−6)碎片离子m/z (R.A.%)分子式离子模式 理论值实际值 F113.81鼠李柠檬素-3-O-β-D-葡萄糖苷[12]463.123 5463.123 1−0.86463.123 2, 230.987 1 (12.16), 301.141 3 (100)C22H22O11[M+H]+ F27.127,2′-二羟基-3′,4′-二甲氧基异黄烷[13-15]303.122 7303.122 90.66302.690 9, 149.023 5(4.63),123.044 3 (100)C17H18O5[M+H]+ F35.11毛蕊异黄酮[13-15]285.075 8285.075 90.35253.144 8 (3.33), 269.080 8 (13.89), 285.075 7 (100)C16H12O5[M+H]+ F46.67芒柄花苷#[13-15]431.133 7431.134 00.70431.134 2, 269.080 8 (100)C22H22O9[M+H]+ F58.18芒柄花素#[13-15]269.080 8269.080 90.37253.144 8 (2.35), 213.014 6 (2.38), 269.080 8 (100)C16H12O4[M+H]+ F65.05毛蕊异黄酮葡萄糖苷#[13-15]447.128 6447.129 00.89447.128 8, 270.052 6 (1.41), 285.075 7 (100)C22H22O10[M+H]+ F77.12黄芪异黄烷苷[16]463.161 0463.161 00.00463.161 0, 286.085 0 (17.26), 301.108 3 (100)C23H28O10[M-H]− F85.88鼠李柠檬素[17]301.070 7301.070 4−1.00301.105 7 (5.09), 167.070 5 (100)C16H12O6[M+H]+ F913.83afromosin[17]299.091 4299.091 81.34263.147 8 (17.56), 299.056 0 (100)C17H14O5[M+H]+ F107.005,7-dimethoxy-4′-hydroxyflavanone[17]299.092 5299.092 50.00213.962 7 (1.45), 299.056 3 (41.46)C17H16O5[M-H]− F119.85槲皮素[16]303.049 9303.048 9−3.30303.122 7C15H10O7[M+H]+ F127.56黄芩素[16]269.045 5269.045 70.74223.069 8 (14.05), 251.191 8 (78.64), 269.080 7 (100)C15H10O5[M-H]− F137.12鹰嘴豆牙素A[17]283.061 2283.061 30.35269.041 2 (18.39), 283.061 3 (31.91)C16H12O5[M-H]− F147.78华良姜素[17]315.086 3315.085 9−1.27315.087 8, 313.238 6 (91.72), 300.107 1 (1000)C17H14O6[M+H]+ F1511.85山柰酚[16-17]331.045 9331.048 99.06331.048 8, 301.107 1 (100)C15H10O6[M+HCOO]− F1615.25山柰酚-3-O-葡萄糖苷[16-17]449.107 8449.107 4−0.89449.276 0, 287.161 4 (100)C21H20O11[M+H]+ F170.87染料木苷[14-16]433.112 9433.113 61.62433.122 9, 253.144 7 (8.02), 217.066 3 (100)C21H20O10[M+H]+ F1812.53异鼠李素[15-17]317.065 6317.065 70.32317.065 2, 299.041 3 (0.43)C16H12O7[M-H]− F198.98异甘草素[16]257.080 8257.080 90.39257.080 6, 211.154 2 (100)C15H12O4[M+H]+ F208.52红车轴草素[16-17]301.070 7301.070 2−1.66301.070 6, 269.080 6 (2.82)C16H12O6[M+H]+ F217.32美迪紫檀素[17]271.096 5271.096 81.11271.096 5, 150.885 5 (100)C16H14O4[M+H]+ S19.01黄芪甲苷I[17]913.480 2913.482 42.41807.449 6 (0.93)C45H72O16[M+HCOO]− S28.37黄芪甲苷II[18]871.469 7871.468 6−1.26677.499 8 (3.46)C43H70O15[M+HCOO]− S38.04黄芪甲苷#[18-20]829.459 1829.460 31.45829.459 8, 699.435 5 (11.70), 782.568 3 (96.22)C41H68O14[M+HCOO]− S47.34黄芪甲苷Ⅶ[18]991.511 9991.510 9−1.01991.413 2, 945.116 7 (46.78)C47H78O19[M+HCOO]− S55.71大豆皂苷I[19]987.517 0987.519 52.53986.507 8, 204.669 7 (20.11)C48H78O18[M+HCOO]− S614.82环黄芪醇[20]491.373 1491.373 10.00491.120 0, 143.103 0 (2.08)C30H50O5[M+H]+
#代表通过对照品鉴定;R.A.%代表离子的相对强度
#stands for identification by reference; R.A.% stands for the relative abundance of ion
3.2.2 皂苷类成分鉴别 通过XCalibur软件对皂苷部位进行分析鉴别,结果见表1(S1~S6)。通过与对照品R及二级碎片比较,成分S3被鉴定为黄芪甲苷。根据文献报道[17-20],S1~S6分别被鉴定为黄芪甲苷I、黄芪甲苷II、黄芪甲苷、黄芪甲苷Ⅶ、大豆皂苷I和环黄芪醇。
3.3 黄芪各给药组对大鼠一般状态的影响
3.3.1 对大鼠体质量的影响 如表2所示,在给药过程中,各组大鼠体质量均逐渐升高,而与对照组相比,各组大鼠体质量无显著性差异。说明各给药组对大鼠体质量的增长影响较小。
3.3.2 对大鼠肛温的影响 如表3所示,与对照组相比,给药第14、28天各给药组大鼠肛温均有所升高,其中全成分组大鼠肛温升高有显著性差异(<0.05、0.01),可以体现黄芪的温热效应,全成分组温热效应最强。分别“扣除”各个部位后,只有缺多糖组在第14天肛温升高有显著差异(<0.05),而这种显著性在第28天测定时又消失,其余均无显著性差异,说明对于体温的升高,不是某个部位的单独作用,而是黄芪3个部位以及其余成分的综合作用,符合中医理论的整体观念。
给药第14天,与对照组相比,缺皂苷组与缺黄酮组大鼠唾液量显著升高(<0.01、0.001);给药第21天,与对照组相比,全成分组、缺多糖组与缺黄酮大鼠唾液量显著降低(<0.001),黄酮组与缺皂苷组大鼠唾液量显著升高(<0.05)。给药第28天,与对照组相比,多糖组、皂苷组与缺黄酮组大鼠唾液量显著降低(<0.001)。全成分组在第21、28天唾液量均减少,可能为“上火”症状的体现。多糖组、皂苷组在第28天唾液量显著降低,而缺多糖组、缺皂苷组唾液量并没有降低,黄酮组唾液量没有显著降低,而缺黄酮组即多糖和皂苷配伍组唾液量显著降低,说明长时间大剂量服用黄芪导致唾液量减少的“上火”症状来源于黄芪组分中的多糖部位和皂苷部位。
表2 黄芪及各组分对大鼠体质量的影响(, n = 12)
Table 2 Effect of Astragali Radix and its fractions on body weight in rats(, n = 12)
组别剂量/(g·kg−1)体质量/g 第1天第7天第14天第21天第28天 对照—151.58±3.90227.67±12.41271.58±15.03319.42±25.63339.25±34.56 全成分10.80153.08±5.32219.56±12.97266.73±22.70305.75±27.75332.13±28.47 多糖1.08146.58±5.62218.43±14.52272.20±16.99313.27±30.25343.00±36.40 皂苷0.11150.71±7.48226.86±14.19276.18±18.81317.50±23.12352.38±27.12 黄酮0.05148.42±4.96229.49±8.53281.13±8.82330.50±16.87356.42±17.67 缺多糖0.16150.67±6.91227.16±13.64282.50±27.84320.08±31.76352.00±33.78 缺皂苷1.13149.25±6.69222.85±15.04274.00±19.46322.08±25.20342.92±29.04 缺黄酮1.19148.00±7.66224.54±12.07269.92±19.65306.42±20.14333.33±24.17
表3 黄芪及各组分对大鼠肛温和唾液量的影响(, n = 12)
Table 3 Effect of Astragali Radix and its fractions on rectal temperature and saliva volume in rats(, n = 12)
组别剂量/(g·kg−1)肛温/℃唾液量/mg 第14天第28天第14天第21天第28天 对照—37.49±0.5236.93±0.457.39±5.0210.27±3.3814.42±6.48 全成分10.8037.88±0.21*37.39±0.33**7.72±6.614.25±2.51***10.28±7.13 多糖1.0837.83±0.4237.24±0.507.41±3.5120.34±20.533.18±2.05*** 皂苷0.1137.72±0.3437.07±0.406.87±5.678.41±6.375.05±3.84*** 黄酮0.0537.79±0.3336.97±0.447.36±5.1815.93±6.47*14.08±7.78 缺多糖0.1637.95±0.45*37.21±0.328.03±8.463.35±3.38***11.95±4.54 缺皂苷1.1337.81±0.4137.23±0.2522.22±7.26***15.13±4.99*12.94±3.38 缺黄酮1.1937.79±0.1937.17±0.2444.88±40.27**4.47±3.43***4.41±2.83***
与对照组比较:*<0.05**<0.01***<0.001,下表同
*< 0.05**< 0.01***< 0.001control group, same as below table
3.3.3 对大鼠摄食量、粪便量及粪便含水量的影响 如表4所示,给药第14天,与对照组相比,多糖组大鼠摄食量显著减少(<0.05),黄酮组大鼠摄食量显著升高(<0.001);给药第21天,与对照组相比,缺皂苷组和缺黄酮组大鼠摄食量显著降低(<0.01、0.001);给药第28天,与对照组相比,缺黄酮组大鼠摄食量显著减少(<0.001)。
与对照组相比,除全成分组大鼠粪便量有所减少外,其余组别大鼠粪便量均升高,其中黄酮组具有统计学意义(<0.01)。对于粪便含水量而言,与对照组相比,全成分组与多糖组大鼠粪便含水量显著降低(<0.05、0.01),缺皂苷组大鼠粪便含水量显著升高(<0.001)。
联合摄食量和粪便量可知,黄酮组粪便量显著增加的原因可能为摄食量的增加,而全成分组以及多糖组粪便含水量显著降低则可能为“上火”症状的体现。结合全成分组、多糖组以及缺多糖组的粪便含水量,说明对于粪便量干燥的“上火症状”可能主要源于多糖类组分。
3.4 黄芪各给药组对大鼠血清炎症因子的影响
如图5所示,与对照组相比,全成分组、多糖组、皂苷组大鼠血清中TNF-α水平显著升高(<0.05、0.001),缺皂苷组大鼠血清中TNF-α水平没有升高,而缺多糖组依然显著性升高(<0.01),说明黄芪全成分升高TNF-α的作用可能来自于皂苷部位、多糖部位,且皂苷部位的影响可能较大。此外,与对照组相比,全成分组血清中IL-1β水平显著升高(<0.05),多糖组IL-6表达水平显著升高(<0.01)。表明过量食用黄芪时,其多糖和皂苷可能通过升高促炎因子水平诱发炎症反应,导致“上火”症状。
表4 黄芪及各组分对大鼠摄食量、粪便量及粪便含水量的影响(, n = 12)
Table 4 Effect of Astragali Radix and its fractions on food intake, fecal output and feces moisture in rats(, n = 12)
组别剂量/(g·kg−1)摄食量/g24 h粪便量/g粪便含水量/g 第14天第21天第28天 对照—130.73±2.60117.85±0.75127.17±3.066.53±1.482.85±1.18 全成分10.80128.48±3.75108.29±33.13119.25±13.326.28±1.411.03±1.43** 多糖1.08118.33±20.03*127.17±30.41124.85±30.207.28±2.620.92±2.67* 皂苷0.11134.20±8.06127.55±26.80127.12±2.007.22±2.403.62±1.01 黄酮0.05138.33±3.11***120.08±11.86131.92±8.607.90±0.28**3.45±2.44 缺多糖0.16132.23±3.10113.28±7.51126.42±11.437.18±8.633.59±3.12 缺皂苷1.13131.83±0.8299.42±17.44**127.67±9.198.73±6.154.91±1.32*** 缺黄酮1.19128.82±1.49101.22±4.71***115.46±3.41***6.68±3.181.99±3.47
3.5 黄芪各给药组对大鼠血清甲状腺功能的影响
如图6所示,与对照组相比,多糖组、皂苷组和黄酮组大鼠血清中T3水平显著降低(<0.05),缺黄酮组大鼠T4水平显著升高(<0.05),各组大鼠TRH水平无显著差异,黄酮组大鼠TSH水平显著降低(<0.05)。说明黄芪的温热效应可能不是通过促进甲状腺功能产生。
3.6 黄芪各给药组对大鼠肾上腺功能的影响
如图7所示,与对照组相比,全成分组、多糖组、皂苷组、缺多糖组和缺黄酮组大鼠血清中17-OHCS水平均显著升高(<0.05、0.01),而黄酮组没有升高,说明黄芪温热效应可能还来自于多糖、皂苷部位对肾上腺功能的促进。
3.7 黄芪各给药组对大鼠能量代谢的影响
如图8所示,与对照组相比,全成分组、多糖组、皂苷组、缺皂苷组、缺黄酮组大鼠肝组织中Na+, K+-ATP酶活力都有升高的趋势,其中全成分组和缺黄酮组有显著性差异(<0.05)。与对照组相比,全成分组、缺皂苷组、缺黄酮组Ca2+, Mg2+-ATP酶活力都有升高的趋势,其中全成分组和缺皂苷组有显著性差异(<0.05、0.001)。Na+, K+-ATP酶、Ca2+, Mg2+-ATP酶活力增加,耗能和产热增加,说明全成分组可以增加机体产热,而多糖与黄酮或皂苷部位配伍之后对产热影响较大。
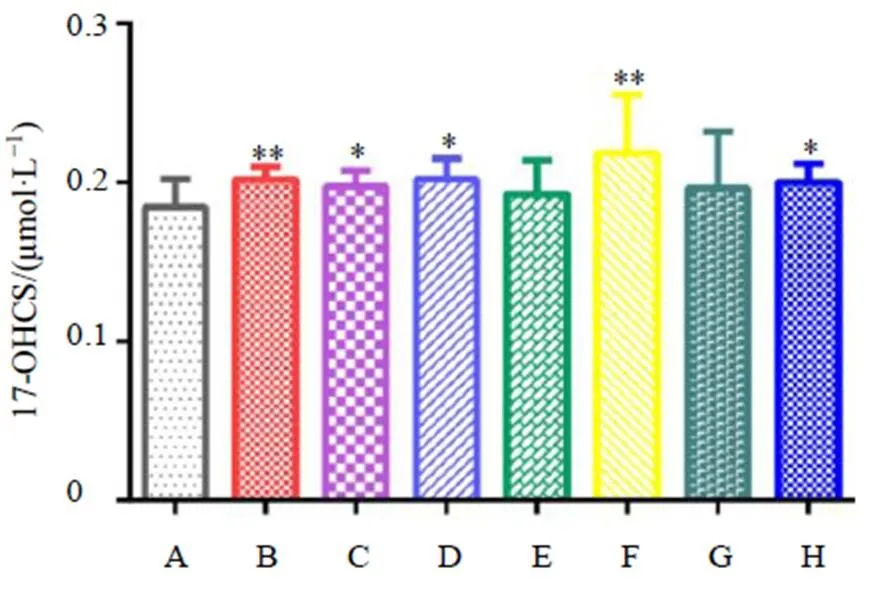
图7 黄芪及各组分对大鼠血清中17-OHCS水平的影响(, n = 8)
丙酮酸可氧化脱羧生成乙酰辅酶A,然后进入三羧酸循环,最终完全被氧化成CO2、H2O和大量的ATP。与对照组相比,多糖组、皂苷组以及缺皂苷组、缺黄酮组丙酮酸含量有增加的趋势,但无显著性差异。与对照组相比,全成分组、多糖组、缺多糖组和缺黄酮组SDH活力有所升高,其中全成分组和多糖组有显著差异(<0.05、0.01),而黄酮组SDH活力显著降低(<0.05)。说明全成分组、多糖组可促进三羧酸循环加速,促进ATP的生成增加。与对照组相比,皂苷组肝组织LDH活力显著降低(<0.05),其余各组无显著性差异,说明皂苷组可以降低机体无氧代谢的水平。与对照组相比,全成分组、多糖组、黄酮组、缺皂苷组以及缺黄酮组肝糖原含量都有上升的趋势,其中缺皂苷组与缺黄酮组有显著差异(<0.01、0.001),说明含有多糖的配伍组会增加机体的储能。
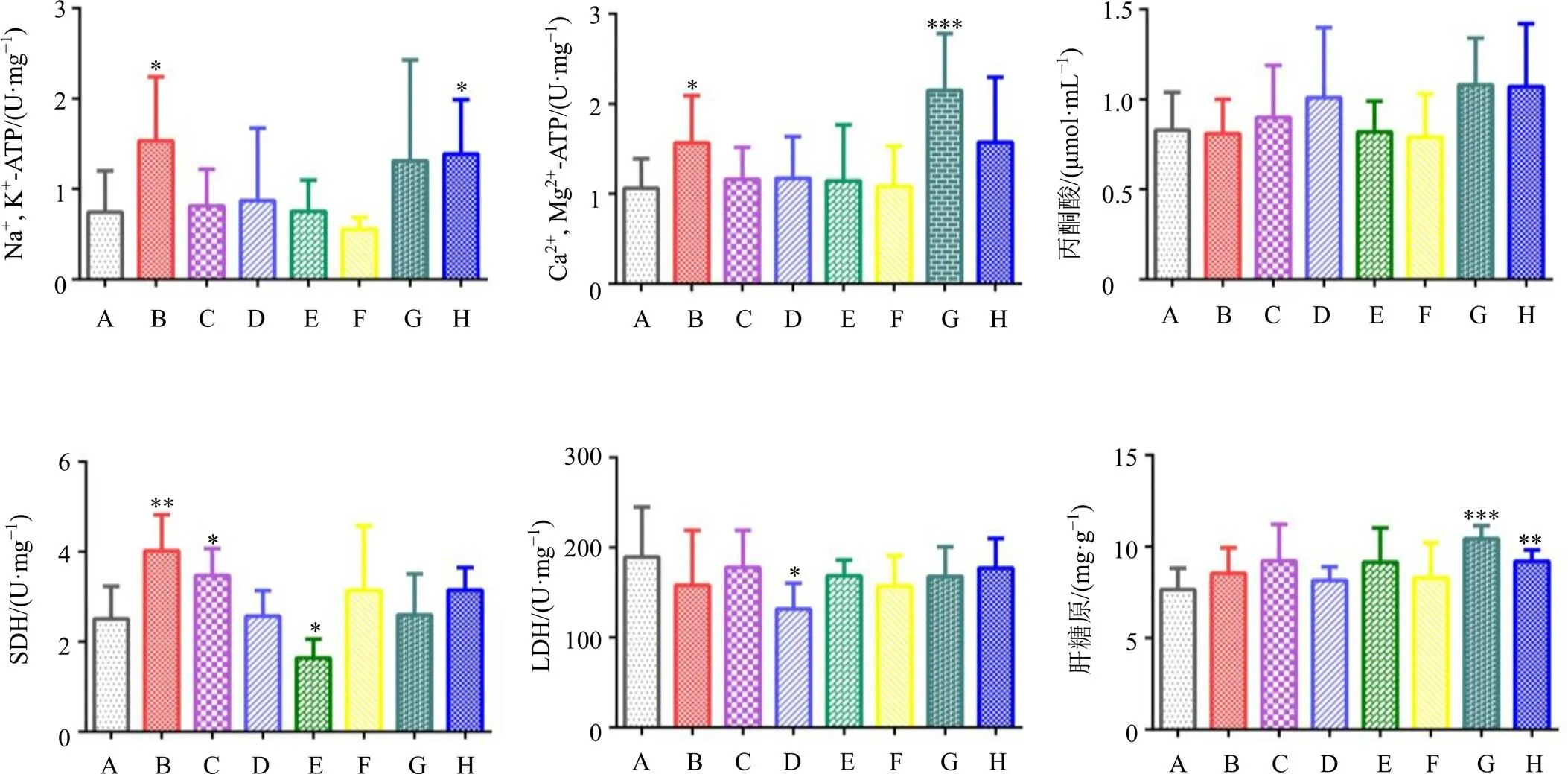
图8 黄芪各给药组对大鼠肝组织中Na+, K+-ATP酶活力、Ca2+, Mg2+-ATP酶活力、丙酮酸含量、SDH活力、LDH活力和肝糖原含量的影响(, n = 8)
3.8 黄芪各给药组对AMPK介导的PGC-1α/NFR1通路的影响
如图9所示,与对照组相比,全成分组、多糖组均可上调大鼠肝组织mRNA表达水平,其中全成分组有显著性差异(<0.05);全成分组、多糖组均可显著性增加、和mRNA表达水平(<0.05、0.01);此外,缺多糖组可显著上调mRNA表达水平(<0.05),缺皂苷组和缺黄酮组可显著上调mRNA表达水平(<0.01、0.001)。
如图10所示,与对照组相比,各组均可显著上调p-AMPK、PGC-1α和TFAM蛋白表达水平(<0.05、0.01、0.001),各组均上调NRF1蛋白表达水平,其中全成分组、多糖组和缺多糖组有显著性差异(<0.05、0.01)。因此,黄芪全成分组可以促进AMPK功能活化,并作用于下游PGC-1α、NRF1等因子,从图中可以看出多糖部位对、、NRF1和TFAM的mRNA表达水平影响较大,同时对p-AMPK、PGC-1α、NRF1和TFAM的蛋白表达水平的影响也较大。
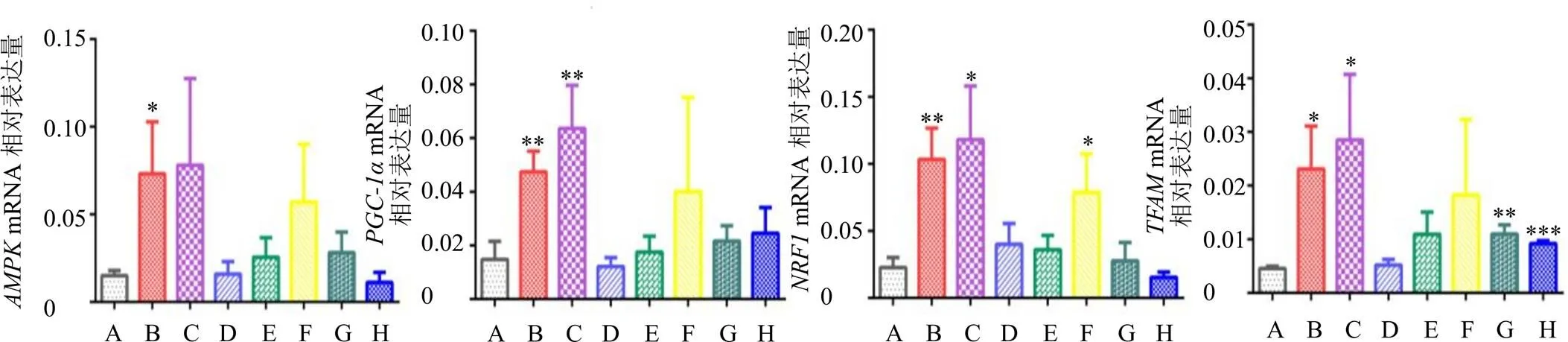
图9 黄芪及各组分对大鼠肝组织AMPK、PGC-1α、NRF1和TFAM mRNA表达的影响(, n = 3)

图10 黄芪及各组分对大鼠肝组织AMPK、PGC-1α、NRF1和TFAM蛋白表达的影响(, n = 3)
4 讨论
4.1 有效部位拆分工艺
在黄芪的部位拆分工艺研究中,考察了AB-8树脂、D101树脂、聚酰胺树脂、溶剂萃取法的分离效果,结果表明成分交叉且得到的部位纯度不高。本研究中方法A、B的相关参数包括上样量、是否加碱洗脱、乙醇浓度、洗脱体积、洗脱体积流量等洗脱条件在预实验阶段均进行了考察和优化,最终确定以D101树脂结合溶剂萃取法效果较好,0.5 g/mL生药量上样,0.1% NaOH、20%乙醇除杂,80%乙醇收集富集部位效果最佳。此方法,简便、易行、环保,可为黄芪部位的分离提供参考依据。在测定总黄酮的纯度时,由于黄芪中大多黄酮为异黄酮,不具有亚硝酸钠-硝酸铝-氢氧化钠显色条件,故没有采用经典的以芦丁为对照品溶液的硝酸铝比色法。
4.2 黄芪温热效应引起“上火”的物质基础及机制分析
《黄帝内经》有载:“气有余便是火”,而黄芪作为“补气圣药”,长期过量食用可能引发“上火”反应。体温升高、大便干燥为“上火”的症候。对大鼠的肛温研究结果表明,黄芪全成分组最为显著,是黄芪温热药性的体现,而体温升高可能是多方面综合作用的体现,如对肾上腺功能的作用,对炎症因子的作用,对能量代谢的作用等,因此虽然各个部位对各个指标的作用有差异,但最终体温的升高来源于几个部位的综合作用,而非单个部位的作用,因此全成分组体温升高最为显著。结合第28天,从各个部位对体温升高的贡献来看,多糖部位贡献最大。全成分组、多糖组粪便含水量降低显著,体现出大便干燥的症状,而缺多糖组粪便含水量有所升高,因此多糖部位对粪便干燥的“上火”症状影响较大,结合缺皂苷组粪便含水量显著增高,而缺黄酮组粪便含水量降低,表明皂苷对粪便干燥的“上火”症状也有一定的贡献。《尚书》有言:“火曰炎上”,“上火”常出现的症状集中在头面部,如口舌生疮、嗓子干痛、流鼻血等,因此对大鼠的唾液量进行研究,研究结果表明,全成分组、皂苷组、多糖组或含有多糖与皂苷的配伍组大鼠唾液量显著降低,因此多糖部位和皂苷部位对唾液量减少的影响较大,其中多糖部位的影响大于皂苷部位。
Huang等[21]认为过量食用龙眼导致的“上火”与炎症相关,因此本研究对炎症因子进行了测定。从实验结果可知,黄芪多糖可显著上调TNF-α与IL-6水平,黄芪皂苷可显著上调TNF-α水平,黄酮组的IL-6和IL-1β水平显著降低。由此推测,长期超剂量服用黄芪引发的“上火”可能是由黄芪多糖部位或皂苷部位导致。黄酮部位则体现一定的抗炎活性,也有研究表明黄酮类成分可以通过下调IL-6、IL-1β的水平来改善炎症反应[22-23]。说明黄芪的“上火”反应是各部位成分综合的效应,因此在机体本身有一定“阴虚阳亢”症状时,“上火”反应会更加明显。
研究表明,患有“热证”大鼠能量代谢紊乱,尤其是与甲状腺功能和钠泵的活性变化相关[24],因此对甲状腺功能进行了测定。在对大鼠甲状腺功能的研究中发现,除缺黄酮组的T4含量有一定的升高外,其余组别均无显著性升高,这说明黄芪导致“上火”可能不通过甲状腺功能轴实现调节。而相关研究[25-26]认为“上火”与交感肾上腺系统相关,17-OHCS可以反映交感神经-肾上腺系统功能,肾上腺功能的亢进与其分泌呈正相关,因此本研究对血清中的17-OHCS进行了测定,结果表明,与对照组相比,全成分组、多糖组、皂苷组等17-OHCS含量显著增加,表明以上部位对肾上腺功能有一定的促进作用。能量代谢包括能量的产生与消耗,在这个过程中ATP能直接反映生物体能量代谢水平的高低,是能量的“通用货币”,ATP酶主要存在于细胞膜与细胞器膜上,其功能是将ATP水解并释放出能量,因此对Na+, K+-ATP酶和Ca2+, Mg2+-ATP酶的活力进行了测定。在黄芪及各组分对Na+, K+-ATP酶活力的影响中发现全成分组、缺黄酮组增强显著,全成分组、缺皂苷组Ca2+, Mg2+-ATP酶活力增强显著,可以推测全成分组与含有多糖的配伍组可以促进大鼠ATP的分解和产热。SDH是反映线粒体功能的标志酶,其活性的上调代表三羧酸循环的加速与ATP的增加[27],LDH广泛分布在组织中,其活力代表了肝脏的厌氧代谢水平,全成分组、多糖组对SDH具有促进作用,皂苷组对LDH有抑制作用,且多糖部位对于黄芪促进ATP增加作用的贡献最大。肝糖原是由大量葡萄糖分子聚合而成的多糖,以糖原的形式储存在肝脏中,它可以在需要的时候分解成葡萄糖,同时产生能量,多糖组、缺皂苷组和缺黄酮组的肝糖原含量较高,推测因有多糖的存在导致糖原储存较多。
有专家认为,“上火”表现出的皮肤黏膜的红肿热痛、溃疡等症状,与能量代谢密切相关[28-29]。AMPK能够灵敏地感应细胞内二磷酸腺苷(adenosine diphosphate,ADP)/ATP和单磷酸腺苷(adenosine monophosphate,AMP)/ATP的比值变化,被视为“能量传感器”和“能量代谢的总开关”。PGC-1α主要存在于含有线粒体的组织中,它可以在AMPK的调节下辅助激活NFR1与TFAM,促进线粒体的合成[30]。赵婷等[31]通过建立实热“上火”动物模型对AMPK能量代谢方面进行研究,表明红参引发的“上火”与AMPK等上调相关。张喜召等[4]通过建立“上火”模型研究表明对“上火”动物模型中AMPK-PGC-1α信号通路受到抑制。本研究结果表明,黄芪及各部位对AMPK介导的通路中的关键蛋白AMPK、PGC-1α、NFR1、TFAM有上调作用,各组分均可促进能量代谢,增强能量储备(图11)。因此黄芪引发的“上火”反应机制可能与AMPK介导AMPK-PGC-1α通路相关。比较各组的作用大小发现,多糖组作用较强,与全成分组相当或者高于全成分组。
综上所述,通过“部位扣除”结合单个部位给药,对黄芪引起的“上火”反应从炎症反应、肾上腺功能、ATP酶活力、SDH活力以及AMPK介导的AMPK-PGC-1α通路等方面进行探讨,发现黄芪的3类成分中多糖类成分可能对“上火”的影响较大,在黄芪相关保健品开发时,可以采用一定的方法控制黄芪多糖的含量,以达到减少“上火”反应的目的。

图11 基于能量代谢及AMPK通路作用示意图
利益冲突 所有作者均声明不存在利益冲突
[1] 吴德鸿, 刘佳佳, 谢冠群, 等. “实火”与“虚火”牙龈炎患者的血浆代谢特征研究 [J]. 中华中医药杂志, 2020, 35(8): 3842-3845.
[2] 朱燕丽, 李池川, 陈洁, 等. 基于网络药理学探究黄芪辅助治疗肺结核的作用机制[J]. 现代药物与临床, 2022, 37(1): 42-49.
[3] 赵鑫, 吕文良, 刘爽, 等. 基于网络药理学探讨黄芪治疗代谢相关脂肪性肝病作用机制[J]. 药物评价研究, 2021, 44(1): 89-97.
[4] 张喜召, 包洁, 窦晓兵, 等. 基于AMPK-PGC-1α信号通路探讨“上火”动物模型的发病机制 [J]. 中华中医药杂志, 2020, 35(4): 2002-2006.
[5] 甘霖. 阴虚“上火”的生物组学分析及“上火”的中药干预研究 [D]. 广州: 华南理工大学, 2020.
[6] 谢静, 龚易昕悦, 丁立生, 等. 黄芪及其活性成分对脓毒症临床和药理作用的研究进展 [J]. 中草药, 2021, 52(8): 2502-2510.
[7] 谭雪霞, 朱宏明, 唐铖, 等. HPLC-MS鉴定黄芪水煎液中黄酮类成分 [J]. 现代药物与临床, 2021, 36(2): 231-235.
[8] 杨敏, 张天锡, 史磊, 等. 大孔吸附树脂分离纯化中药成分影响因素探讨 [J]. 中草药, 2020, 51(15): 4050-4058.
[9] 贾刚. 黄芪有效组分的提取分离及结构鉴定 [D]. 长春: 长春中医药大学, 2008.
[10] 马秀, 刘少静, 张婉莹, 等. 黄芪多糖的分离纯化及药理作用研究进展 [J]. 化学工程师, 2019, 33(8): 50-53.
[11] 王瑞海, 叶迎, 许京, 等. 甘肃红芪和黄芪总多糖含量测定对比 [J]. 中国实验方剂学杂志, 2017, 23(22): 77-83.
[12] Zhang J, Xu X J, Xu W,. Rapid characterization and identification of flavonoids inby ultra-high-pressure liquid chromatography coupled with linear ion trap-orbitrap mass spectrometry [J]., 2015, 53(6): 945-952.
[13] Huang X, Liu Y, Song F R,. Studies on principal components and antioxidant activity of differentsamples using high-performance liquid chromatography/electrospray ionization multiple-stage tandem mass spectrometry [J]., 2009, 78(3): 1090-1101.
[14] 张蔚, 江曙, 钱大玮, 等. 芒柄花苷与人体肠道细菌的相互作用研究 [J]. 药学学报, 2014, 49(8): 1162-1168.
[15] 施怀生, 毕小凤, 史宪海. UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用分析黄芪根及其茎叶中黄酮和皂苷类成分 [J]. 世界中西医结合杂志, 2018, 13(3): 357-361.
[16] 许如玲, 范君婷, 董惠敏, 等. 经典名方黄芪桂枝五物汤标准煎液化学成分的UPLC-Q-TOF-MS分析 [J]. 中国中药杂志, 2020, 45(23): 5614-5630.
[17] Duan Y, Pei K, Cai H,. Bioactivity evaluation-based ultra high-performance liquid chromatography coupled with electrospray ionization tandem quadrupole-time-of-flight mass spectrometry and novel distinction of multi-subchemome compatibility recognition strategy with-herb-pair as a case study [J]., 2016, 129: 514-534.
[18] 吴红根, 钟淑梅, 彭璐, 等. HPLC-ESI-MS/MS分析黄芪蜜炙前后活性成分差异 [J]. 质谱学报, 2020, 41(6): 637-647.
[19] Li Y, Guo S, Zhu Y,. Comparative analysis of twenty-five compounds in different parts ofvar.andby UPLC-MS/MS [J]., 2019, 9(6): 392-399.
[20] Liu Y, Liu J, Wu K X,. A rapid method for sensitive profiling of bioactive triterpene and flavonoid fromandby ultra-pressure liquid chromatography with tandem mass spectrometry [J]., 2018, 1085: 110-118.
[21] Huang H M, Li M X, Wang Y,. Excessive intake of longan arillus alters gut homeostasis and aggravates colitis in mice [J]., 2021, 12: 640417.
[22] Cheng S C, Huang W C, Pang J H S,. Quercetin inhibits the production of IL-1β-induced inflammatory cytokines and chemokines in ARPE-19 cells via the MAPK and NF-κB signaling pathways [J]., 2019, 20(12): 2957.
[23] 张娟, 毛文静, 白庆云. 槲皮素及其衍生物防治肝损伤作用及机制的研究进展 [J]. 中草药, 2021, 52(23): 7348-7357.
[24] Luo K K, Zhao H Y, Bian B L,. Huanglian Jiedu Decoction in the treatment of the traditional Chinese medicine syndrome “Shanghuo”-an intervention study [J]., 2021, 12: 616318.
[25] Zhao T, Yang Z, Mei X X,. Metabolic disturbance in Korean red ginseng-induced “Shanghuo” (excessive heat) [J]., 2020, 253: 112604.
[26] 苏鑫, 孙大中. “上火”与应激反应相关性探析 [J]. 中华中医药杂志, 2015, 30(1): 32-34.
[27] Xu X, Dou D Q. The ginseng’s fireness is associated with the lowering activity of liver Na(+)-K(+)-ATPase [J]., 2016, 190: 241-250.
[28] 谢冠群, 钱俊华, 范永升. 上火的由来、定义及其研究思路 [J]. 世界中医药, 2017, 12(12): 2869-2871.
[29] Pan M H, Zhu S R, Duan W J,. “Shanghuo” increases disease susceptibility: Modern significance of an old TCM theory [J]., 2020, 250: 112491.
[30] 阚东方. 黄芪及其拆分组分对大鼠肝细胞能量代谢的影响及机制研究 [D]. 济南: 山东中医药大学, 2018.
[31] 赵婷, 谢冠群, 徐莉, 等. 从AMPK能量调节功能探讨红参上火机制 [J]. 浙江中医药大学学报, 2018, 42(10): 797-803.
Material basis and mechanism of “Shanghuo” response caused by warm nature ofbased on “fraction deduction”
CAO Li-long1, PEI Ke1, LIU Rui1, NING Yan2, ZHAO Ting-ting1, YU Zi-han1, WU Chen-cheng1, SHAO Xiang-yu1, ZHANG Shuo-sheng1, WANG Ying-li1, HU Mei-bian1, CAI Hao3
1. Shanxi Modern Chinese Medicine Engineering Laboratory, School of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, China 2. Chinese Medicine Processing Research Center, School of Pharmacy, Zhejiang University of Chinese Medicine, Hangzhou 310053, China 3. Engineering Research Center for Standardization and Standardization of Chinese Medicine Processing, Ministry of Education, School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
To explore the material basis and mechanism of “Shanghuo” caused by warm nature of Huangqi ()The flavonoids and saponins indecoction were isolated and identified by UHPLC-Q-Orbitrap HRMS firstly. Then SD rats were randomly divided into eight groups, administrated with distilled water and corresponding drugs, respectively. The daily dose was administered at four times dosage prescribed byfor 30 d. The state of rats was observed, rectal temperature, food intake, fecal output, feces moisture and saliva volume were measured. The related indexes including inflammatory factors, thyroid function, adrenal function and energy metabolism were determined. Finally, mRNA and protein expressions of adenosine monophosphate activated protein kinase (), peroxisome proliferator-activated-recptor-γ coactivator-1α (), nuclear respiratory factor 1 () and mitochondrial transcription factor A () in each group were detected.There was a good separation for polysaccharides, flavonoids and saponins, at the same time the purity of total polysaccharides, saponins and flavonoids was more than 50%, 80% and 80% respectively. A total of 21 flavonoids and six saponins were identified. There was no significant difference in body weight among all groups, while the rectal temperature ofgroup was significantly increased (< 0.05) by comparing to control group. The feces moisture ofand polysaccharides group were significantly decreased (< 0.05, 0.01), however polysaccharides plus flavonoids group was significantly increased (< 0.001) by comparing to control group. For saliva volume, compared with control group, polysaccharides, saponins and polysaccharides plus saponins group were significantly decreased on 28th day (< 0.001). The level of tumor necrosis factor-α (TNF-α) in, polysaccharides, saponins and saponins plus flavonoids groups were all significantly increased (< 0.05, 0.01, 0.001), while only interleukin-6 (IL-6) level in polysaccharides group was significantly increased (< 0.01), IL-1β level ingroup was increased (< 0.05) by comparing to control group. The contents of 17-hydroxycorticosteroid (17-OHCS) in all groups were increased by comparing with control group, while, polysaccharides, saponins, saponins plus flavonoids group and saponins plus polysaccharides groups had significantly difference (< 0.05, 0.01). Compared with control group, activities of Ca2+, Mg2+-ATPase and Na+, K+-ATPase in, polysaccharides plus flavonoids and polysaccharides plus saponins were increased, activity of succinate dehydrogenase (SDH) inand polysaccharides group were also significantly increased (< 0.05, 0.01). Compared with control group, mRNA and protein expressions of,,andwere upregulated in all groups, and the trends ofand polysaccharides group were better than that of other groups.“Shanghuo” induced by excessive consumption ofmay be related to the inflammatory reaction and enhanced energy metabolism caused by polysaccharides and saponins ofThe mechanism may be related to AMPK mediated PGC-1α/NFR1 pathway, and polysaccharides played a major role.
; “Shanghuo” response; UHPLC-Q-Orbitrap HRMS; energy metabolism; adenosine monophosphate activated protein kinase pathway
R285.5
A
0253 - 2670(2022)14 - 4350 - 15
10.7501/j.issn.0253-2670.2022.14.015
2022-01-10
国家自然科学基金面上项目(82074022);国家自然科学基金联合基金重点项目(U21A20410);科技部“中医药现代化研究”重点研发计划项目子课题(2019YFC1710800);山西省应用基础研究项目(201801D221436);山西省教育厅科技创新计划项目(2019L0720);山西省中医药管理局项目(2019ZYYC016);山西省重点研发计划项目(201903D421018);山西省重点研发计划项目(201903D421018);山西药茶的研制和开发项目(2020PY-YC-20)
曹丽珑(1996—),女,硕士研究生,研究方向为中药炮制与物质基础研究。E-mail: C178798032@126.com
裴 科(1986—),女,硕士生导师,研究方向为中药炮制与物质基础研究。E-mail: peike_pk@126.com
蔡 皓(1966—),男,副教授,研究方向为中药炮制机制及炮制配伍。E-mail: haocai_98@njucm.edu.cn
[责任编辑 李亚楠]
