经动脉化疗栓塞联合卡瑞利珠单抗及酪氨酸激酶抑制剂治疗中晚期肝细胞癌的安全性及近期疗效
2022-07-20杨炜浩仲斌演朱晓黎
杨炜浩, 仲斌演, 杨 飞, 沈 健, 朱晓黎
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的肝癌类型,多数患者在就诊时已发展为中晚期,失去了根治性治疗的机会[1-2]。 动脉化疗栓塞术(transarterial chemoembolization,TACE)作为中期肝癌的推荐治疗方式, 能有效控制肝内肿瘤病灶;《原发性肝癌诊疗规范(2019 年版)》指出,TACE 的应用范围为具有高肿瘤负荷的Ⅱb 期、 伴有大血管侵犯的Ⅲa 期及部分Ⅲb 期患者。但对于TACE 难治性肿瘤、超过up-to-seven 标准(即肿瘤数目和最大肿瘤直径之和超过7)的中期HCC[3-4]、韩氏评分sixtwelve 在6 分以上或合并肝外肿瘤的患者[5],单纯TACE 的效果不佳,且可能损伤肝脏储备功能,导致不良预后。尽管具有抗血管生成作用的一系列酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI) 及针对免疫检查点的免疫疗法为中晚期HCC 提供了新的治疗选择[6-12],但单一治疗的客观缓解率及生存获益仍有限。 因此迫切需要将TACE 与针对肿瘤增殖和转移不同环节的系统治疗联合以迅速降低肿瘤负荷,改善肿瘤微环境,提高TACE 疗效。
有研究表明,基于TACE、TKI 和免疫检查点抑制剂(immune checkpoint inhibitors,ICI)的联合治疗效果优于单一治疗[13-14]。 然而联合治疗有增加治疗相关不良事件发生风险的可能性,如何在提高疗效的同时保证患者的安全性, 是临床研究关注的重点。 本研究回顾性分析了接受TACE 联合卡瑞利珠单抗(Camrelizumab)及TKI 治疗的患者不良事件发生情况和初步疗效。
1 资料与方法
1.1 研究对象
回顾性分析2019 年8 月至2021 年2 月于苏州大学附属第一医院接受TACE、Camrelizumab、TKI联合治疗的33 例HCC 患者的临床资料。 纳入标准:①符合《原发性肝癌诊疗规范(2019 年版)》的临床诊断标准或经组织病理确诊为HCC; ②未合并其他类型的恶性肿瘤;③Child-Pugh 评分≤7 分;④ECOG 评分0~1 分;⑤至少接受过1 次TACE、2 个周期免疫治疗以及1 个月的TKI 治疗。 排除标准:①中国肝癌临床分期(China liver cancer staging,CNLC)Ⅰ期或Ⅳ期;②治疗随访信息缺失;③因非治疗因素而中断治疗。
1.2 治疗方法
TACE、Camrelizumab、TKI 三联治疗定义为TACE与Camrelizumab 治疗起始时间间隔在2 个月以内,且TACE 与TKI 起始时间间隔在1 个月以内[15]。TACE 以传统方式进行。术中锥形束CT 用于识别肿瘤供血动脉。TACE 应尽可能达到超选择性栓塞,以获得更好的治疗效果并减少TACE 相关的并发症。按需进行重复TACE。
Camrelizumab 采用200 mg/次、每3 周静脉注射1 次的治疗方案。 TKI 药物均口服给药, 索拉非尼(Sorafenib)的剂量为800 mg/d,仑伐替尼(Lenvatinib)为8 mg/d 或12 mg/d(根据体质量决定),阿帕替尼(Apatinib)为250 mg/d。TKI 药物治疗在TACE 术前2 d 暂停,并在TACE 术后复查肝功能,其正常或接近正常后继续应用。
药物治疗剂量和间隔时间根据不良事件的发生情况而调整,如果患者不能耐受不良事件或临床处理疗效不佳, 可考虑TKI 减量或暂停免疫治疗。出现3 级或以上不良事件时, 暂停免疫及靶向治疗,当相应不良事件缓解时再恢复治疗,否则永久停药。
1.3 随访
以符合联合治疗的初始TACE 治疗时间为随访起始时间,每次免疫治疗前及TACE 治疗前后进行相关实验室检查,记录患者不同级别不良事件的发生情况,持续时间及处理情况,直到出现不可接受的毒性或疾病进展。 不良事件根据美国国家癌症研究所常见不良事件评价标准(CTCAE)5.0 版进行分级。 为了避免局部治疗并发症的干扰,在局部治疗后至少1 个月评估治疗相关的不良事件。
在基线、 联合治疗开始后1 个月进行增强CT或磁共振成像(MRI),此后每2~3 个月进行1 次影像评估。 根据实体瘤改良反应评估标准(mRECIST)评估肿瘤反应,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。
随访截止日期为2021 年5 月30 日。 主要观察指标为各类不良事件的发生率和发生级别。 次要观察指标包括肿瘤反应、 客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)、无进展生存期(progression free survival,PFS)、至疾病进展时间(time to progression,TTP)。 随访截止时, 病死率未达到50%, 因此未评估总生存期(overall survival,OS)。
1.4 统计学分析
统计分析采用SPSS V26.0 软件。连续变量以均数±标准差表示。 对于离散变量,显示相对频率。 通过Kaplan‐Meier 方法分析PFS、TTP 曲线。 χ2检验用于比较两组间不良反应发生率。 P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
33 例HCC 患者中,男27 例,女6 例,年龄为(58.4±10.3)岁。 HBV 感染30 例(90.9),3 例(9.1)为其他病因。ECOG 评分为0 分22 例(66.7),1 分为11 例(33.3)。 AFP<400 μg/L 24 例(72.7),AFP≥400 μg/L 9 例(27.3)。 肿瘤大小为(7.1±3.8)cm。 肿瘤数量<3 个10 例(33.3),≥3 个23 例(69.7)。 有门脉侵犯10 例(33.3),有肝外转移12 例(36.4),有治疗史12 例(36.4)。CNLC 分期为Ⅱa 期3 例(9.1%),Ⅱb 期10 例(30.3%),Ⅲa 期8 例(24.2%),Ⅲb 期12 例(36.4%);Child-Pugh 分级为A 级26 例(78.8%),B 级7 例(21.2%)。 联合TKI 治疗中,Sorafenib 治疗14 例,Lenvatinib 治疗11 例,Apatinib 治疗8 例。患者接受TACE 的中位次数为2 次(1~6 次)。Camrelizumab 治疗的中位时间为5 个周期(2~20 个周期)。
2.2 肿瘤反应
随访中位时间为15.1 个月(9.5~18.0 个月),随访截止时,10 例患者死亡,11 例患者仍在接受三联治疗。 PFS 为9.2 个月(5.9~12.5 个月),TTP 为7.7 个月(3.3~12.1 个月)。 肿瘤反应情况见表1。1 例67 岁CNLC Ⅱa 期HCC 患 者TACE 联 合Camrelizumab及TKI 治疗前后对比见图1。
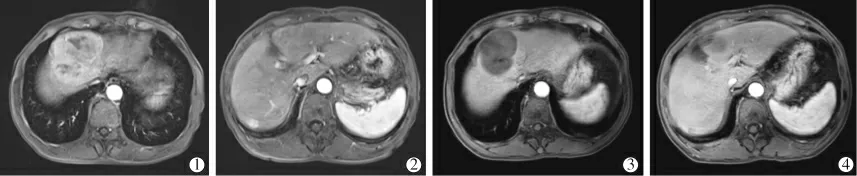
图1 CNLC Ⅱa 期HCC 患者TACE 联合Camrelizumab 及TKI 治疗前后对比

表1 肿瘤反应情况
2.3 不良事件发生情况
共29 例(87.9%)患者发生了不同程度的不良事件,包括药物相关性肝功能损伤、反应性皮肤毛细血管增生症(reactive cutaneous capillary endotheial proliferation, RCCEP)、皮疹、甲减等。 5 例患者出现3 级不良事件, 其中3 例患者出现了两种3 级不良事件(呕吐及垂体炎、高血压与蛋白尿);最常见的3 级不良事件为肝功能损伤, 未出现4 级不良事件或因治疗导致死亡的病例。
联合Sorafenib 组12 例发生不良事件, 未发生≥3 级不良事件。 联合Lenvatinib 组9 例发生不良事件,1 例为≥3 级不良事件。 联合Apatinib 组8 例均发生不良事件,4 例为≥3 级不良事件,其中3 例患者出现了2 种3 级不良事件。见表2。对3 组不良事件发生情况进行两两比较后发现,Apatinib组RCCEP 的发生率高于Sorafenib 组(P=0.019)及Lenvatinib 组(P=0.003);同时,≥3 级不良事件发生率也高于Sorafenib 组(P=0.03)及Lenvatinib 组(P=0.046)。

表2 不良事件发生情况
Child-Pugh B 组与Child-Pugh A 组的不良事件发生率为71.4%比46.2%(P=0.235), 而≥3 级不良事件的发生率Child-Pugh B 组高于Child-Pugh A组,为28.6%比3.8%(P=0.043)。
2.4 不良事件的处理
33 例患者中,3 例患者因无法缓解的严重不良事件(肝功能损伤、尿蛋白、呕吐)而永久停药,不良事件导致2 例(声嘶、食欲下降)患者TKI 减量,1 例(肝功能损伤)暂停免疫治疗1 次。 患者不良事件的处理及转归见表3。

表3 不良事件的处理及转归
3 讨论
TACE 是治疗中晚期HCC 的主要手段,但是单一TACE 疗效有限,且TACE 术后局部缺血、缺氧的状态会刺激残存肿瘤组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,增加肿瘤血管重建和局部复发转移的风险[16]。 抗血管生成剂可以拮抗VEGF 的作用,逆转由组织缺氧及免疫抑制细胞引起的免疫抑制,与TACE 联用理论上能协同增效[17]。 TKI 具有VEGF 和成纤维细胞生长因子(fibroblast growth factor,FGF)等多靶点抑制作用。Kudo 等[18]的一项随机、多中心、前瞻性试验对比了TACE 联合Sorafenib 与单纯TACE 对不可切除HCC 的疗效, 结果显示联合组在中位PFS(25.2个月比13.5 个月)、1 年生存率(96.2%比82.7%)、2 年生存率(77.2%比64.6%))等方面均优于单纯TACE组。 此外,有meta 分析表明TACE 和Sorafenib 的联合应用可以延长不可切除HCC 患者的TTP 和DCR[19]。
TACE 通过栓塞使肿瘤缺血坏死的同时还可以使肿瘤抗原暴露,诱导免疫原性细胞死亡,ICI 的应用则可进一步增强抗肿瘤免疫[20]。 有研究表明,低氧条件下程序性死亡因子配体1(programmed death ligand 1,PD-L1)的表达上调,即TACE 造成的缺氧环境会使PD-L1 表达升高[21]。Camrelizumab 可与程序性死亡受体1(programmed cell death protein 1,PD-1)结合,阻断PD-1/PD-L1 的结合及下游信号通路,因此TACE 和Camrelizumab 的联合治疗理论上也是可行的。 这种联合治疗模式的另一个潜在优势是PD-1与VEGF 的双重阻断作用可通过多种机制增强抗肿瘤作用[19]。目前阿替利珠单抗(Atezolizumab)与贝伐珠单抗(Bevacizumab)、信迪利 单 抗(Sintilimab)与贝伐珠单抗生物类似物(Bevacizumab biosimilar)的联合治疗均表现出了优于Sorafenib 单药治疗的客观缓解率及生存获益[22-23]。
目前,TACE 联合靶向和免疫治疗的研究尚处于探索阶段。在Zheng 等[13]的一项中晚期HCC 疗效对比研究中,TACE 联合Sorafenib 及ICI 表现出了优于TACE 联合Sorafenib 的疗效:DCR 为81.82%比55.17%、 中位PFS 为16.26 个月比7.3 个月、 中位OS为23.3 个月比13.8 个月。 黄剑等[14]报道了16 例接受TACE 联合Camrelizumab 及Apatinib 治疗的晚期HCC 患者, 其ORR 为75%, 中位PFS 长达9 个月(95%CI:5.58~13.29),中位OS 为12 个月(95%CI:9.04~16.09)。而在一项Camrelizumab 联合Apatinib一线治疗晚期HCC 的临床试验中,ORR 和中位PFS 分别为34.3%和5.7 个月(95%CI:5.4~7.4)[24]。
尽管TACE 联合靶免治疗可能疗效更好,其潜在的不良事件风险也值得关注。 Zheng 等[13]报道22例接受TACE、Sorafenib 及ICI 联合治疗的患者均未出现4 级以上严重不良事件,但瘙痒、肌痛、甲状腺功能减退以及3~4 级皮疹等不良事件的发生率均高于TACE 联合Sorafenib,有4 例因不良事件导致剂量减少或中断。 在黄剑等[14]报道中,有87.5%的患者出现了靶向及免疫相关并发症,37.5%的患者出现了3 级并发症,包括2 例手足综合征,3 例严重腹泻,1 例免疫性肺炎,经对症支持治疗后均好转。值得注意的是,在本研究中,肝功能损伤占不良事件的首位。 而在Camrelizumab 联 合Apatinib、Atezolizumab 联 合Bevacizumab、Sintilimab 联合Bevacizumab biosimilar等几项研究中,高血压的发生占据首位[22-24]。这可能由于TACE 联合靶向和免疫的三联治疗在一定程度上会进一步加重肝功能损伤,Child-Pugh B 组的3 级及以上肝功能损伤的发生率更高。 尽管在充分保肝治疗或及时停药等处理后,多数患者的肝功能损伤可得到缓解并避免进一步加重,但较差的基础肝功能仍增加了肝功能损伤的风险。 因此在采取联合治疗之前,肝功能仍是保证治疗安全性必须考虑的因素之一。
本研究为单中心观察性研究, 随访时间较短,未对OS 进行分析, 仅对短期疗效及安全性进行了评估;此外限于样本量较少,且联合三种不同TKI,因此所得结果尚需后续真实世界中大样本数据进一步证实。
综上所述, 尽管TACE 联合Camrelizumab 及TKI 治疗HCC 不良事件发生率较高,但均在可控范围内,有一定的安全性及良好的耐受性,有望为中晚期肝癌生存延长提供新的治疗选择。
