盐度对青海湖裸鲤生长及渗透调节基因的影响
2022-07-20李长忠李梓瑄刘艳慧祁洪芳金文杰
黄 屾,李长忠,李梓瑄,刘艳慧,柳 芳,祁洪芳,汪 洋,金文杰
(1.青海大学 生态环境工程学院,青海 西宁 810016; 2.青海湖裸鲤救护中心,青海湖裸鲤繁育与保护重点实验室,青海 西宁 810016)
青海湖裸鲤(Gymnocyprisprzewalskii),属鲤形目鲤科裂腹鱼亚科裸鲤属[1],是青海湖中重要的野生经济鱼类,在青海湖水生生态系统平衡中起重要作用[2]。青海湖是我国最大的内陆咸水湖泊,湖水的盐度约为15,由于其特殊的高原地理环境,湖中的青海湖裸鲤生长十分缓慢。因具有耐盐碱、耐高寒、耐低氧等优良特性,青海湖裸鲤受到广泛关注[3]。每年的4—7月,性成熟的青海湖裸鲤由青海湖溯河洄游到布哈河、沙柳河、泉吉河等5条主要的淡水支流河道的静水区中产卵繁殖,繁殖后的亲鱼及孵化后的幼体再降河洄游到青海湖[4]。在洄游过程中将面临贫营养、高盐度等一系列的环境变化[2]。自2002年开始,青海湖裸鲤救护中心协同多个科研院所全面开展了青海湖渔业生态环境和青海湖裸鲤资源的探测工作,进行了持续十余年的青海湖裸鲤增殖放流工作,累计向青海湖放流青海湖裸鲤大规格1龄鱼种1.2亿尾,青海湖裸鲤的资源量由2002年的2.569×103t恢复至2017年的8.12×104t,人工增殖放流对青海湖裸鲤资源的贡献率达到23%[5]。然而,在青海湖裸鲤鱼种放流后洄游至青海湖的过程中,其生存状况和适应机制尚未明确。

1 材料与方法
1.1 试验材料
试验用1龄青海湖裸鲤取自青海湖裸鲤救护中心。选取健康、规格均一的试验鱼在淡水中暂养7 d后开始试验。试验前禁食2 d后称量质量。初始体质量(18.414±0.613) g,初始体长(10.960±0.288) cm。
1.2 不同盐度下1龄青海湖裸鲤的生长
在80 cm× 30 cm× 60 cm鱼缸中注入充分曝气的自来水120 L,并添加一定量的海水晶(江西盐通科技有限公司)完成各盐度调配,放入1龄青海湖裸鲤35尾,暂养7 d后,进行为期30 d的养殖试验。设置0、5、10、15共4个盐度组,每个盐度组设置2个平行。投喂粒径1.5 mm的温格尔裸鲤稚鱼配合饲料(山东汉业生物科技有限公司),日投喂2次,日投喂量为体质量的3%[24]。投喂2 h后吸底1次,吸出残余的饵料和粪便。日换水1/2,以保持水质良好。试验期间严格控制水温、溶解氧和pH。生长试验期间未出现死亡现象。胁迫15 d和30 d时,每个盐度组随机捞取1龄青海湖裸鲤10尾,用丁香酚(1∶10 000,质量比)麻醉后进行取样,并测定体质量、体长等形态学指标。
1.3 渗透调节相关基因表达
选取活力正常的200尾鱼,在鱼缸中暂养。暂养期间正常投喂,每日10:00和16:00各投喂1次,投喂量为青海湖裸鲤体质量的3%。水温(17.5±0.5) ℃,水缸保持持续充气,保证其暂养期间溶氧量(7.0±0.5) mg/L,每日吸底1次,清除鱼缸底部残留的饵料及粪便,暂养期间试验鱼无死亡情况。3 d后,挑选180尾转移至鱼类毒理实验养殖系统(青岛金水海洋生物设备有限公司)进行试验。试验分对照组(淡水,盐度0)、低盐度组(盐度5)、高盐度组(盐度15),每组设置3个平行,每个平行饲养20尾鱼。各盐度组分别在胁迫0、3、6、12、24、48、96 h时间点取样,经间氨基苯甲酸乙酯甲磺酸盐麻醉后,取鲤鳃、肾脏和肝脏组织放入无RNA酶冻存管,液氮速冻后放入-80 ℃冰箱储存。
1.4 总RNA的提取
使用总RNA提取试剂盒[天根生化科技(北京)有限公司]提取总RNA,使用1%琼脂糖凝胶电泳检测RNA完整性。
1.5 实时荧光定量PCR
设计实时荧光定量PCR引物(表1),以β-actin基因为内参,用荧光定量PCR仪(Light Cycler 96 SW1.1,罗氏)测定不同胁迫条件下的NKCC1、NBC1、AQP1、NHE1基因表达量的变化。实时荧光定量PCR试验使用天根生化科技(北京)有限公司试剂盒完成。PCR反应体系为20 μL:2×miRcute Plus miRNA Premix 10.0 μL,上、下游引物各0.4 μL,cDNA模板1 μL,ddH2O 8.2 μL。反应程序:95 ℃预变性15 min;94 ℃变性30 s,60 ℃退火60 s,循环40次。

表1 NKCC1、NBC1、AQP1、NHE1基因实时荧光定量PCR引物参数
1.6 数据处理
试验鱼的存活率(RS,%)、肝体指数(ωHIS,%)、肥满度(CF)、平均体质量增长率(wWGR,%)、平均体长增长率(RLG,%)、特定生长率(RSG,%/d)按下式计算[25]:
RS=nt/n0×100%
(1)
wHIS=mg/mk×100%
(2)
CF=100m/L3
(3)
wWGR=(mt-m0)/m0×100%
(4)
RLG=(Lt-L0)/L0×100%
(5)
RSG=(lnmt-lnm0)/t×100%
(6)
式中,n0为幼鱼试验初始数量(尾),nt为终末数量(尾),t为试验幼鱼的饲养天数(d),mk为鱼体去除内脏的质量(g),mg为肝质量(g),m为幼鱼体质量,L为幼鱼体长,m0为初始体质量(g),mt为终末体质量(g),L0为初始体长(mm),Lt为终末体长(mm)。
各基因表达均以β-actin基因为内参,使用2-ΔΔCt法[26-27]对基因的表达量进行分析。所有试验数据均用平均值±标准差表示,并用SPSS 25.0软件进行单因素方差分析和邓肯多重比较,做归一化处理后,使用Origin 2018作图。
2 结 果
2.1 不同盐度下青海湖裸鲤的生长性能
经15 d的饲养,不同盐度条件下体质量与盐度均呈负相关关系,盐度0组终末体质量最高,且与盐度10组和盐度15组相比差异显著(P<0.05)。盐度5组与盐度10组间差异不显著(P>0.05)(表2)。平均体质量增长率和特定生长率最大值均出现在盐度0组,且盐度0组与盐度5组间、盐度10组和盐度15组间差异不显著(P>0.05),但盐度5组和盐度10、15组间差异显著(P<0.05)。终末体长在盐度0组最高,盐度15组最低,且差异显著(P<0.05)。
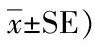
表2 不同盐度胁迫15 d后体质量、体长变化(n=10;平均值±标准误)
胁迫30 d时,随着盐度的升高体质量呈现下降趋势,盐度0组和盐度5组间、盐度10组和盐度15组间差异不显著(P>0.05)(表3)。盐度0组和盐度5组特定生长率差异不显著(P>0.05);盐度15组的特定生长率最低,且与其他组差异显著(P<0.05)。盐度15组终末体长最低,与其他组差异显著(P<0.05)。盐度0组平均体长增长率最高,盐度15组最低,且均与其他组差异显著(P<0.05)。
表3 不同盐度胁迫30 d后体质量、体长变化(n=10,平均值±标准误)
不同盐度下饲喂15 d时,终末肝体比与盐度亦呈负相关关系,盐度0组与盐度5组差异不显著(P>0.05),且与盐度10组差异不显著(P>0.05),但与盐度15组差异显著(P<0.05),盐度10组和盐度15组差异不显著(P>0.05)(表4)。盐度0组和盐度10、15组终末脏体比差异显著(P>0.05),但盐度0组和盐度5组终末脏体比差异不显著。盐度5组肥满度最高,与盐度0组、盐度10组差异不显著;盐度15组肥满度最低,与盐度0组差异显著(P<0.05)。
经过30 d的饲养,盐度0组肝体比最大,与盐度10组和盐度15组差异显著(P<0.05)(表5)。盐度5组脏体比最高,与盐度0组差异不显著(P>0.05),与盐度10、15组有显著差异。盐度10组肥满度最低,与其他3组差异显著(P<0.05),盐度0、5、15组之间的肥满度差异不显著(P>0.05)。

表4 不同盐度胁迫15 d后存活率、脏器系数、肥满度变化(n=10,平均值±标准误)
表5 不同盐度胁迫30 d后存活率、脏器系数、肥满度变化(n=10,平均值±标准误)
2.2 淡水养殖条件下青海湖裸鲤NKCC1、NBC1、AQP1、NHE1基因的相对表达
检测淡水养殖条件下的NKCC1基因的相对表达量,肾脏中NKCC1基因的相对表达量最高,显著高于鳃和肝脏中的相对表达量(P<0.05),鳃和肝脏中的相对表达量差异不显著(P>0.05)(图1a)。NBC1基因在鳃、肾脏、肝脏中均表达,肾脏中的相对表达量显著高于鳃和肝脏中的相对表达量(P<0.05),鳃和肝脏中的相对表达量差异不显著(P>0.05)(图1b)。AQP1基因在各个组织中均有表达,且3个组织中的相对表达量差异均不显著(P>0.05)(图1c)。NHE1基因在肝脏中的相对表达量本底值最高,与鳃和肾脏的相对表达量相比差异显著(P<0.05),鳃和肾脏中的相对表达量差异不显著(P>0.05)(图1d)。
2.3 不同盐度胁迫下各基因的相对表达
2.3.1 NKCC1基因的相对表达
NKCC1基因的相对表达结果(图2)显示:盐度5胁迫下青海湖裸鲤鳃中NKCC1基因相对表达量急剧上调,在6 h时达到峰值且与对照组差异显著(P<0.05),6 h后相对表达量降至与对照组差异不显著(P>0.05);肾脏中的相对表达量趋势为下调,且直至试验结束仍与对照组差异显著(P<0.05);NKCC1基因在肝脏中的相对表达量一直低于对照组,且差异显著(P<0.05)。盐度15胁迫下青海湖裸鲤鳃中NKCC1基因相对表达量呈先上调后下调的趋势,在24 h时达到峰值,且与对照组差异显著(P<0.05),随后下调至与对照组相比差异不显著(P>0.05);肾脏中相对表达量先呈下调趋势,但12 h时有显著上调,上调之后与对照组差异不显著(P>0.05);盐度15组胁迫后NKCC1基因在肝脏中的相对表达量与盐度5组类似。

图1 淡水养殖条件下青海湖裸鲤NKCC1、NBC1、NHE1、AQP1基因的表达Fig.1 Expression level of NKCC1, NBC1, NHE1 and AQP1 genes in G. przewalshii under freshwater culture不同小写字母表示各组织之间差异显著(P<0.05).Different letters indicate significant differences between tissues (P<0.05).

图2 NKCC1基因的相对表达Fig.2 Relative expression level of NKCC1 gene不同字母或数字表示同一处理不同时间点差异显著(P<0.05),相同字母或数字表示同一处理不同时间点差异不显著(P>0.05),下同.Different letters or numbers denote significant differences from the same treatment at different time (P<0.05); the same letter or number means no significant differences from the same treatment at different time (P>0.05). et sequentia.
2.3.2 NBC1基因的相对表达
NBC1基因的相对表达结果(图3)显示:盐度5胁迫下青海湖裸鲤鳃中NBC1基因的相对表达量急剧上调,在6 h时达到峰值,与对照组差异显著(P<0.05),随后下调至与对照组相比差异不显著(P<0.05);肾脏中的相对表达量趋势为先上调后下调,24 h时达到最大值且与对照组差异显著(P<0.05),24 h后下调至正常水平;NBC1基因在肝脏中的相对表达量一直低于对照组,且差异显著(P<0.05)。盐度15胁迫下青海湖裸鲤鳃中NBC1基因的相对表达量呈上调趋势,在24 h时相对表达量达到最大值,与对照组差异显著(P<0.05),随后显著下调,96 h时下调至正常水平(P<0.05);肾脏中的相对表达量在试验期间未发生明显变化,各个时间点的相对表达均与对照组差异不显著(P<0.05);NBC1基因在肝脏中的相对表达量一直低于对照组,且差异显著(P<0.05)(图3b)。

图3 NBC1基因的相对表达Fig.3 Relative expression level of NBC1 gene
2.3.3 NHE1基因的相对表达
NHE1基因的相对表达结果(图4)显示:盐度5胁迫下青海湖裸鲤鳃中NHE1基因相对表达量急剧上调,在6 h时相对表达量达到峰值,与对照组差异显著(P<0.05),随后下调至正常水平;肾脏中的相对表达量为先上后下的趋势,12 h时相对表达量最高,且与对照组间差异显著(P<0.05),24 h后下调至与对照组差异不显著的水平;NHE1基因在肝脏中的相对表达量一直低于对照组,且差异显著(P<0.05)。盐度15胁迫下青海湖裸鲤鳃中NHE1基因相对表达量呈上调趋势,在48 h时达到峰值,与对照组间差异显著(P<0.05),随后下调至与对照组相比差异不显著的水平(P<0.05);肾脏中的相对表达量呈现上调趋势,48 h时表达量达到最高,且与对照组间差异显著(P<0.05),直至96 h试验结束,肾脏中NHE1基因的相对表达量仍显著高于对照组;盐度15组NHE1基因在肝脏中的相对表达模式与盐度5组相同。
2.3.4 AQP1基因的相对表达
AQP1基因的相对表达结果(图5)显示:盐度5胁迫下青海湖裸鲤鳃中AQP1基因相对表达量急剧上调,在6 h时表达量达到峰值,随后呈下调趋势,且与对照组差异不显著(P>0.05);肾脏中的表达量呈先上调后下调的趋势,6 h至24 h时均显著高于对照组(P<0.05),随后恢复至与对照组差异不显著的水平(P>0.05);AQP1基因在肝脏中的相对表达量一直低于对照组,且差异显著(P<0.05)。盐度15胁迫下青海湖裸鲤鳃中AQP1基因相对表达量急剧上调,在24 h时达到峰值,与对照组差异显著(P<0.05),随后呈显著下调趋势,但直至96 h试验结束,AQP1基因的表达水平仍显著高于对照组(P<0.05);肾脏中的相对表达量为下调的趋势,96 h时表达量达到峰值,且与对照组差异显著(P<0.05);盐度15组AQP1基因在肝脏中的相对表达量与盐度5组类似。
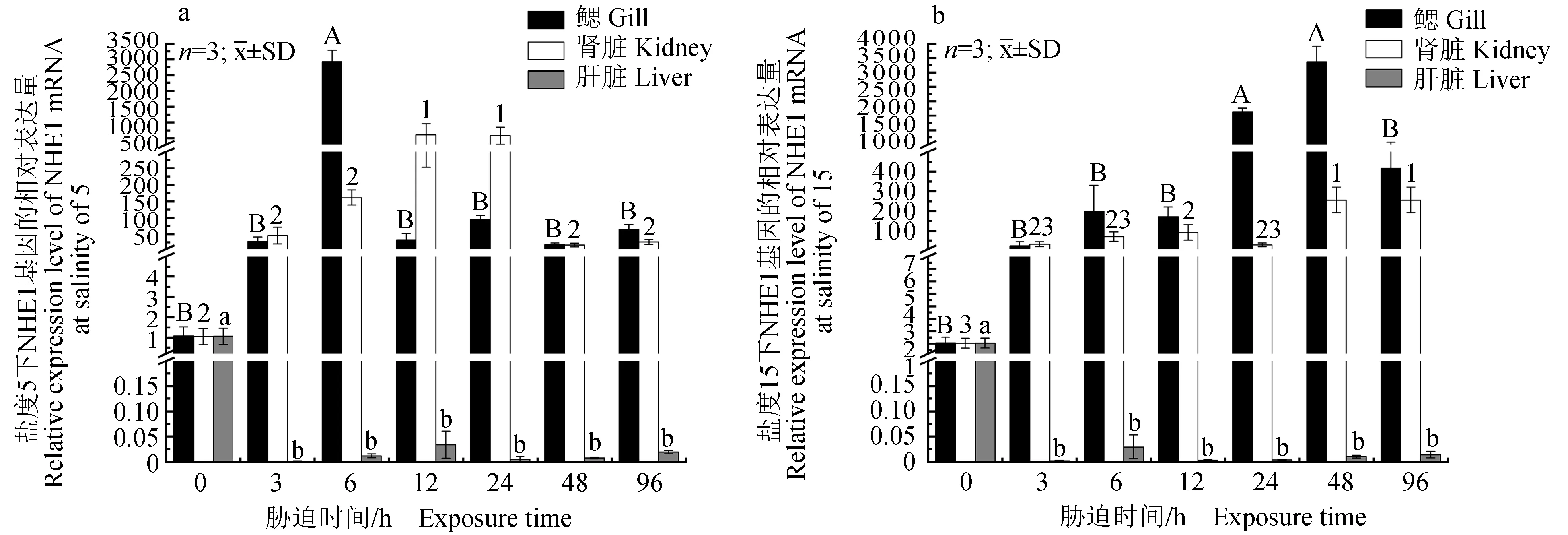
图4 NHE1基因的相对表达Fig4 Relative expression level of NHE1 gene

图5 AQP1基因的相对表达Fig.5 Relative expression level of AQP1 gene
3 讨 论
3.1 盐度对青海湖裸鲤生长性能的影响
盐度作为水体重要的环境因子之一,是影响广盐性鱼类生存的重要因素[24],盐度的转变会引起鱼体的应激反应。有研究显示,急剧变化的盐度会导致低盐度组或高盐度组鱼类的生长速度变缓,面对高盐度环境时,鱼体内有大量盐分积累,高盐环境会对皮肤和鳃等器官造成损伤,并扰乱体内外的渗透平衡,进而影响生理机能,甚至可能造成死亡[20]。鱼类在面对盐度改变时,需要消耗大量能量去调节体内渗透压以维持机体的内环境稳态,调节渗透压所需能量通常占基本生命活动所必需总能量的10%~20%,甚至高达或多于50%[28]。褐菖鲉(Sebastisucusmarmoratus)[29]的幼鱼对盐度有非常强的耐受力,盐度7.5~30下均能正常存活,而盐度15~25下该鱼特定生长率较大。这表明盐度10~25更适宜褐菖鲉幼鱼生长。黄姑鱼(Nibeaalbiflora)[30]在盐度42的条件下,其特定生长率、肝体比均比低盐度下小且差异显著(P<0.05)。在本试验中,经不同盐度试验15 d和30 d后,盐度10、15组与其余盐度组的各生长指标差异显著(P<0.05),高盐度下青海湖裸鲤体质量、体长、特定生长率、肝体比、脏体比和肥满度均较小。这表明在本试验中高盐度对青海湖裸鲤的生长存在抑制。原因可能为:青海湖裸鲤在对盐度变化的过程中需要消耗大量能量来维持体内外渗透压稳定,从而影响其生长发育。由此可见,盐度也是野生型青海湖裸鲤相较人工淡水养殖条件生长速度缓慢的原因之一。
3.2 不同盐度胁迫对青海湖裸鲤渗透相关基因表达的影响
NKCCla是一种电中性跨膜转运蛋白,其进行离子跨膜运输的运输比例为:1Na+∶1K+∶2Cl-,NKCCla存在NKCC1和NKCC2两种亚型[31]。鳃的渗透调节机制和离子转运蛋白基因的表达与盐度适应有关。研究发现,泌氯细胞内部大量分布有像Na+/K+-ATP酶、NKCC、NHE3等蛋白,这些蛋白与离子运输密切相关[32-33],且均具有调节吸收和分泌K+、Na+、Cl-离子的功能[34],机体内外渗透压的平衡主要依靠这些鳃上的蛋白进行调节。有研究表明,莫桑比克罗非鱼(Oreochromismossambicus)[35]经过不同盐度条件的胁迫,NKCCla在其鳃组织中高度表达,该结果可能与渗透压调节活动及鳃丝氯细胞盐分泌关联甚广。在本试验中,经不同盐度胁迫后,青海湖裸鲤鳃中NKCC1基因的表达量均显著上调,但在肾脏中出现下调趋势,这种现象的出现可能因为肾中调控机制与鳃有所不同,推测NKCC1基因表达量的降低可能与蛋白酪氨酸激酶或环嘌呤核苷酸依赖的激酶降低了其对渗透压的敏感性有关[36]。
NHE是一种双向离子交换载体蛋白,一般处于细胞的顶膜或基底膜外侧,具有催化细胞内H+和细胞外Na+的电中性交换的作用[38]。Edwards等[39]研究显示,NHE基因可能参与渗透调节,特别是在鱼类适应盐度变化的环境时发挥重要作用。在本试验中,面临盐度压力时,青海湖裸鲤鳃和肾脏中的NHE1基因表达均出现显著上调。有研究显示,大菱鲆(Scophthalmusmaximus)经盐度胁迫后,NHE1基因在鳃、肾脏、肠道中的表达量均显著升高[40]。这与本试验结果一致,推测NHE1基因也参与了青海湖裸鲤的渗透调节过程。
AQPs是一组跨膜蛋白家族,作为水分的传输通道,允许水在细胞膜中自由流动,对维持参与渗透调节和体液稳态的器官中的水分的平衡具有重要作用[41]。暗纹东方鲀(Takifuguobscurus)[42]和卵形鲳鲹(Trachinotusovatus)[43]在盐度胁迫下肠道和肾脏中的AQP1基因表达量上升,在低渗胁迫下肾脏和肠道中的AQP1基因表达量则下降。而低盐胁迫后的大菱鲆[40]AQP1基因在肾脏和肠道中的表达量显著升高,在鳃中的表达量无明显变化,说明AQP1基因在不同物种和组织中的功能特异。本试验中,经盐度胁迫后,青海湖裸鲤鳃和肾脏中的AQP1基因的表达显著上调,推测是因为青海湖裸鲤受盐度影响后,鳃和肾脏中AQP1基因大量表达,以排出体内多余水分。

4 结 论
起始体质量为(18.414±0.613) g的青海湖裸鲤在盐度0、5、10、15条件下,30 d内呈现出不同的生长趋势,高盐度下青海湖裸鲤体质量、体长、特定生长率、肝体比、脏体比和肥满度均较低,各项指标表现出盐度和时间依赖性,高盐度可能对青海湖裸鲤的生长产生抑制。NKCC1、NBC1、NHE1、AQP1 4个基因在应对不同盐度、不同时间时呈现出不同的表达模式并表现出组织特异性。面临盐度胁迫时,各基因在鳃组织中均有明显上调,在肾脏组织中也有不同变化,但在肝脏中的表达受到了抑制。表明其参与青海湖裸鲤渗透调节时发挥着不同的作用。鳃、肾脏和肝脏共同参与了渗透压的调节,对维持青海湖裸鲤体内外的动态平衡起到重要作用。本研究结果可为后续对青海湖裸鲤渗透调节作用机制的研究提供前期研究依据,也可为青海湖裸鲤人工养殖及增殖放流提供理论支持。
