LncRNA MCM 3AP-AS1在弥漫性大B细胞淋巴瘤患者中的表达及临床意义
2022-07-19李瑞花蒋引娣刘接班
李瑞花,蒋引娣,刘接班
咸阳市中心医院血液内科,陕西 咸阳 712000
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一种恶性B细胞淋巴瘤,其5年生存率介于32%~81%[1]。目前,DLBCL的发病机制仍不明确,导致治疗方式较为局限,病死率居高不下[2]。因此将新兴的分子靶向治疗应用于DLBCL有着重要意义。近年来,许多研究表明长链非编码RNA(lncRNA)通过调节肿瘤相关基因的表达参与肿瘤发病过程,可以作为治疗靶点或预后指标[2]。长链非编码RNA微小染色体维系蛋白3结合蛋白反义1(long non-coding RNA Microchromosome maintenance protein 3-associated protein antisense 1,lncRNA MCM3AP-AS1)位于人类染色体21q22.3上,参与调节多种疾病中的蛋白表达,并与宫颈癌、口腔鳞癌、前列腺癌、肝癌、非小细胞癌、子宫内膜癌等癌症发病机制有关[3-6]。研究表明,lncRNA可以通过与微小RNA(microRNA,miR)结合来影响肿瘤相关基因的表达[7]。HOU等[4]有关口腔鳞癌的研究结果显示,MCM3AP-AS1在口腔鳞癌中的高表达与口腔鳞癌患者不良预后有关,MCM3AP-AS1直接靶向抑制miR-363-5P,对口腔鳞癌的发展产生促进作用。SHEN等[6]的研究表明,MCM3AP-AS1在非小细胞癌组织及癌细胞中呈上调表达且能够加速病情进展,miR-195-5p则下调表达,MCM3AP-AS1通过直接靶向抑制miR-195-5p来促进非小细胞癌的发展。然而,MCM3AP-AS1、miR-195-5p在DLBCL中的作用尚不清楚。因此,本研究通过探讨MCM3AP-AS1、miR-195-5p在DLBCL组织中的表达,初步分析两者在DLBCL中的临床意义。
1 资料与方法
1.1 一般资料共纳入于2017年1月至2018年7月在咸阳市中心医院血液内科接受手术治疗的DLBCL患者80例,并在术中收集组织样本(癌组织及其对应的癌旁组织),样本离体后,迅速置于液氮中保存。纳入标准:所有患者的诊断标准均符合世界卫生组织(WHO)淋巴肿瘤诊断分类标准(2017年)[8];入组前未接受放疗或化疗者。排除标准:(1)无法行化疗、放疗者;(2)继发性DLBCL;(3)既往有非DLBCL的恶性肿瘤史;(4)有精神疾病。本研究严格按照伦理委员会批准的方案进行,所有研究对象均自愿参加并签署知情同意书。收集患者性别、年龄等一般资料,以及原发部位(结外或结内)、血清乳酸脱氢酶水平、肿瘤直径、B症状、国际预后指数(IPI)评分、病理分型、临床分期(Ann Arbor分期)[9]等临床病理资料。其中年龄<60岁36例、≥60岁44例;男性41例,女性39例;乳酸脱氢酶水平正常者42例,升高者38例;原发部位在淋巴结外35例,淋巴结内45例。
1.2 荧光定量PCR检测MCM3AP-AS1和miR-195-5p表达水平取-80℃冻存的样品,液氮磨样后取50~100 mg样品,使用试剂盒(QIAGEN,美国)提取总RNA,超微量核酸蛋白分析仪(Biofuture,英国)检测RNA质量,以OD260/OD280值在1.8~2.0之间为质量较好,然后使用反转录试剂盒(QIAGEN,德国)进行反转录,按照SYBRGreen试剂盒(Invitrogen,美国)说明书配置反应体系,并在实时定量PCR检测仪(Corbett Research,澳大利亚)上分析样品。MCM3AP-AS1以GAPDH为内参,miR-195-5p以U6为内参,采用2-△△Ct法计算MCM3AP-AS1和miR-195-5p表达水平。本研究所有引物均由上海英潍捷基生物公司合成,具体序列见表1。

表1 引物序列
1.3 随访入组患者均于术后每6个月随访一次,以复诊或电话方式进行,准确记录随访结果,随访时间截至2021年8月,共3年。无失访者。
1.4 统计学方法所有数据均使用SPSS25.0软件分析。计数资料以例表示,计量资料以均值±标准差(±s)表示;组间差异分析行χ2检验或t检验;MCM3AP-AS1与miR-195-5p相关性分析使用Pearson法;Logistics回归分析影响DLBCL患者预后的因素;构建Kaplan-Meier生存曲线比较MCM3AP-AS1、miR-195-5p不同表达水平与患者术后3年累积生存率的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 DLBCL癌组织及其癌旁组织的MCM3AP-A-S1、miR-195-5p表达水平比较DLBCL癌组织中MCM3AP-AS1表达水平明显高于癌旁组织,而miR-195-5p表达水平明显低于癌旁组织,差异均有统计学意义(P<0.05),见表2。
表2 DLBCL癌组织及其癌旁组织的MCM 3AP-AS1和mi R-195-5p表达水平比较(±s)
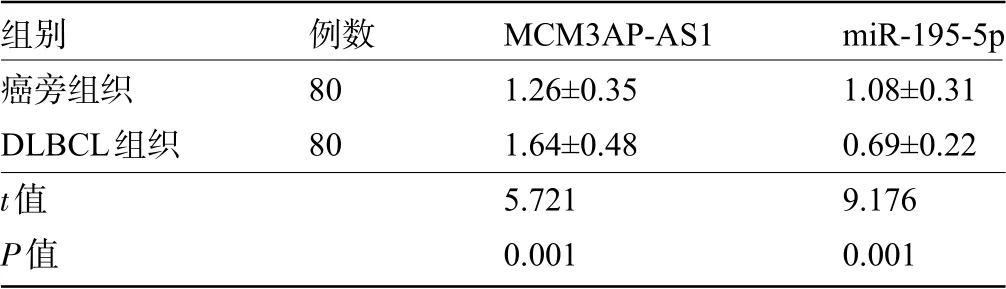
表2 DLBCL癌组织及其癌旁组织的MCM 3AP-AS1和mi R-195-5p表达水平比较(±s)
2.2 MCM3AP-AS1与miR-195-5p的相关性Pearson相关性分析显示,DLBCL患者癌组织中MCM3AP-AS1与miR-195-5p表达水平呈负相关(r=-0.560,P=0.000),见图1。
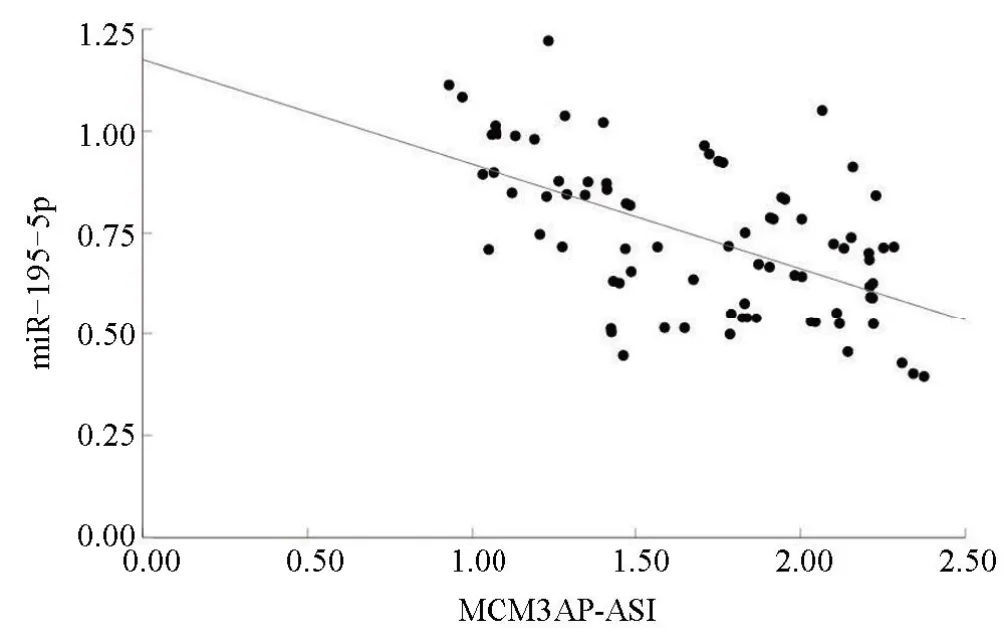
图1 MCM 3AP-AS1与miR-195-5p的相关性
2.3 癌组织MCM3AP-AS1、miR-195-5p表达水平与DLBCL患者临床病理特征的关系分别以DLBCL癌组织中MCM3AP-AS1、miR-195-5p表达水平的平均值为界限,将DLBCL患者分为MCM3AP-AS1高表达组(41例)和低表达组(39例),miR-195-5p高表达(37例)和低表达组(43例)。MCM3AP-AS1、miR-195-5p不同表达水平与患者年龄、性别、原发部位、血清乳酸脱氢酶水平无显著相关性(P>0.05);MCM3AP-AS1、miR-195-5p不同表达水平与患者B症状、临床分期、IPI评分、肿瘤直径有关(P<0.05),见表3。

表3 MCM 3AP-AS1、miR-195-5p水平与DLBCL患者临床病理特征的关系(例)
2.4 MCM3AP-AS1、miR-195-5p表达水平与DLBCL患者生存时间的关系80例患者术后随访3年,其中27例死亡,53例生存,总生存率为66.25%。MCM3AP-AS1高表达组患者的平均生存时间为27.37个月、低表达组患者平均生存时间为32.03个月,MCM3AP-AS1高表达组患者的累积生存率为41.46%,低于低表达组的66.67%(Logrankχ2=5.888,P=0.015)。miR-195-5p高表达组、低表达组患者生存时间均值分别为31.76个月、27.81个月,其中低表达组患者累积生存率为41.86%,显著低于高表达组的67.57%(Logrankχ2=5.230,P=0.022),见图2。
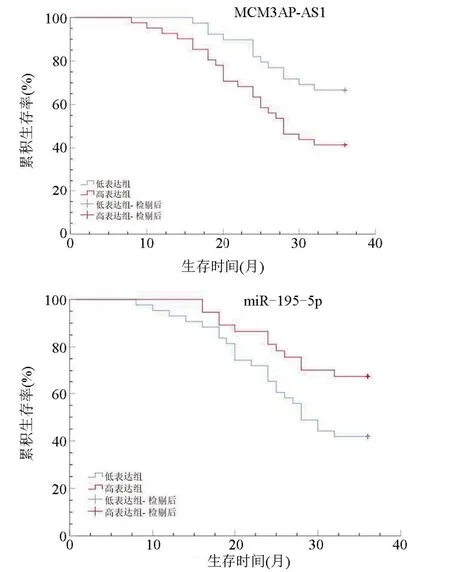
图2 MCM3AP-AS1、miR-195-5p表达水平与DLBCL患者累积生存率的关系
2.5 影响DLBCL患者预后的因素将MCM3A P-AS1、miR-195-5p以及表3中有差异的临床分期、B症状、IPI评分、肿瘤直径纳入Logistics回归分析。结果显示,MCM3AP-AS1、miR-195-5p水平以及IPI评分、临床分期、B症状是影响患者预后的主要因素(P<0.05),见表4。

表4 影响DLBCL患者预后的多因素Logistics回归分析结果
3 讨论
DLBCL是一种侵袭性的淋巴系统增生性疾病,属于非霍奇金淋巴瘤(NHL)常见的亚型,并占所有NHL病例数的1/3以上[10]。DLBCL作为一种淋巴瘤,可在人体的任何部位发病,给患者生命带来巨大威胁。DLBCL的主要临床症状为无痛性进行性肿块增大,伴有盗汗、发热,其主要治疗方案为全身放疗、一线化疗方案为R-CHOP(rituximab combined with CHOP)方案,尽管R-CHOP方案对DLBCL的治疗有效,但是超一半的患者会出现化疗耐药、转移、复发,导致五年生存率非常低[11]。因此,寻找新的有效治疗靶点及探究DLBCL发病分子机制对改善预后尤为重要。
lncRNA与胰腺癌、肝癌、前列腺癌、胃癌、乳腺癌等多种肿瘤的发生有关,被认为是癌症治疗的靶点,同时其在DLBCL发病过程、预后及耐药性中也起着重要作用[2,12]。例如,研究显示lncRNA SNHG8在DLBCL中表达水平增加,将其沉默后则对DLBCL细胞增殖产生抑制并促进其凋亡[12]。张宁等[13]发现,lncRNA BCAR4在DLBCL患者血清中高表达,其高表达不仅与较大的肿瘤、较高分期、较高IPI评分、有B症状相关,还与较差预后有关。值得注意的是,MCM3AP-AS1也在多种癌症中发挥促癌作用。ZHOU等[14]发现MCM3AP-AS1在结直肠癌组织中上调表达,并与结直肠癌患者预后不良有关,将其沉默后显著抑制了癌细胞迁移能力。YU等[5]通过qRT-PCR技术检测子宫内膜癌组织中MCM3AP-AS1的表达水平发现,MCM3AP-AS1在子宫内膜癌中显著上调表达,其高表达与较低的生存率相关。此外,在非小细胞癌中MCM3AP-AS1的高表达与患者较大的肿瘤直径大小、低分化、较高的TNM分期密切相关[6]。结合本研究中MCM3AP-AS1在癌组织中的表达水平升高,其表达水平与B症状、临床分期、IPI评分、肿瘤直径有关,说明MCM3AP-AS1可能参与调控DLBCL病理过程。
miRNA参与调控人体基础代谢、细胞分化、细胞增殖等过程,并在肿瘤中异常表达且参与调控肿瘤相关基因。位于17号染色体上的miR-195被认为是肿瘤增殖的抑制剂,在肿瘤治疗中具有广阔的前景[15]。其中,miR-195-5p在多种肿瘤中低表达,例如宫颈癌、喉癌、结直肠癌、卵巢癌,表明miR-195-5p与肿瘤细胞侵袭和转移有关[15]。张小婷[16]的研究结果显示,miR-195-5p在卵巢癌患者血清中表达水平降低,其表达水平与糖类抗原125、病理分级、国际妇产科联盟分期、淋巴转移及较低的生存率有关。韩肖骅等[17]发现,乳腺癌患者血清miR-195-5p水平显著升高,其表达水平与患者孕激素受体、淋巴结转移、分子分型、TNM分期等密切相关,对乳腺癌的诊断有一定的价值。另有研究显示,DLBCL组织中miR-195表达下调发挥抑癌基因功能[9]。结合本研究中miR-195-5p的低表达,并且miR-195-5p的不同表达水平与患者临床分期、B症状、IPI评分、肿瘤直径具有明显相关性,提示miR-195-5p可能负向调控DLBCL发病进程。
在肿瘤发展过程中,具有miRNA结合位点的lncRNA可以竞争性和miRNA结合,两者相互作用调节彼此的表达[1]。先前研究显示,MCM3AP-AS1可以与miR-194-5p、miR-138-5p、miR-211-5p和miR-142-3p等多种miRNA结合共同调控疾病进展[14]。赵天增等[18]研究了MCM3AP-AS1对肺癌细胞增殖、迁移的影响,结果显示肺癌细胞中MCM3AP-AS1表达水平显著增加,抑制其表达可对癌细胞增殖产生消极作用,miR-16-5p在癌细胞中表达下调,将miR-16-5p过表达同样对癌细胞产生抑制,进一步分析发现MCM3AP-AS1通过靶向负调控miR-16-5p的表达来影响肺癌细胞的生物活动。SHEN等[6]的研究发现,在非小细胞癌中MCM3AP-AS1上调表达,其高表达会促进癌细胞的迁移、侵袭等,而miR-195-5p在癌组织中下调表达且是MCM3AP-AS1的靶点,MCM3AP-AS1通过靶向抑制miR-195-5p来发挥促癌作用。本研究中Pearson结果显示MCM3AP-AS1与miR-195-5p呈 负 相 关(r=-0.560,P=0.000),提 示 在DLBCL中MCM3AP-AS1可能通过直接负调控miR-195-5p的表达来加重病情。本研究中Logistics回归分析结果显示,MCM3AP-AS1、miR-195-5p、临床分期、B症状、IPI评分是影响该病患者预后的主要因素(P<0.05)。吴亮等[19]的研究也指出IPI评分高、临床分期高、有B症状是影响DLBCL患者术后生存情况的危险因素。通过构建术后3年的生存分析曲线,结果显示MCM3AP-AS1低表达、miR-195-5p高表达时的患者累积生存率较高,提示当DLBCL组织中MCM3AP-AS1低表达、miR-195-5p高表达时,DLBCL患者预后较好。以上结果提示,MCM3AP-AS1、miR-195-5p与DLBCL的发生、发展密切相关,推测其分别发挥促癌基因、抑癌基因功能。
综上所述,DLBCL患者癌组织中MCM3AP-AS1高表达,miR-195-5p呈低表达,两者呈负相关,当MCM3AP-AS1高表达、miR-195-5p低表达时患者预后效果较差。本研究结果提示MCM3AP-AS1可能是治疗DLBCL的一个有前景的新靶点。但是,本研究纳入的样本量有限,影响DLBCL不良预后的危险因素未能完全分析,且MCM3AP-AS1、miR-195-5p对癌细胞的具体调控方式仍需进一步研究。
