早期血运重建对室壁运动正常的急性非ST段抬高心肌梗死患者左心室应变的影响
2022-07-19徐茂椿陆纪德贾照英袁晓菲许嘉鸿
徐茂椿, 沈 燕, 陆纪德, 王 璐, 贾照英, 袁晓菲,齐 元, 许嘉鸿, 刘 淼
(1. 上海市浦东新区公利医院心内科,上海 200135; 2. 上海市浦东新区公利医院心脏超声科,上海 200135)
急性非ST段抬高的心肌梗死(non-ST-segment elevation myocardial infarction, NSTEMI)是心血管疾病所致死亡的主要原因之一。与ST段抬高型心肌梗死(ST-segment elevation myocardial infarction, STEMI)患者相比,NSTEMI患者诊断的特异性较差,未经及时治疗的患者可能会演变为完全冠状动脉闭塞的STEMI,从而导致左心室(left ventricular, LV)功能障碍造成不良的预后[1-2]。因此该类患者的介入时机尤为重要,但对于术前常规心超检查提示室壁运动正常的NSTEMI患者,行早期介入是否更有利于心室收缩功能的改善,目前临床上缺乏更精确的检测数据,以提供更好的循证依据。假设在室壁运动正常的NSTEMI患者中,早期介入干预可能更好地改善左心室收缩功能。因此,本研究运用二维斑点追踪成像(two-dimensional speckle tracking imaging, 2D-STI)技术评估早期和延迟两种不同介入时机对该类患者左心室应变的影响。
1 资料与方法
1.1 一般资料
选取2018年11—2020年11月上海市浦东新区公利医院心内科确诊的NSTEMI患者,经常规心超检查明确室壁运动正常后[3],随机分为2组: (1) 早期血运重建组(early intervention group, EG)42例,其中男20例,女22例,年龄50~75岁。(2) 延迟血运重建组(delayed intervention group, DG)组40例,其中男19例,女21例,年龄51~76岁。入选标准: (1) NSTEMI诊断标准参照中国不稳定心绞痛和非ST段抬高心肌梗死诊断与治疗指南。(2) 血管病变定义为冠脉存在≥70%狭窄病变。(3) 能获得较清晰的左室短轴及长轴基底段、中间段及心尖段切面图像。排除标准: (1) 合并严重瓣膜病变;(2) 慢性闭塞病变;(3) 房颤;(4) 严重三支病变;(5) 合并心源性休克及机械并发症;(6) 既往存在心肌梗死病史或冠脉支架植入术史;(7) 合并慢性支气管炎,肺气肿。另设正常对照组(normal control, NC)组40例,其中男18例,女22例,年龄50~68岁。本研究得到我院伦理委员会的批准[伦理号: (2017)公利医院伦审字第glll-038号]。所有参与者在检查前均提供了书面知情同意书。所有患者均按照现行指南治疗[2]。
1.2 方法
1.2.1 介入程序和定义 根据年龄、心率、收缩压、Killip分级、心脏骤停、ST段偏移、血清肌酐水平、心脏生物标记数据,计算GRACE风险评分。所有患者均为首次心肌梗死和首次PCI。经心超检查明确室壁运动情况后,以1∶1的比例,随机分配至DG组(24~72 h)和的EG组(12 h内)。根据指南,早期血运重建策略的定义为入院24 h内行冠脉介入[2]。结合我院绿色通道的优化情况,本研究早期血运重建时间限定于12 h内。所有患者术后长期服用双联抗血小板治疗。
1.2.2 图像采集 患者到达急救室中位时间1.5 h(0.8 h,3.2 h)后进行超声心动图检查。由2名对研究方案不知情的超声医师独立进行。使用Philips iE 33彩色多普勒超声诊断仪,采用双平面Simpson’s公式计算左室射血分数(left ventricular ejection fraction, LVEF)。2D-STI检查前,均未使用β受体阻滞剂和硝酸酯类药物,检查时连接心电图,并监测血压。于胸骨旁短轴采集3个水平图像。基底水平观采集标准为清晰显示二尖瓣的2个瓣叶;心尖水平观采集标准为乳头肌消失,靠近心尖部。经胸骨旁长轴获取3个心尖长轴切面。每个指标获取3个连续心动周期的值,并存储在硬盘上进行离线分析。手术后1个月及1年均于静息状态下进行超声复查。
1.2.3 图像分析 使用Qlab 9.0中CMQ软件进行分析。选择对应切面,软件自动绘制心肌区域,手动调节测定线与心肌走形一致,于二尖瓣短轴切面、乳头肌短轴切面及心尖水平短轴切面获取组织运动曲线,显示左室心内膜、心外膜旋转角度、左室圆周应变(circumferential strain, CS)。根据18节段的收缩末期平均值计算左室的整体圆周应变(global circumferential strain, GCS)。从3个心尖长轴切面(三腔、四腔和二腔)获取运动曲线后,显示整体纵向应变(global longitudinal strain, GLS)。每个长轴切面又细分为基底段(B),中间段(M)和心尖段(Ap),显示不同节段纵向应变。以上所有测值均取3个心动周期平均值,时间参数均采用心率标化。
1.2.4 室壁运动评分 17节段左室模型中,根据节段运动幅度和收缩期增厚率来评估室壁运动情况。节段性室壁运动评分如下。增强: 0分;正常: 1分;减弱: 2分;消失: 3分;矛盾运动: 4分。室壁运动指数(wall-motion score index, WMSI)由所有节段的每个点的平均值计算得出[3]。
1.3 统计学处理

2 结 果
2.1 临床和冠脉介入特征
在纳入的82例患者中,EG组1例未能完成随访超声检查,故共有81例纳入研究,EG组41例,DG组40例。2组间年龄、心率、静息时血压、高血压、糖尿病和高脂血症发病率差异无统计学意义。2组患者β受体及血管紧张素类药物使用率差异无统计学意义。3组常规心脏超声检查指标无统计学差异,见表1。

表1 2组临床和冠脉介入资料Tab.1 Comparing of clinical and angiographic characteristics of patients between two groups
左室舒张末容积(left ventricular end-diastolic volume, LVEDV);左室收缩末容积(left ventricular end-systolic volume, LVESV);左室舒张末内径(left ventricular internal diameter at end-diastole, LVIDd);左室收缩末内径(left ventricular internal diameter at end-systole, LVIDs)
2.2 左室整体应变
再灌注术前,2介入组GCS峰值较NC组均显著增高(P<0.01),GLS峰值较NC组均显著降低(P<0.01),2组间差异无统计学意义,见表2、图1。术后1个月及1年,2组GCS峰值较术前降低(P均<0.01),与NC组比较,差异无统计学意义;GLS峰值比较,EG组较DG组显著增高(P<0.01),与NC组比较,差异无统计学意义,见表2。
表2 血运重建前后2组左室扭转及收缩功能指标比较Tab.2 Conventional echocardiographic parameters and global strain parameters between two groups during the PCI procedure
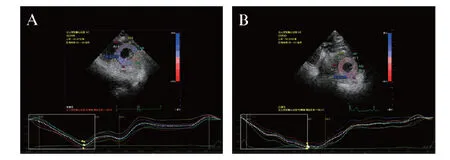
图1 正常对照组和DG组术前的CS比较Fig.1 Comparison of preoperative images of left ventricular CS between normal control groupand myocardial infarction groupA: 正常对照组;B: DG组;AVO: 主动脉瓣开放;AVC: 主动脉瓣关闭;MVO: 二尖瓣开放;以AVC线判定左室收缩末期
2.3 左室节段纵向应变
经3个长轴切面进一步观察左室不同节段的纵向应变(longitudinal strain, LS)。再灌注术后1个月,下壁、前壁、下侧壁与前侧壁的各节段LS,在3组间比较差异无统计意义,见图2~4。前间隔与下间隔的基底段及中间段LS,EG组与DG组比较,差异有统计学意义(P<0.01)。而EG与NC组比较,差异无统计学意义(P<0.01),见图3、4。
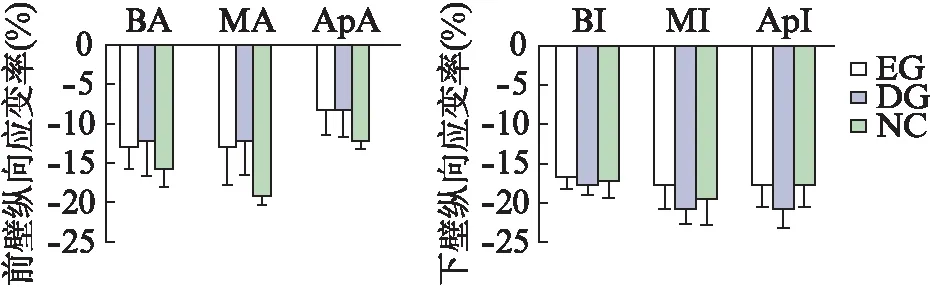
图2 左心室前壁及下壁各节段纵向应变率Fig.2 Longitudinal strain rate of each segment of anterior and inferior wall of left ventricleBA: 前壁基地段;MA: 前壁中间段;ApA: 前壁心尖段;BI: 下壁基底段;MI: 下壁中间段;ApI: 下壁心尖段
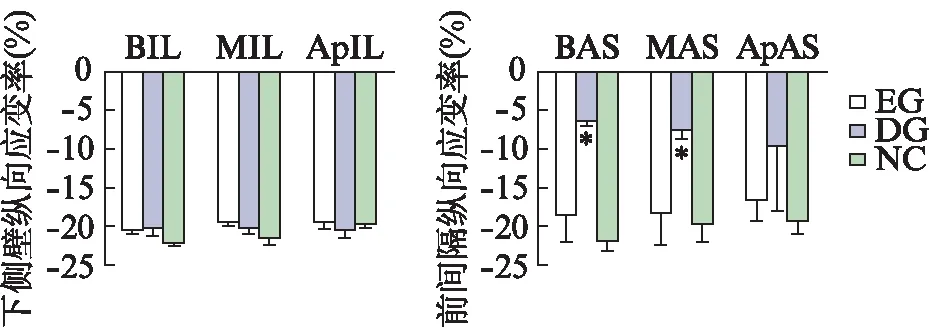
图3 左心室下侧壁及前间隔各节段纵向应变率Fig.3 Longitudinal strain rate of each segment of inferolateral wall and anteroseptal of left ventricleBIL: 下侧壁基底段;MIL: 下侧壁中间段;ApIL: 下侧壁心尖段;BAS: 前间隔基底段;MAS: 前间隔中间段;ApAS: 前间隔心尖段;与EG组相比,*P<0.01
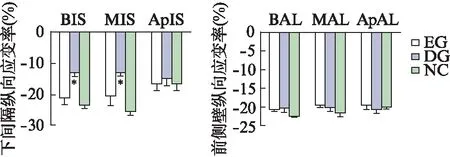
图4 左心室下间隔及前侧壁各节段纵向应变率Fig.4 Longitudinal strain rate of each segment of infero septal and anterolateral of left ventricleBIS: 下间隔基底段;MIS: 下间隔中间段;ApIL: 下间隔心尖段;BAL: 前侧壁基底段;MAL: 前侧壁中间段;ApAL: 前侧壁心尖段;与EG组相比,*P<0.01
3 讨 论
尽管现行指南建议对于特定NSTEMI患者群体采用早期侵入策略,但要全面的识别早期血运重建有益的患者群体仍然存在争论[4-6]。有研究发现对于延迟手术的NSTEMI患者,完全阻塞的罪犯血管发生率显著提高,也就是说,延迟手术可能会使NSTEMI演变为STEMI[5]。同时也有研究发现,半数NSTEMI患者于术前常规二维超声心动图检查提示心肌运动正常[7]。因此,传统的无创检查方法已经无法满足判断患者左室功能改善状态的临床实际需求。随着影像技术的进步,应用2D-STI实时跟踪不同帧频间相同位置的心肌运动轨迹,通过准确地评估心肌运动应变和扭转,可较传统的心超指标更全面地评价心脏的整体功能,其中纵向应变近年来更是被认为较LVEF能更早更精确的反应左室收缩功能[8]。
本研究发现,术前LVEF值正常并且目测室壁运动正常的NSTEMI患者,其左室收缩期纵向应变率(GLS)较正常人群已显著降低[EG组(-14.36±9.34)%vsNC组(-24.17±2.24)%,P<0.01],但GCS却增高或无变化。这与以往的研究结果相一致[9]。可能是由于LVEF和室壁运动评分指数等常规超声心动图参数,是基于体积变化和心肌增厚去判断的,与心室负荷关联性较大,并且无法检测轻度缺血导致的心肌收缩功能改变,因此LVEF正常。NSTEMI发病的早期,由于冠脉尚未完全闭塞,缺血集中于以纵向肌束为主的心内膜下,该区域对局部缺血较以径向和周向肌束组成的心外膜下更为敏感[10]。因此,NSTEMI患者发病早期纵向纤维运动受损显著,而径向和周向纤维不受影响或产生代偿性运动过度。
本研究发现,早期(<12 h)的干预时机能够较(>24 h)的延迟干预更好地改善左室壁运动看似正常患者的整体心肌运动功能,EG组的GLS由术前的(-14.36±9.34)%升至(-25.06±3.45)%,差异有统计学意义(P<0.01)。并且考虑到冠状动脉疾病的超声表现中存在节段性室壁运动异常这一现象,本研究还观察了纵轴各个节段的应变率。结果显示,EG组的室间隔基底段纵向应变(LS-BIS,LS-BAS)及室间隔中段纵向应变(LS-MIS,LS-MAS)较DG组显著增加(P<0.01)。而有趣的现象是,2组各个切面的心尖段纵向应变与NC组比较,差异无统计学意义。这可能是由左室纵向纤维的分布特点及各节段旋转、应变的难易度差异所致。心肌的纵向纤维集中于心内膜基底段,并且基底段的运动限制要大于心尖段,由此可以预期与基底段相比,心尖段需要的扭矩较小,应变代偿能力也较强,导致心尖段峰值应力无变化。
以往在NSTEMI患者中应用GLS和应变率等非常规性超声指标的研究,集中于的术前诊断或术后无复流等预测指标的诊断效能上[9,11]。而本研究是首次应用GLS等应变率指标判断该类患者介入术后左室运动能力改变,以论证介入干预最佳时间的问题。研究的结果也证实了早期血运重建的策略能够使患者的左室壁运动得到更好的改善。随着今后研究的深入,2D-STI应该在急诊NSTEMI患者的风险评估中加以推广,以利于医师对介入时机的判断。避免由于早期缺血性左室纵轴功能损伤被心外膜下保留的圆周功能和正常的左室射血分数所掩盖了而误导了医师的判断。
本研究也存在一定的缺陷,STI技术本身的局限性在于通过平面运动,可能会导致扭转测量误差。在急诊状态下如果不能采集清晰的切面,就无法可靠地进行STI测量,会限制该技术在急诊接触患者时的普遍使用。
