表没食子儿茶素没食子酸酯对大鼠干细胞成骨分化作用的研究
2022-07-19程琳姚洁隋萍李兵陈习驰靳攀
程琳,姚洁,隋萍,李兵,陈习驰,靳攀
(长江大学医学部,湖北 荆州 434023)
骨质疏松症是一种慢性代谢性骨疾病,在骨重建过程中,当骨吸收超过骨形成时就会发生[1],尤其相伴随的骨量低下、骨脆性增加和易发生骨折等问题更是严重威胁人群健康。有研究报道绝经后妇女饮茶能显著提高骨密度[2],我国流行病学调查也显示饮茶可以提高骨密度、防骨质疏松的发生[3]。绿茶中的主要成分为儿茶素,其属于茶多酚(tea polyphenols)中的一种,主要种类有表儿茶素(epicatechin,EC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、表没食子儿茶素(epigallocatechin,EGC)、表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate,EGCG)],目前研究认为其中主要发挥作用的是EGCG[4]。多项研究证实EGCG无论体内动物实验还是体外细胞实验均有明显的促进成骨作用[5-7],但是其促进成骨是EGCG自身的作用还是必须在其它因素参与下才能发挥作用目前尚不清楚。本研究拟通过比较EGCG对大鼠干细胞的直接作用和与成骨诱导液的协同作用,探究EGCG在成骨分化中的作用。
1 材料和方法
1.1 实验材料 表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate,EGCG,纯度≥95%,Sigma-Aldrich,美国];SPF级Sprague-Dawley大鼠(5日龄)5只(购自广西医科大学实验动物中心);α-MEM培养基(Gibco,美国);胎牛血清(杭州四季青生物工程材料有限公司,中国);胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(0.25%)、青链霉素混合液(100x)(北京索莱宝科技有限公司,中国);CCK-8(Biosharp公司,中国);RIPA裂解液、苯甲基磺酰氟(PMSF)、BCA蛋白浓度测定试剂盒(增强型)(碧云天生物技术研究所,中国);碱性磷酸酶(AKP)测定试剂盒、碱性磷酸酶染液(南京建成生物工程研究所,中国);总RNA小量抽提试剂盒(双柱型)(广州美基生物科技有限公司,中国);PCR引物(北京六合华大基因科技股份有限公司,中国);逆转录试剂盒(TaKaRa,日本);PCR试剂盒(巴塞尔罗氏公司,瑞士);RNase-free water(上海生工生物工程股份有限公司,中国);全波长酶标仪(Multiskan GO,Thermo Fisher Scientific公司,美国);洁净工作台(素净集团苏州安泰空气技术有限公司,中国);二氧化碳培养箱(Thermo ScientificTMForma Series II Water-Jacketed,赛默飞公司,美国);倒置荧光显微镜(尼康Nikon公司,日本);常温离心机(Eppendorf公司,德国);核酸检测仪(Thermo Fisher Scientific,美国);多槽梯度PCR仪(ProFlex,Applied Biosystems,美国);实时荧光定量PCR仪(LightCycler 96,罗氏公司,瑞士)。
1.2 实验方法
1.2.1 干细胞的提取与培养 利用全骨髓贴壁法分离大鼠骨髓间充质干细胞(BMSCs)[8],将新生3~7 d Sprague-Dawley(SD)乳鼠颈椎脱臼法处死,于75%酒精中浸泡5 min消毒,转移至无菌洁净工作台中,剪下双侧大腿,左手持无菌纱布,右手拿无菌小剪刀除去皮肤、皮下肌肉、神经和血管后剔净股骨,放入无菌PBS洗3次;将股骨两端干骺端剪掉,暴露髓腔,用1 mL注射器抽吸完全培养基(按照90 mL高糖培养基加入10 mL胎牛血清和1 mL青链霉素的比例配制)多次冲洗股骨髓腔,直至骨髓冲洗干净、股骨完全发白为止。补充培养基至常用量,将培养皿移入培养瓶中,置于37℃ 5% CO2培养箱培养,2 d后初次换液,以后每3 d换液,待细胞铺面瓶底面积80%左右时传代培养。
1.2.2 实验分组 培养至第三代,将细胞分为4组:A组(BMSCs):单纯用完全培养基培养BMSCs,B组(BMSCs+EGCG):将BMSCs在添加10 μmol/L EGCG的完全培养基中培养,C组(BMSCs+Osteoinductive fluid):用成骨诱导液培养BMSCs,D组(BMSCs+Osteoinductive fluid+EGCG):将BMSCs在添加10 μmol/L EGCG的成骨诱导液中培养。
1.2.3 细胞增殖检测 将干细胞消化、离心,重悬后,用细胞计数板计数,24孔板每孔接种10 000个/孔,培养2 d后待细胞贴壁紧密且细胞数量有一定扩增后,每组加入对应的培养基培养,之后每3 d换液。培养至待检测时间点后,1 mL培养基中加入100 μL CCK-8溶液,轻轻晃动后放入37 ℃ 5% CO2培养箱避光孵育1 h,取出24孔板重复振荡,用无血清培养基对半稀释后混合均匀,每孔吸取200 μL转移至96孔板中,将吸光度设定在450 nm处,酶标仪检测吸光度(OD value)。
1.2.4 ALP检测 各组细胞在对应的培养液中培养7 d和14 d后,吸走全部培养基,缓慢加入PBS清洗3次。苯甲基磺酰氟(PMSF)加入RIPA裂解液中配制成PMSF终浓度为100 mM的混合液,24孔板每孔加入200 μL混合液,用枪头反复吹打,充分裂解细胞。按照厂家的使用说明,首先将蛋白标准品稀释成不同的浓度进行测量,绘制标准曲线;然后用BCA蛋白浓度测定试剂盒检测待测样品在酶标仪562 nm波长处的吸光度,用标准曲线计算样品的蛋白浓度。同时将碱性磷酸酶(AKP)测定试剂盒中试剂取出,按照说明书步骤进行加样,混合均匀后37 ℃水浴,15 min后加入显色剂,混匀后于520 nm处测量吸光度,通过说明书中的公式计算ALP活性。
1.2.5 ALP染色 在24孔板接种细胞前,每孔加入无菌的细胞爬片,分组后各组加入对应的培养液,14 d后取出细胞爬片。按照碱性磷酸酶染液说明书步骤进行,在PBS溶液中清洗干净,将细胞爬片放入固定液中固定3 min,然后浸入新鲜配制的底物应用液中,避光孵育15 min,PBS溶液洗涤2 min,最后放入复染液中复染30 s,蒸馏水冲洗干净,常温晾干,中性树脂封片。
1.2.6 成骨相关基因检测 采用实时荧光定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)来检测成骨相关基因的表达水平,主要包括骨钙素(osteocalcin,Ocn)、Ⅰ型胶原(alpha-1 type I collagen,Col1a1)、骨涎蛋白(bone sialoprotein,Bsp)和Runt相关转录因子2(runt-related transcription factor 2,Runx2)。分别于培养的7 d和14 d,用总RNA提取试剂盒提取各个样品的总RNA,同时用核酸检测仪检测A260/A280评估RNA的纯度是否达标。在去除基因组DNA后,采用反转录反应试剂盒合成cDNA,采用荧光定量法在实时荧光定量PCR仪上反应:95 ℃预变性10 min; 95 ℃变性15 s;60 ℃退火60 s,共40个循环。以β-Actin为内参,按照2-△△Ct计算各个基因的相对表达量。引物序列见表1。

表1 RT-PCR引物
2 结果
2.1 细胞增殖情况 图1展示了各组BMSCs在7 d和14 d的增殖情况。CCK-8结果显示C组(BMSCs+Osteoinductive fluid)和D组(BMSCs+Osteoinductive fluid+EGCG)细胞增殖均明显低于A组(BMSCs)和B组(BMSCs+EGCG),可以初步判断成骨诱导液对BMSCs的增殖有一定的抑制作用。7 d时B组高于A组,而14 d时B组却低于A组,说明单纯EGCG对BMSCs的影响不明确;但是7 d和14 d时C组和D组差异均不明显,说明在成骨诱导液中EGCG对BMSCs的增殖无明显影响。
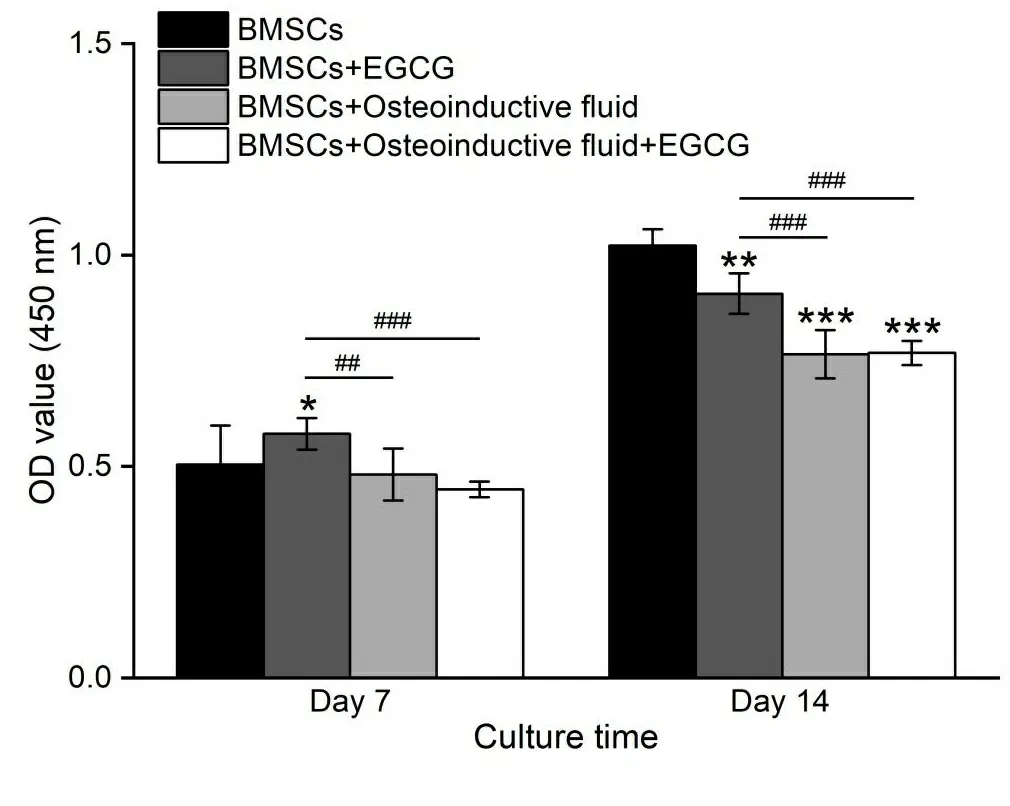
* P<0.05; **、## P<0.01;***、###P<0.001。
2.2 ALP检测 图2展示了7 d和14 d各组BMSCs的碱性磷酸酶(ALP)活性。ALP是干细胞早期成骨分化的特异性生物标记物[9],7 d时4组之间差异不明显,而14 d时C组(BMSCs+Osteoinductive fluid)和D组(BMSCs+Osteoinductive fluid+EGCG)的ALP活性明显高于A组(BMSCs)和B组(BMSCs+EGCG),A组和B组差异不明显,说明成骨诱导液可以诱导BMSCs的成骨方向分化,加入EGCG明显加快了分化的进度,但是单纯EGCG干预对BMSCs的ALP活性影响不明显。
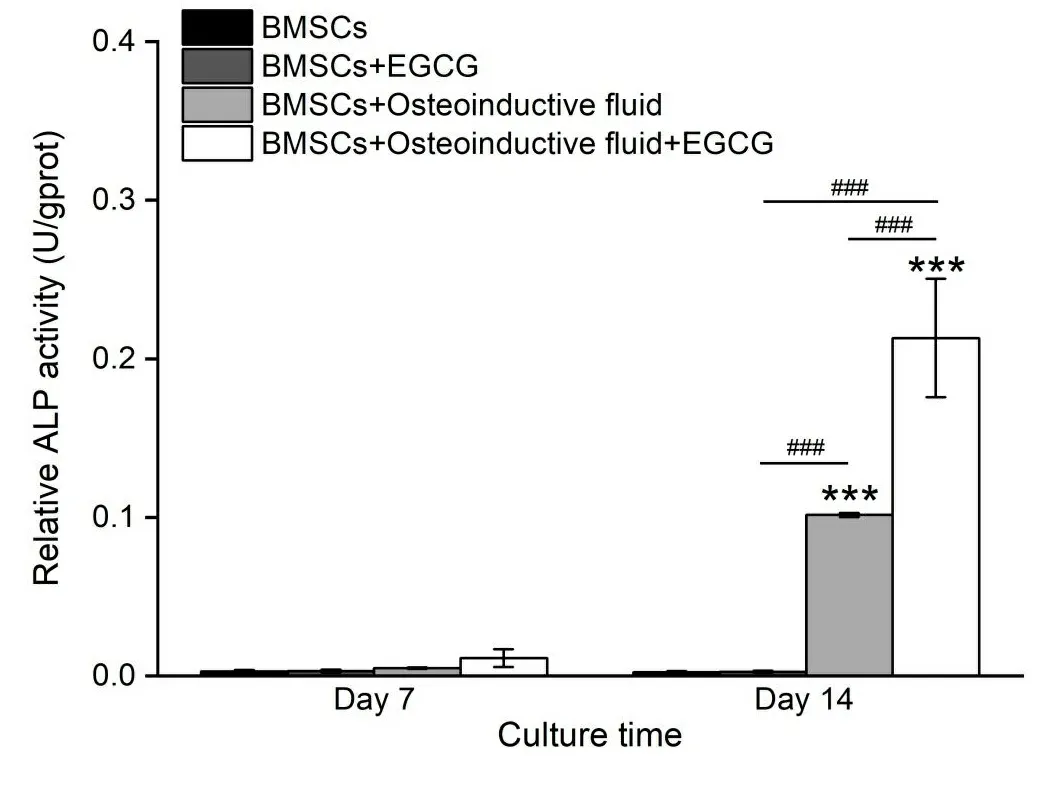
* P<0.05; **、## P<0.01;***、###P<0.001。
2.3 ALP染色 图3展示了14 d时各组BMSCs的ALP染色。ALP染色较弱时,细胞胞浆中出现红棕色颗粒;染色较强时,胞浆呈现棕褐色或者咖啡色,强阳性表达时染色区域甚至有团聚甚至成片现象。如图3所示,A组(BMSCs)染色较弱,B组(BMSCs+EGCG)开始出现阳性染色,主要呈现红棕色;C组(BMSCs+Osteoinductive fluid)和D组(BMSCs+Osteoinductive fluid+EGCG)主要呈现棕褐色阳性区域,尤其D组出现了成片的阳性区域。结合ALP活性的检测,ALP染色进一步说明了EGCG在成骨诱导液中其促进成骨分化的作用得到了极大的提升。
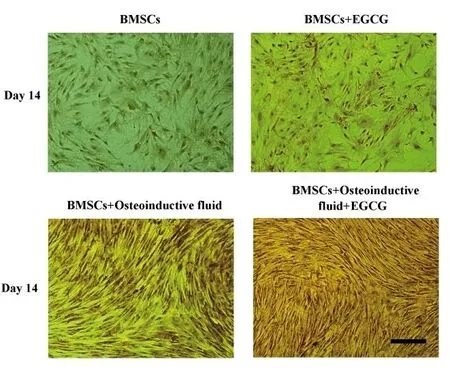
图3 不同组BMSCs的ALP染色(标尺=100 μm)
2.4 成骨相关基因表达情况 图4展示了7 d和14 d各组BMSCs成骨相关基因的表达情况。如图4a,A组(BMSCs)、 B组(BMSCs+EGCG)和C组(BMSCs+Osteoinductive fluid)在7 d和14 d差异均无显著性,而D组(BMSCs+Osteoinductive fluid+EGCG)在14 d时Ocn基因表达水平明显高于其它组。在图4b、4c和4d中,除了B组Col1a1基因14 d时的表达水平高于A组之外, A、B两组的其它基因在2个时间点的表达均呈现显著性差异。总体上来看,C组、D组成骨相关基因的表达明显高于A组和B组,图4中均出现D组的成骨相关mRNA表达水平显著高于C组的情况。
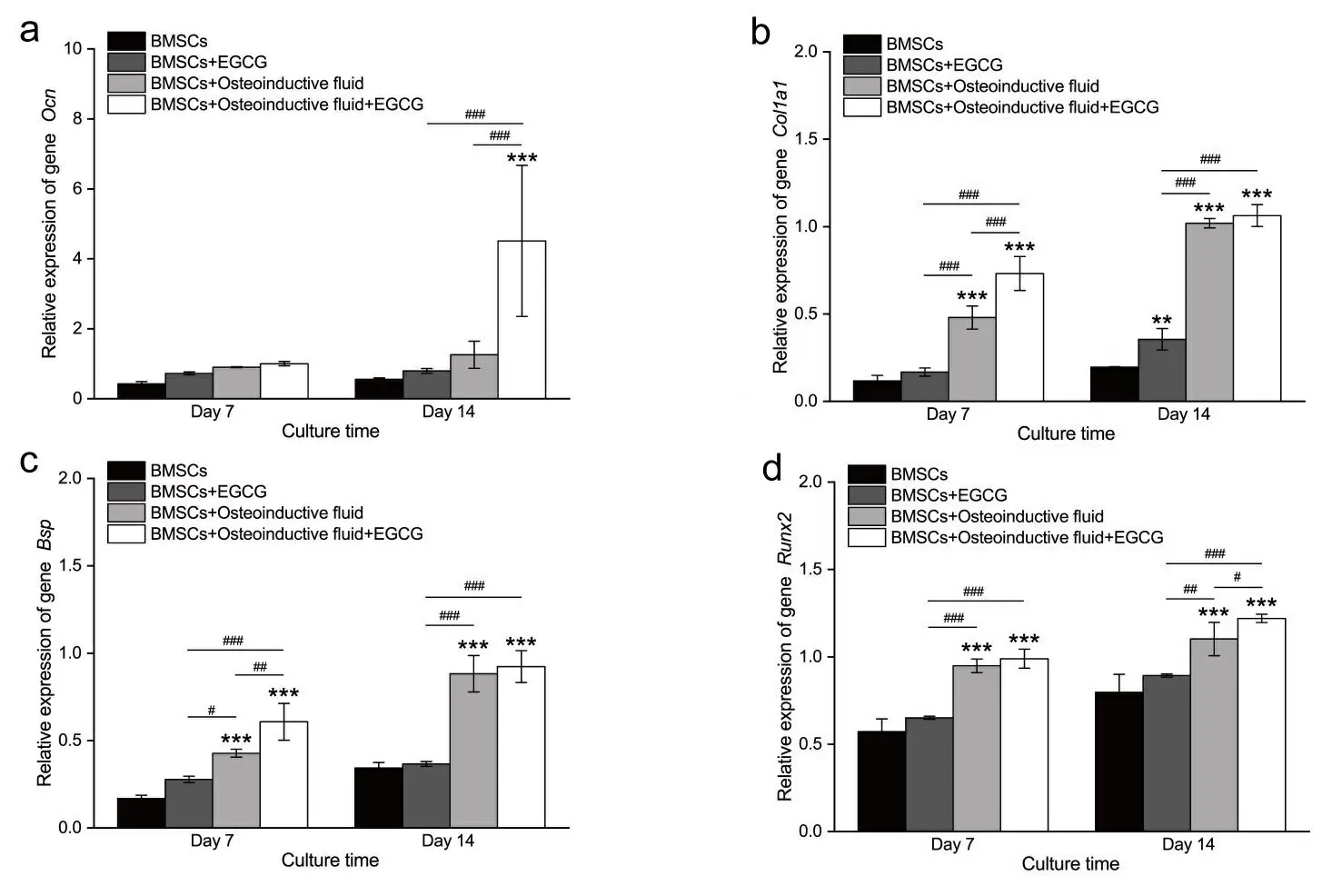
* P<0.05; **、## P<0.01;***、###P<0.001。
3 讨论
骨质疏松症在宏观上表现为骨吸收大于骨形成,在微观上则表现为成骨细胞数量不足。干细胞是成骨细胞的主要来源,基于干细胞对骨质疏松症进行研究是目前常用的方法[10]。与脂肪干细胞(adipose tissue-derived MSCs,ATSCs)相比,骨髓间充质干细胞(BMSCs)具有更好的成骨活性和更低的异向分化特性,更适合开展骨质疏松相关的干细胞水平研究[11]。本实验通过研究单纯EGCG和成骨诱导液环境中的EGCG对大鼠BMSCs的成骨作用探究EGCG在干细胞成骨分化中的作用。本研究细胞增殖实验表明单纯EGCG在7 d时对BMSCs有促进作用,而在14 d时有抑制作用,此自相矛盾的结果可能是由于14 d的培养时间较长和24孔板底部面积有限造成。有研究报道成骨诱导液在促进干细胞成骨方向分化的同时对干细胞的增殖有一定影响[12],本研究中添加成骨诱导液组的细胞增殖明显低于不添加的组,也证实了这一现象。除了7 d时EGCG似乎对干细胞增殖有影响外,在其它各组检测中细胞增殖与EGCG之间无关。ALP水平与骨折愈合能力正相关,其含量升高可以有效反映成骨活性增强[13-14]。为了具体探测EGCG的成骨作用在成骨诱导液存在时和不存在时的差别,本研究进行了ALP活性检测和染色。参考相关文献对细胞内外ALP含量的比较,选择了检测细胞内的ALP[15]。7 d时各组无差异,而14 d时加成骨诱导液的两组ALP表达明显增高,EGCG在成骨诱导液中显著增强了干细胞的成骨分化。ALP染色则通过标志酶染色的方法来直观体现各组的成骨分化趋势,加成骨诱导液的细胞阳性染色明显高于不加成骨诱导液的组,且同时加成骨诱导液和EGCG的组明显阳性染色最强。
Ocn、Col1a1、Bsp和Runx2均为成骨分化的特异性标志基因,且已被证实与骨质疏松相关[16]。EGCG对这些基因表达的影响与其在骨质疏松中的作用直接相关,故而监测这些基因的表达情况对研究EGCG在干细胞成骨分化中的作用至关重要。本研究中加成骨诱导液的两组基因表达明显高于未加成骨诱导液的两组。添加EGCG的成骨诱导液培养的BMSCs基因Col1a1和Bsp在7 d时显著高于未添加EGCG的成骨诱导液组,而添加EGCG的成骨诱导液培养的BMSCs基因Ocn和Runx2在14 d时显著高于未添加EGCG的成骨诱导液组,其它时间点是否添加EGCG对相关基因的表达无明显影响,这一现象可能是由于成骨诱导过程中基因表达的先后顺序导致的,具体还需要更多的研究。但是从成骨相关特异性基因表达的整体趋势上可以看出,EGCG作用的发挥依赖成骨的环境。
综上所述,单纯EGCG对干细胞成骨作用和增殖作用均比较微弱,但是在成骨诱导环境中其成骨作用大大增强,说明EGCG发挥促进成骨作用需要依赖其它因素,其自身不能启动成骨过程,此研究可能为EGCG成骨相关的体外细胞和组织工程实验的改良提供理论依据。
