抗NMDA受体脑炎相关癫痫小鼠脑组织小胶质细胞及IL-1β、TNF-α表达的变化
2022-07-19叶霖黄虹蜜吴莹杨升煜李偲俊罗小丹马美刚吴原
叶霖,黄虹蜜,吴莹,杨升煜,李偲俊,罗小丹,马美刚,吴原
随着抗体检测的普及,临床上证明,自身免疫性癫痫(autoimmune epilepsy,AE)在癫痫中占相当一部分比例,对抗癫痫药物不敏感的患者,免疫疗法可能有效,说明这种癫痫与自身免疫性疾病相关。2017年国际抗癫痫联盟(ILAE)对AE的定义是:它直接由一种免疫性疾病引起,并且癫痫发作是这种疾病的核心症状。N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体抗体是AE最常见的神经特异性抗体之一,所致癫痫发作的临床表现复杂多样,癫痫发作的预后与患者免疫反应进程存在密切联系。
小胶质细胞作为中枢神经系统的主要免疫细胞,在发育期和成年期的神经回路的发展和维护中与神经元形成、存活及吞噬有着密切的关系。小胶质细胞的激活是一个动态变化的过程,在癫痫的发生发展中起重要作用。越来越多的证据表明,小胶质细胞在中枢神经系统的激活可分为2种相反的类型:M1型和M2型。根据激活的表型,小胶质细胞可以产生细胞毒性或神经保护作用。但对癫痫和(或)癫痫发作过程中的这种小胶质细胞的研究不多。本研究参照文献[7]的造模方法,以NMDA受体抗体介导的AE小鼠为研究对象,观察癫痫发作情况并探索M1/M2型小胶质细胞的活化和相关炎症因子TNF-α、IL-1β的表达变化。
1 材料与方法
1.1 动物来源
选取健康清洁级成年雄性C57BL/6J小鼠共17只,8周龄,体质量约18~22 g,饲养环境温度为(21±1)°C,湿度(55±10)%,周围光线明暗周期为12 h交替进行(光期:晚上7点到早上7点),食物和水源供应充足。C57BL/6J小鼠由广西医科大学动物实验中心提供,实验过程均按动物研究伦理学要求进行。
1.2 主要仪器及试剂
合成肽GluN1359-378(购于卓一生物);结核分枝杆菌H37Ra(购于BDDS);完全弗氏佐剂(购于Sigma Aldrich Laboratory);小鼠TNF-α、IL-1β酶联免疫吸附测定(ELISA)试剂盒(购于Boster Biological Technology);兔抗鼠IBA-1单克隆抗体(购于Sigma Aldrich Laboratory); 兔抗鼠Arg1单克隆抗体(购于Boster Biological Technology); 兔抗INOS单克隆抗体(购于Boster Biological Technology); 兔抗鼠p-p38单克隆抗体(购于Boster Biological Technology); 兔抗鼠GADPH单克隆抗体(购于Sigma Aldrich Laboratory)。
1.3 方法
1.3.1 动物分组
小鼠随机分为2组:抗NMDA受体脑炎相关癫痫组(11只,模型组);正常对照组(6只)。模型组8周龄雄性C57BL/6J小鼠皮下注射200 μg多肽GluN1359-378(溶于100 μL PBS溶液)与含有600 μg结核分枝杆菌H37Ra的完全弗氏佐剂乳剂混合物,体积比1∶1,该乳剂分4次注射到四肢,每次50 μL,诱导自身免疫应答。所有模型组小鼠在免疫时和免疫后48 h,腹腔注射含有200 ng百日咳杆菌毒素的200 μL生理盐水。免疫2周后,模型组小鼠腹腔注射戊四氮(PTZ)50 mg/kg。对照组用同等剂量生理盐水代替乳剂、百日咳杆菌毒素和PTZ。
1.3.2 动物行为学观察
观察记录小鼠体质量及痫性发作情况。根据Racine分级标准:0 级为无惊厥;Ⅰ级为面部阵挛;Ⅱ级为面部阵挛+节律性点头;Ⅲ级为面部阵挛+节律性点头+前肢阵挛;Ⅳ级为面部阵挛+节律性点头+前肢阵挛+后肢站立;Ⅴ级为面部阵挛+节律性点头+前肢阵挛+后肢站立+跌倒。根据Racine分级,选择Ⅳ-Ⅴ级致痫小鼠作为癫痫模型组。
1.3.3 海马神经元细胞形态变化
小鼠断头取脑,以4%(质量浓度)多聚甲醛固定24 h,石蜡包埋,切片(片厚4 μm),二甲苯透明、酒精脱水,Nissl染色液37 ℃染色30 min,水洗,风干,二甲苯透明,中性树胶封片,置显微镜下观察神经元形态。
1.3.4 海马组织中TNF-α、IL-1β测定
取3只小鼠断头取脑,快速剥离海马组织,该操作于冰面上完成,置于-80℃冰箱储存待用。提取海马组织蛋白后,按ELISA试剂盒操作说明分别测量海马组织中IL-1β及TNF-α细胞因子水平。
1.3.5 Western blot检测海马组织中IBA-1、Arg-1、iNOS 蛋白的表达水平
各组取适量海马组织于高效RIPA蛋白裂解液和PMSF混合液中充分裂解30 min提取总蛋白,BCA法测定蛋白浓度,加Loading Buffer煮沸后取25 ug蛋白上样,SDS-PAGE分离转移至NC膜,快速封闭液室温封闭20 min,加入相应的一抗置于4℃冰箱过夜,次日TBST洗膜后加入带HRP荧光标记山羊抗兔二抗(1∶10 000)于室温孵育1 h,TBST洗膜后系统成像,以Image J软件分析条带灰度值,计算目的蛋白与内参蛋白GAPDH的比值以及各组目的蛋白条带的比值,进行定量分析。
1.4 统计学方法
采用SPSS 22.0统计软件作统计学分析,Graph Pad Prism 5对数据进行作图,数据以均数±标准差表示,采用单因素方差(one-way ANOVA)分析组间差异,P
<0.05为差异有统计学意义。2 结果
2.1 动物行为学观察
第7天和第14天对照组和模型组小鼠体质量比较差异无统计学意义 (第7天:t
=0.682,P
>0.05;第14天:t
=-0.624,P
>0.05)。结果详见表1。对照组小鼠未见自发的癫痫痫性症状发作,第14天脑电图(EEG)以不规则基础波为主(图1)。第14天模型组小鼠有出现咀嚼、点头的痫性症状,EEG监测可见散在的痫性波(图1)。第14天模型组注射PTZ后11只小鼠均出现Ⅳ级以上发作,发作率为100%,死亡4只,死亡率为36%。表1 对照组与模型组小鼠第7天、第14天体质量比较(=6,/g)
组别第7天第14天对照组模型组0.57±0.200.25±0.770.30±0.660.58±0.64
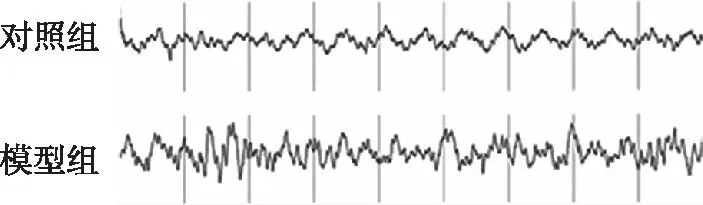
图1 第14天两组小鼠的EEG表现
2.2 海马神经元细胞形态和存活的变化
对照组小鼠海马CA1、CA2及DG区可见神经元排列整齐,形态规则完整,染色质分布均匀;尼氏染色均匀。与对照组比较,模型组小鼠海马CA1、CA2及DG区尼氏染色均出现减弱,部分神经元细胞变性坏死,细胞形态不完整,细胞肿胀或皱缩,轮廓模糊,界限不清;细胞间距增加,排列疏松紊乱(图2)。
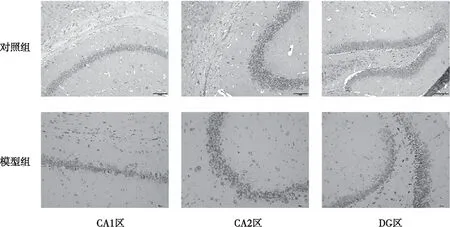
图2 两组小鼠海马组织CA1、CA2及DG区神经元存活情况(Nissl染色,×200)
2.3 对照组与模型组海马组织中炎性因子TNF-α、IL-1β的比较
与对照组比较,模型组小鼠海马组织中IL-1β、TNF-α因子均显著增高,差异有统计学意义(t
=-3.58,P
<0.05)。结果详表2。表2 小鼠海马组织中TNF-α及IL-1β的表达情况[=3,/(pg/mL)]
组别TNF-αIL-1β对照组60.77±7.10135.70±5.93模型组97.40±14.15227.20±32.52
2.4 对照组与模型组海马组织中IBA-1、Arg-1、iNOS蛋白水平的比较
与对照组比较,模型组小鼠的海马组织中,IBA-1、iNOS显著增高,差异有统计学意义(IBA-1:t
=-4.85,P
<0.05;iNOS:t
=-3.00,P
<0.05),p-p38减少,差异有统计学意义(t
=2.93,P
<0.05),Arg-1减少,差异无统计学意义(t
=-2.40;P
>0.05,图3)。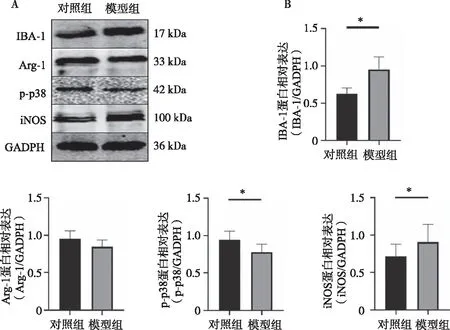
注:A为Western Blot检查两组小鼠海马组织IBA-1、Arg-1、iNOS蛋白的表达水平,B为两组小鼠海马组织IBA-1、Arg-1、iNOS蛋白相对表达量的统计分析。图3 两组小鼠海马组织中IBA-1、Arg-1及iNOS蛋白水平
3 讨论
抗NMDA受体脑炎是最常见的自身免疫性脑炎,约占自身免疫性脑炎的80%,癫痫发作是脑炎最常见的症状之一,然而导致抗NMDA受体脑炎相关癫痫的机制目前尚不清楚,为进一步探讨,本研究制作了抗NMDA受体脑炎相关癫痫小鼠模型,基于该模型小鼠海马组织小胶质细胞极性的改变,为自身免疫性脑炎癫痫发作所致的炎症损伤提供理论依据。本研究结果提示,模型组小鼠EEG检测到异常放电,海马组织的神经元细胞受损,小胶质细胞和M1型小胶质细胞表达较对照组增加,炎症因子IL-1β和TNF-α也明显增多。
通常抗NMDA受体脑炎患者EEG都有异常放电,表现为弥漫性慢波、过度活动β波、极度δ刷和全面性节律活动δ波,EEG的正常与否不但影响着患者的预后,而且影响着癫痫的复发概率。本实验中模型组小鼠EEG检测到异常的神经元放电,表现为痫性波,这与临床研究相一致,81.2%的自身免疫性脑炎患者伴有癫痫发作的症状。同时本研究中抗NMDA受体脑炎相关癫痫小鼠海马组织CA1、CA2及DG区出现部分神经元细胞变性坏死,这可能是因为NMDA受体的活化介导兴奋性神经毒性,引起神经元损伤,损伤的神经元增加了神经元的兴奋性,诱发癫痫发作,所以小鼠出现咀嚼及点头等痫性症状,EEG存在痫性波。然而本实验中小鼠EEG没有表现出抗NMDA受体脑炎患者经典的δ刷波形,可能与患病病程有关。
IL-1β及TNF-α是中枢神经系统中最常见的炎症因子,有研究显示,癫痫发作可引起大脑中炎症因子IL-1β水平升高、海马中的TNF-α和IL-1βmRNA表达上调,本研究结果提示,小鼠海马组织中炎症因子IL-1β及TNF-α表达水平增高,说明脑部产生了具有炎症特性的分子免疫反应。神经元在受到损害、感染等刺激时通常可引起小胶质细胞的激活、增生,激活的小胶质细胞释放促炎细胞因子,增强炎性相关基因的表达。小胶质细胞活化后可以呈现两种激活状态:经典活化状态M1型和选择活化状态M2型。M1型小胶质细胞主要表达的是促炎型小胶质细胞,释放如IL-1β、TNF-α及NO等,表达标志物一氧化氮合酶(inducible nitric oxide synthase,iNOS);M2型小胶质细胞则表达抑炎性因子,包括IL-10、IL-13、转化生长因子-β、血管内皮生长因子、内皮生长因子及精氨酸1(Arginase 1,Arg-1)等,表达标志物Arg-1。本实验中模型组小鼠海马组织中蛋白IBA-1表达明显增加,神经元受到了刺激而引起小胶质细胞的活化。同时模型组小鼠海马组织中iNOS表达明显增高,M1型小胶质细胞大量激活,Arg-1蛋白表达与对照组比较没有明显变化,抑制炎症反应的M2型小胶质细胞没有明显激活或抑制。这说明该模型可能是以激活的经典活化状态M1型小胶质细胞为主,这与Davies等的研究一致。而激活的M1型小胶质细胞表现为促进炎症因子如IL-1β、TNF-α的释放。以上说明了抗NMDA受体脑炎相关癫痫发作同样有这样的表现,抗NMDA受体抗体和癫痫的发作刺激中枢神经系统,激活小胶质细胞,炎症反应激活,促进M1型小胶质细胞活化,促进炎症因子IL-1β及TNF-α的释放。
炎症反应有多种激活途径,p38丝裂素活化蛋白激酶(p38 mitogen activated,protein kinase,p38MAPK)是其中之一。p38MAPK是丝裂素活化蛋白激酶(MAPK)家族成员之一,可以通过调节促炎性因子IL-1β及TNF-α等的分泌,影响神经炎症反应的发生发展。在其他各种疾病中发现激活p38 MAPK信号通路可以使IL-1β、TNF-α大量分泌。既往研究表明,参与小胶质细胞激活的信号通路有很多,p38就是其中之一,促进p38MAPK蛋白磷酸化可以激活M1型小胶质细胞,释放炎症因子。然而本实验中与之不同的是,模型组小鼠海马组织磷酸化p38减少,小胶质细胞和M1型小胶质细胞却仍然被激活,IL-1β、TNF-α分泌增多,推测抗NMDA受体脑炎相关癫痫模型中,磷酸化p38减少可能跟NMDA受体激活钙激活/钙调蛋白依赖性蛋白激酶 Ⅱ (calcium-activated/calmodulindependent protein kinase Ⅱ,CamKⅡ) 和SynGAP-MUPP1 有关。
通过本次研究表明,抗NMDA受体脑炎相关癫痫小鼠海马组织中神经元受损伤,小胶质细胞活化,M1型小胶质细胞激活,释放炎症因子IL-1β及TNF-α。
