染色体核型分析联合微阵列分析技术在产前诊断的应用价值
2022-07-18黄婷婷黎俏袁慧珍王欣荣刘艳秋
黄婷婷 黎俏 袁慧珍 王欣荣 刘艳秋
江西省妇幼保健院医学遗传中心(南昌 330006)
出生缺陷是指婴儿在出生前所发生的结构、功能或者代谢异常等,导致出生缺陷的常见原因之一为染色体异常。传统染色体核型分析技术可检测出染色体数目和大片段结构异常,是产前诊断胎儿染色体异常的“金标准”,但该技术需经过细胞培养导致检测周期长、分辨力低且无法检出染色体片段小于5 Mb 的拷贝数变异(copy number variations,CNVs)[1-2]。染色体微阵列分析(chromosome microarray analysis,CMA)则能在全基因组亚显微水平上检测出1 kb 以上的CNVs,从而弥补传统染色体核型分析技术上的不足,增加异常染色体的检出率,被逐渐应用于医学领域[3-4]。但CMA 在产前诊断临床应用中的具体价值评估则需要更大量的数据支持。本研究通过回顾性分析4 854 例胎儿样本的染色体核型分析及CMA 检测结果,比较两种方法优缺点,为更好地产前遗传咨询和对胎儿进行预后评估提供依据。
1 资料与方法
1.1 资料
1.1.1 研究对象 取2020年1月至2021年12月因不同指征在江西省妇幼保健院医学遗传中心行介入性产前诊断的孕妇4 854 例。获取的胎儿样本同时行染色体核型分析及CMA 检测,在产前诊断术前孕妇及家属进行详细遗传咨询并签署知情同意书。
1.1.2 有创性产前诊断指征 有创性产前诊断指征主要有:血清学生化筛查或无创DNA 产前检测高风险;胎儿超声软指标阳性或结构异常,孕妇高龄(预产期年龄≥35 周岁);夫妇之一染色体异常;异常孕产史及医师认为需进行产前诊断的其他情况等。
1.2 方法
1.2.1 介入性产前诊断 根据指征,排除介入性产前诊断禁忌证后,对不同孕周夫妇选择合适的介入性产前诊断方案(经腹绒毛活检术、羊膜腔穿刺术或脐静脉穿刺术),所有孕妇及家属均行遗传咨询并签署知情同意书。
1.2.2 染色体核型检查 在无菌条件下将产前诊断术后获得的胎儿样本经细胞接种、培养、收获、制片、G 显带后上机,分析5 个核型,至少计数20 个细胞分裂相,必要时增加计数量。
1.2.3 CMA 根据基因芯片实验操作流程对所获得的胎儿样本全基因组DNA 进行分析处理。参照美国医学遗传学学会(ACMG)和临床基因组资源(ClinGen)对CNVs 结果进行致病性解读,目前分五类[5]:致病性CNVs(pCNVs)、可能致病性CNVs(lpCNVs)、临床意义未明CNVs(VUS)、可能良性CNVs 和良性CNVs。必要时抽取父母外周血样本行CMA 验证,有助于胎儿预后分析。
1.3 统计学方法 用Excel 表格记录所有数据,SPSS 21.0 软件进行统计学分析处理。计数资料以例数或百分数(%)表示,应用χ2检验对不同组间的差异进行比较,P<0.05 为差异有统计学意义。
2 结果
2.1 检出的胎儿异常染色体分类情况 共4 854例孕妇因不同指征于我院行有创性产前诊断,通过CMA 联合染色体核型分析共检出848 例染色体异常,其中540 例为致病性染色体异常,致病性染色体异常检出率达11.12%(540/4 854)。致病性染色体异常中除染色体非整倍体外CMA 检出151 例pCNVs 和可能致病性CNVs,检出率为3.11%(151/4 854),其中108 例为染色体核型正常,CMA 检出异常,故CMA 增加胎儿致病性染色体异常检出率为2.22%(108/4 854);CMA 还检出VUS 224 例,占比26.42%。染色体核型分析检出75例染色体平衡重排(易位/倒位/插入)等,CMA 正常(表1)。
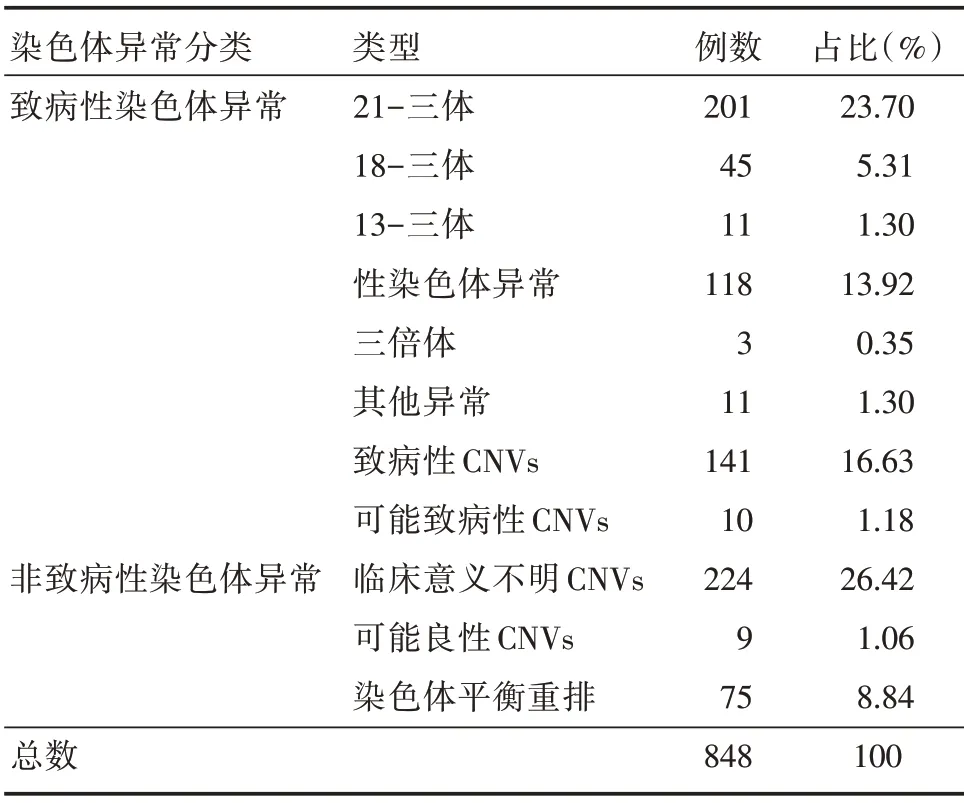
表1 胎儿异常染色体检出情况Tab.1 Detection of fetal abnormal chromosomes
2.2 不同产前诊断指征CMA 检出pCNVs 及可能致病性CNVs 情况 CMA 检出的151 例pCNVs 和可能致病性CNVs 孕妇产前诊断指征不同,主要为胎儿超声异常83 例,占比54.97%。胎儿超声异常为结构异常及超声软指标阳性,胎儿超声软指标包括:单脐动脉、锁骨下动脉迷走、鼻骨发育不良,心室强光点,肾集合管分离,肾脏回声增强,脉络丛囊肿、侧脑室增宽及长骨稍短等等;其次为无创DNA 产前检测高风险30 例,占比19.87%;血清学筛查高风险14 例,占比9.27%。见表2。
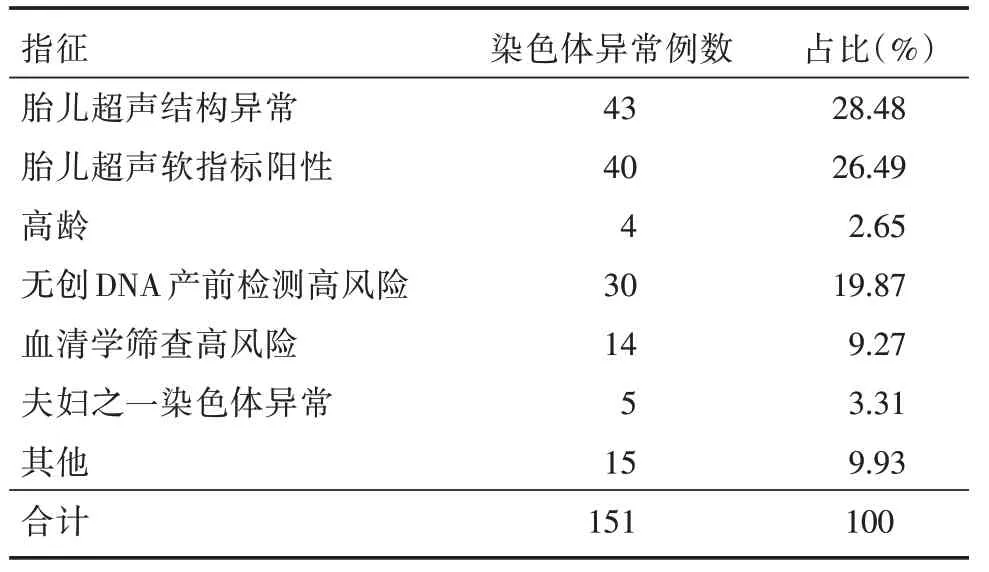
表2 pCNVs 及可能致病性CNVs 产前诊断指征分析Tab.2 Analysis of prenatal diagnosis indications of pCNVs and possible pathogenic CNVs
2.3 染色体核型分析与CMA 结果不一致情况分析 染色体核型分析与CMA 结果不一致9 例,其中5 例为染色体核型未见明显异常,而CMA 提示为不同染色体非整倍体嵌合体,其中4 例终止妊娠,1 例为性染色体46,XX 与47,XXX 嵌合体,目前随访中;染色体核型分析发现3 例额外小标记染色体(small supernumerary marker chromosome,sSMC),其中1 例为嵌合体,经CMA 检测2 例未见明显异常,遗传咨询后继续妊娠结局良好,1 例明确该变异位于4p16.3q12 及8p23.3p23.1 处,4p16.3q12重复片段约56.23 Mb(pCNVs),8p23.3p23.1 重复片段约8.88 Mb(VUS),经遗传咨询后选择终止妊娠。见表3。
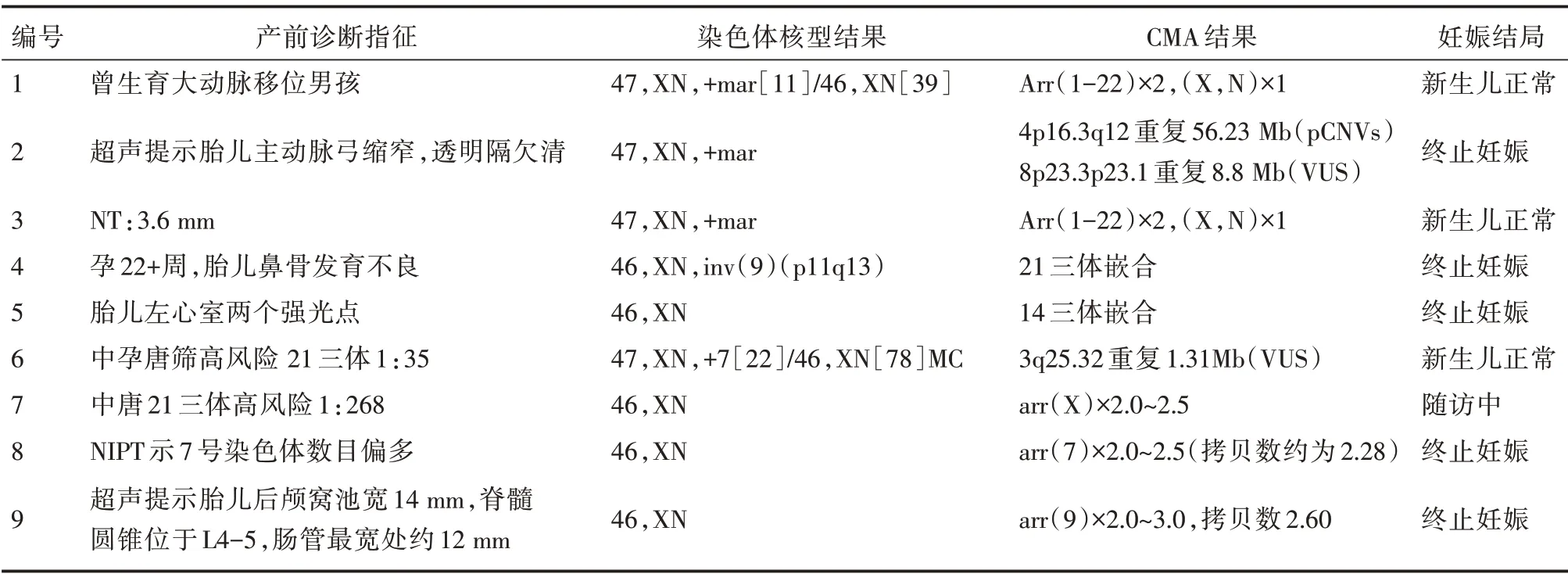
表3 染色体核型分析与CMA 结果不一致情况Tab.3 Inconsistency between chromosome karyotype analysis and CMA results
3 讨论
染色体异常是导致出生缺陷的重要原因,包括染色体数目异常和染色体结构异常[6],如13、18、21-三体综合征及微缺失微重复综合征(micro-deletion and microduplication syndromes,MMS)等。MMS 是由于染色体微结构改变所导致的微小片段的缺失和重复,主要是由于特定染色体区域的CNVs 而引起的,目前已明确由CNVs 所致的染色体微缺失及微重复综合征有300 余种[7],传统产前诊断方法是对有产前诊断指征的孕妇进行绒毛活检、羊膜腔穿刺、脐静脉穿刺、胎儿活检等获取胎儿细胞行染色体核型分析,常规染色体核型分析会漏诊5 Mb 以下的CNVs 所致的出生缺陷[8]。CMA 技术分辨率高,可用于未经培养的DNA 样本,检测周期短,自动化程度较高,弥补了核型分析的不足[9]。在染色体核型分析正常但超声提示有结构异常的胎儿中,发现存在6%~7%明确致病或可能致病的CNVs[10]。本研究中共4 854 例孕妇因不同指征于我院行有创性产前诊断,通过CMA 联合染色体核型分析共检出848 例染色体异常,其中540 例为致病性染色体异常,致病性染色体异常检出率达11.12%(540/4 854)。致病性染色体异常中除染色体非整倍体外CMA 检出151 例pCNVs,检出率为3.11%(151/4 854),其中43 例为染色体核型分析及CMA 均检出异常,108 例为染色体核型正常,CMA 异常,CMA 增加胎儿致病性染色体异常检出率为2.22%(108/4 854)。
2013年CMA 技术己被美国妇产科学会和母胎医学协会推荐作为一线检测技术应用于存在产前超声结构畸形的胎儿中[11];我国2014年的CMA技术在产前诊断中的应用专家共识中也提出,当超声提示胎儿存在结构异常时应在使用染色体核型分析技术基础上同时应用CMA,这样可以提高pCNVs 的检出率;同时推荐当胎儿出现结构异常时,CMA 可作为一线检测手段[12]。有研究[13-14]发现,在骨骼发育异常胎儿中联合使用CMA 对pCNVs 检出率较单纯传统染色体核型分析增加8.7%~16%。有数据发现,当胎儿出现单一中枢神经系统异常时,pCNVs 检出率为5.86%,当胎儿出现多个中枢神经系统异常或合并其他结构异常时,pCNVs 检出率为12.3%[15]。在超声提示胎儿存在先天性心脏病时,CMA 可增加3.0%的pCNVs 或lpCNVs 检出率[16]。在本研究中CMA 检出151 例pCNVs,其中83 例产前诊断指征为胎儿超声结构异常或胎儿超声软指标阳性,占比54.97%(83/151)。
本研究中发现有染色体核型分析与CMA 结果不一致情况,其中5 例为染色体核型未见明显异常,而CMA 提示为不同染色体非整倍体嵌合体,其中4 例终止妊娠,1 例为性染色体46,XX 与47,XXX 嵌合体,孕妇及家属经过遗传咨询后考虑继续妊娠,妊娠结局目前仍在随访中;1 例为核型提示7 号染色体三体嵌合体,嵌合比例22%,为单瓶生长,但CMA 结果未见明显异常,经遗传咨询后,孕妇及家属决定继续妊娠,随访妊娠结局良好,新生儿正常。染色体核型分析与CMA 结果不一致可能与核型分析需要细胞培养有关,在细胞培养过程中存在细胞克隆优势生长情况,造成染色体数目异常的假性嵌合或嵌合比例不真实,而未经培养的胎儿组织进行CMA 检查更能说明嵌合真实情况[17]。CMA 计算出的嵌合比例与采用的探针密度相关,不能检出低比例的嵌合体。在产前诊断应用中发现传统的染色体核型分析联合CMA技术可以增加染色体嵌合体的检出率[18]。
sSMC 是指存在结构异常的染色体,异常片段来源无法通过常规染色体核型分析辨别[19]。有报道sSMC 在新生儿中的检出率约为0.44‰,在产前诊断胎儿中的发生率为0.75‰[20]。LIEHR 等[21]认为,sSMC携带者的临床表型与sSMC 携带的基因剂量效应及印记介导的表观遗传相关,当核型分析发现胎儿为sSMC 携带时,须行染色体微阵列分析检测或高通量测序,以便能更准确地判断sSMC来源及致病性。本研究染色体核型分析发现3 例sSMC,其中1 例为嵌合体,但无法检测其额外染色体的来源及致病性,经CMA 检测2 例未见明显异常,遗传咨询后继续妊娠结局良好,1例明确该变异位于4p16.3q12及8p23.3p23.1 处,4p16.3q12 重复片段约56.23 Mb,累及183 个OMIM 基因。涉及染色体大片段的重复,不排除胎儿可能会具有染色体病的常见临床表型,综合考虑为pCNVs;8p23.3p23.1重复片段约8.88 Mb,根据当前数据库及文献资料,综合考虑为VUS,结合其超声提示胎儿主动脉弓缩窄,透明隔欠清,最后经遗传咨询后孕妇及家属决定终止妊娠。CMA 可对未知来源sSMC 进行检测,明确该遗传物质来源及片段大小,更好地指导临床进行遗传咨询[22]。
本研究中染色体核型分析发现75 例平衡重排(易位/倒位/插入)携带者,而CMA 未见明显异常。平衡重排一般不影响妊娠结局,但如果父母中的一方是携带者,对未来的妊娠仍有生殖影响[23]。CMA 技术在染色体平衡重排等检测方面存在一定的局限性,也被视为不能完全替代传统核型分析技术的重要原因之一。同时随着CMA 技术在产前诊断中的应用,会增加VUS 的检出率[24],VUS 是指CNVs 在目前已知数据库和文献资料中未找到对应的片段,且片段内含有的基因功能不明确,与临床表型相关性也不明确,对VUS 的判读和解释仍面临很大困难及挑战,增加孕妇及家属的焦虑,甚至可能造成健康胎儿妊娠的终止。
综上,染色体核型分析联合CMA 可以增加异常染色体检出率[25],两种技术相辅相成,为产前诊断及遗传咨询提供更准确及详细的信息。CMA 技术在产前诊断临床应用中,需通过数据的不断累积,增强对检测到的CNVs 进行致病性判读能力,提高数据的可信度。
