华北落叶松与阔叶树种混合凋落叶分解过程中养分和细菌群落变化
2022-07-18李雪王淳王静程瑞明赵金满韩馨悦张志东
李雪,王淳,王静,程瑞明,赵金满,韩馨悦,张志东
(1河北农业大学 林学院,河北 保定 071000;2河北省林木种质资源与森林保护重点实验室,河北 保定 071000)
凋落叶是林木生长发育过程的代谢产物,是林地有机质的主要来源。凋落叶分解对于维持土壤肥力、植物生长和生态系统的养分循环等具有重要作用[1]。凋落叶分解为物理过程和生物化学过程[2-3]。分解初期,受淋溶作用的影响,氮、磷等元素快速损失,淋溶作用主要是将有机盐、蛋白质等可溶性物质释放出来,对于木质素等难溶解的物质影响不大。微生物能够直接参与凋落叶的分解过程,如氧化、氨化、固氮等过程。凋落叶的碳、氮、磷等养分元素给微生物提供食物,微生物的代谢活动反过来会影响凋落叶的分解。在微生物参与的分解阶段,氮、磷等营养元素难以满足微生物的需要,因此,微生物会固定氮、磷等营养元素[4]。微生物的群落结构会随着分解时间的变化而改变[5]。易分解的物质在分解初期被大量分解,微生物可利用的物质减少,从而引起微生物群落结构的变化[6]。也有研究表明氮、磷等营养元素的积累也可能与物理吸附有关[7]。
由于自身“基质质量”的影响,针叶树种分解速率较慢。因此,采取有效措施提高凋落叶分解速率对于养分循环具有重要意义。研究表明,一种凋落叶的分解会受另外一种凋落叶的影响,存在混合效应[8]。与针叶凋落物相比,针阔混交能够加快分解速率;也有研究得出针阔混交未起到促进作用[9-10]。目前,混合凋落叶对于分解的影响尚无定论[11]。
华北落叶松(Larixprincips-rupprechtii)是华北地区主要的速生用材林,在水土保持、涵养水源和防风固沙等方面发挥着极其重要的作用。塞罕坝机械林场营造了大面积的华北落叶松人工林[12]。白桦和蒙古栎是华北落叶松人工林的常见混交树种。本研究以塞罕坝地区华北落叶松、白桦(Betulaplatyphylla)和蒙古栎(Quercusmongolica)凋落叶为研究对象,采用凋落物分解袋法,研究分解过程中凋落叶养分和细菌群落动态变化及其相关性,为华北落叶松人工林树种混交和科学管理提供理论依据。
1 研究地区与研究方法
1.1 研究区概况
研究区位于河北省北部,冀蒙交界地(E 116°51′~117°39′,N 42 °02 ′~42 °36 ′ ),属于阴山余脉、大兴安岭余脉和内蒙草高原交错地区,是冀北地区森林-草原和干旱-半干旱交错带。海拔1 010~1 939.9 m,地势较平坦,地形以曼甸和丘陵为主。该地区是典型的半干旱半湿润寒温带大陆季风气候,年均温-1.3 ℃,年均最高气温33.4 ℃,年均最低气温-43.3 ℃。年均降水量460 mm,年均大风日数53 d,年均无霜期64 d。土壤类型以森林土和棕壤土为主。针叶树种以华北落叶松、樟子松(Pinussylvestrisvar.mongolica)、云杉(Piceaasperata)为主,阔叶树种以白桦和蒙古栎为主。
1.2 试验设计
华北落叶松人工林基本情况,见表1。

表1 华北落叶松人工林基本情况Table 1 Condition of sample plots
由表1可知,本试验选择的3块落叶松人工林标准地基本信息,标准地大小为30 m×20 m。2017年10月收集华北落叶松、白桦和蒙古栎凋落叶,带回试验基地风干,去除杂质后备用。凋落叶设置4个处理:纯华北落叶松;华北落叶松×白桦(1∶1);华北落叶松×蒙古栎凋落叶(1∶1);华北落叶松×白桦×蒙古栎凋落叶(1∶1∶1)。按4个处理分别称取24 g凋落叶装入分解袋(网眼孔径1 mm,规格30 cm×20 cm)。在每个样地中心位置设4个埋放点(分别对应4个处理),各埋放点间隔1 m,每个处理埋放6袋,共计72袋。埋放时去除林地上层凋落物,埋放深度与凋落物层齐平,使之与腐殖质层充分接触,之后将少量凋落物覆盖在摆放好的凋落叶袋上,避免雨水冲刷以及意外丢失。
2017年10月埋袋前每种处理各留3袋用作初始养分分析。2018、2019年的5、7、9月份取回凋落叶袋,每次取样分别在3块样地中收集4种处理的样品,不同处理的测量结果取3块相同林龄样地的平均值。取样时要注意去除分解袋上附着的杂物,将分解袋带回实验室,分为2部分,一部分置于80 ℃烘箱内烘干48 h至恒重并记录,用于养分含量测定;另外一部分置于-80 ℃超低温冰箱内,用于微生物群落结构测定。
1.3 凋落叶化学性质测定
根据《土壤农化分析》,凋落叶全碳含量采用氧化法测定;全氮含量采用半微量凯式定氮法测定;全磷含量采用钼蓝比色法测定;全钾含量采用火焰光度计测定;pH采用pH计测定。
1.4 细菌群落结构测定
采用CTAB方法对样品的DNA进行提取,之后使用无菌水将样本稀释至1 g/μl。使用带Barcode的特异引物和高效高保真酶进行PCR。采用OTU聚类分析和物种分类学分析来确定样本细菌在门水平上的群落组成。
1.5 数据分析
凋落叶养分释放率计算式:
Rt=(M0C0-MtCt)/M0C0×100%
(1)
式中:M0表示凋落叶初始干重(g);Mt表示凋落叶分解t时间后剩余干重(g);C0表示凋落叶初始养分含量;Ct表示凋落叶分解t时间后的养分含量。
Shannon指数计算公式:
(2)
式中,Sobs是观测的OTU数,Fi是序列数为i的OTU数目,N是序列数目的和。
Simpson指数计算公式:
(3)
其中,Sobs是观测的OTU数,Fi是序列数为i的OTU数目,N是序列数目的和。
Chao1指数计算公式:
(4)
式中,Sobs表示样本中观察到物种数目,即实际OTU数;F1表示仅有1条read的OTU数;F2表示仅有2条read的OTU数。
ACE指数计算公式:
(5)
式中,Srare是小于等于“abound”条序列的OTU数目,Sabound为大于“abound”条序列的OTU数目,CACE是样本丰富度预测值,F1是序列数为1的OTU数目,γACE是稀有OTU的预测变异系数。
采用SPSS 21.0软件对数据进行统计分析。凋落叶养分含量显著性检验采用单因素方差分析(ANOVA) 和最小显著差异法(LSD),显著性水平设定为 α = 0.05。
利用 Uparse 软件对所有细菌样品进行聚类。采用Mothur方法进行物种注释分析,获得分类学信息并在门分类水平上统计各样本的细菌群落组成。使用Qiime软件计算Shannon,Simpson,Chao1和ACE等多样性指数,并用Origin软件作图。采取R软件的 Vegan 软件包中的冗余分析(Redundancy analysis, RDA)解释凋落叶养分与细菌群落之间的关系。
2 结果与分析
2.1 凋落叶养分含量变化
不同混合凋落叶养分含量,见图1。




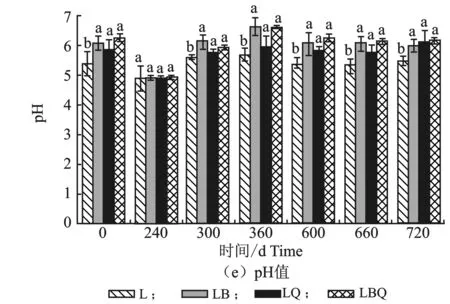
图1 不同混合凋落叶土壤养分变化Figure 1 Changes of soil nutrients in different mixed litters注:L是华北落叶松;LB是华北落叶松+白桦;LQ是华北落叶松+蒙古栎 ;LBQ是华北落叶松+白桦+蒙古栎;下同。不同小写字母代表相同时间不同处理之间存在显著性差距(P<0.05)。
由图1可知,不同处理凋落叶的C含量整体上呈缓慢下降趋势;分解300 d时,LQ的C含量显著低于LBQ;分解360 d、600 d、660 d和720 d时,L的C含量高于LB、LQ和LBQ。不同处理的N含量随分解时间均呈上升趋势;L的初始N含量显著高于其他处理;分解600 d、660 d和720 d时,L的N含量低于其他混合凋落物叶。不同处理的P含量随时间变化呈波动上升趋势,各处理间无显著差异。各处理的K含量整体呈波动下降趋势;L和LB的初始K含量显著高于LQ和LBQ;分解240 d,LB的K含量显著高于其他处理。其他时期各处理间K含量无显著差异。从整体上看,各处理的凋落叶pH呈先降低后上升的趋势;不同处理的初始pH有显著差异,L的初始pH显著低于其他混合凋落叶。分解240 d,各处理差异不显著;分解300 d、360 d、600 d、660 d和720 d,L的pH显著低于其他混合凋落叶。
2.2 养分释放率
不同混合凋落叶养分释放率,见图2。




图2 不同混合凋落叶养分释放率随分解时间的变化Figure 2 Change of nutrient release rate of different mixed litters during decomposition time
由图2可知,凋落叶分解过程中,凋落叶C、N、K释放率为正值,表现为直接释放状态;P释放率随分解时间表现为正-负-正,表现为淋溶-富集-释放状态。分解720 d时,凋落叶C释放率大小顺序为LBQ>LB>LQ>L;N释放率为L>LQ>LB>LBQ;P释放率为L>LBQ>LQ>LB;K释放率为LBQ>LB>LQ>L。
2.3 细菌群落结构变化
不同混合凋落叶细菌优势群落组成随时间的变化,见表2。

表2 不同混合凋落叶细菌优势群落组成随时间的变化Table 2 Changes of bacterial dominant community composition in different mixed litters with decomposition time
由表2可知,在凋落物分解过程中,变形菌门(39.83%~77.16%)、蓝细菌门(0.17%~25.92%)、拟杆菌门(3.95%~23.88%)和放线菌门(1.64%~15.20%)是优势细菌门。微生物群落结构的变化主要是由优势菌的变化引起[13]。因此本研究只对凋落叶优势细菌进行分析,对于4种凋落叶来说,不同分解时间的优势细菌门存在显著差异。在L处理中,随分解时间增加,变形菌门相对丰度呈下降趋势,240 d、300 d、360 d的变形菌门相对丰度显著高于720 d;蓝细菌门相对丰度随分解时间增加呈下降趋势,240 d的蓝细菌门相对丰度显著高于其他分解时间;拟杆菌门相对丰度呈波动上升趋势,600 d和720 d拟杆菌门相对丰度显著高于240 d;放线菌门相对丰度呈上升趋势,600 d、660 d和720 d的放线菌门相对丰度显著高于240 d、300 d和360 d。在LB处理中,变形菌门相对丰度随林龄的增加波动性降低,240 d的变形菌门相对丰度显著高于720 d;240 d的蓝细菌相对丰度显著高于720 d;拟杆菌门相对丰度先升高后降低,分解300 d达到最大值;放线菌门相对丰度波动性上升,720 d达到最大值。在LQ处理中,变形菌门相对丰度呈下降趋势;蓝细菌门相对丰度波动下降,分解240 d相对丰度最高;拟杆菌门相对丰度随分解时间的增加先升高后降低,分解300 d达到最大值;放线菌门相对丰度波动性上升,720 d达到最大值。在LBQ处理中,变形菌门和蓝细菌门相对丰度呈下降趋势,240 d二者的相对丰度显著高于其他分解时间;随时间增加拟杆菌门相对丰度呈先升后降的趋势,600 d达到最大值。放线菌门相对丰度随时间的增加而上升,720 d达到最大值。
对于不同处理的混合凋落叶来说,240 d和600 d不同处理的4种优势菌没有显著差异;300 d和360 d不同处理的变形菌门、蓝细菌门和放线菌门相对丰度没有显著差异,LB的拟杆菌门相对丰度显著高于L;660 d的LQ的拟杆菌门相对丰度显著高于L、LB和LBQ;720 d不同处理的蓝细菌门和放线菌门相对丰度没有显著差异,LQ的变形菌门相对丰度显著高于L、LB和LBQ ,L的拟杆菌相对丰度显著高于LB和LBQ。
2.4 细菌多样性差异
不同混合凋落叶细菌多样性指数,见表3。
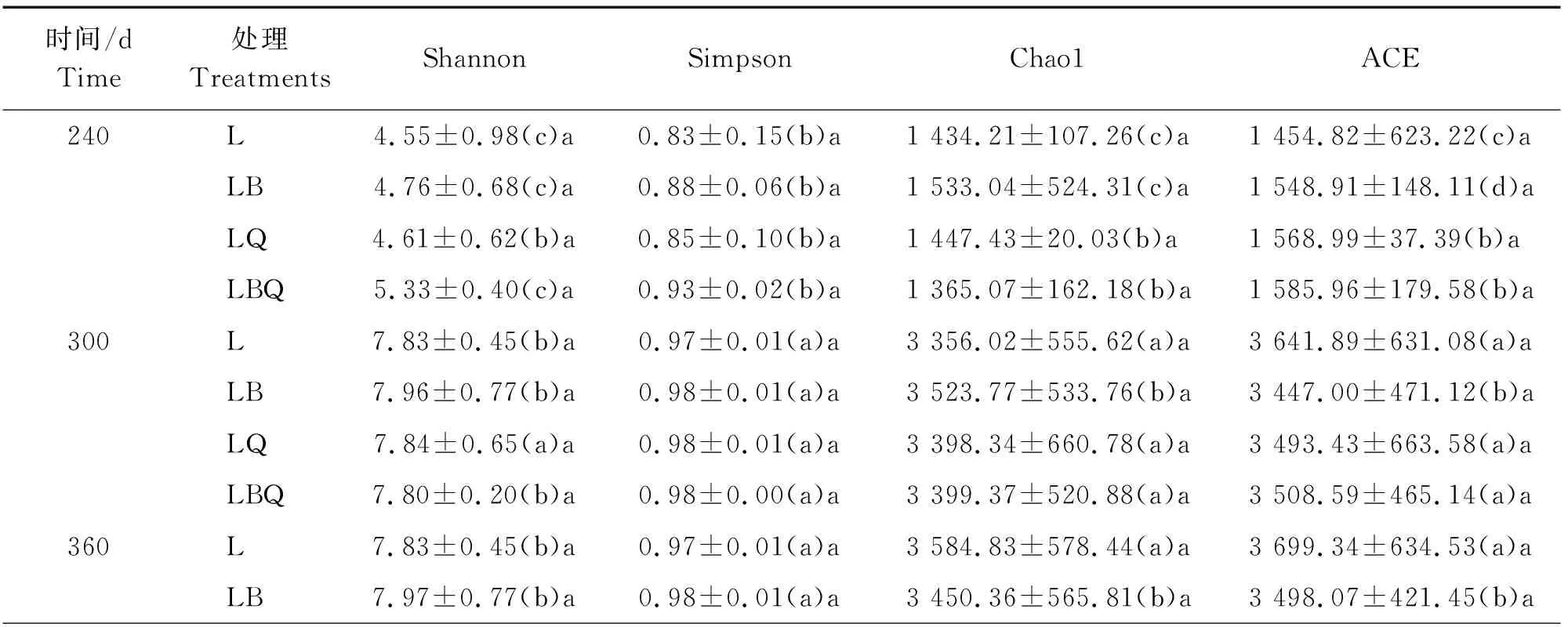
表3 不同混合凋落叶细菌多样性指数Table 3 Diversity index of bacteria in different mixed leaf litter

表3(续)
由表3可知,对于4种处理的凋落叶来说,不同分解时间的细菌多样性指数和丰富度指数存在显著差异。其中Shannon和Simpson指数均随分解时间的增加呈上升趋势,在720 d达到最大值。Chao1和ACE指数随分解时间的增加呈波动性增加,L在360 d达到最大值;LB和LQ在720 d达到最大值; LBQ在360 d和720 d达到最大值。分解600 d、660 d、720 d时,混合凋落物(LB、LQ和LBQ)的Chao1和ACE指数均大于L,在720 d时,存在显著差异。
2.5 细菌群落与养分的关系
凋落叶细菌群落与养分的相关系数,见表4。

表4 凋落叶细菌与养分的相关系数Table 4 Correlation coefficient between litter bacteria and nutrients
由表4可知,凋落叶C含量与放线菌门呈极显著负相关;凋落叶N含量与变形菌门和蓝细菌门呈极显著负相关,与放线菌门呈极显著正相关;凋落叶P含量与拟杆菌门呈显著正相关;K含量与放线菌门呈显著负相关;凋落叶pH与变形菌门和蓝细菌门呈极显著负相关,与拟杆菌门和放线菌门呈极显著正相关。N和pH均与Shannon、Simpson、Chao1和ACE多样性指数呈极显著正相关;P、Chao1和ACE呈极显著正相关;K与Shannon指数呈显著负相关。
3 讨论
3.1 混合凋落叶对养分含量和养分释放的影响
凋落叶分解过程中养分元素会发生变化,其元素迁移模式公认有3种:(1)淋溶-富集-释放;(2)富集-释放;(3)直接释放[14]。各处理凋落叶中C、N、K呈直接释放状态,P呈淋溶-富集-释放状态,这与已有研究结果相似[15]。根据本课题组对20年华北落叶松人工林凋落叶的养分释放率发现,与本试验结果相比,华北落叶松及其混合凋落叶的C和N释放率均相对较高,可能是由于林龄不同导致[16]。凋落叶分解是以C元素为主导的物质循环过程。C组成了植物体内大部分的干物质,以碳水化合物形式存在,在淋溶作用下,C呈净释放[17]。经过720 d的分解,C含量整体上呈下降趋势。分解360 d后,与混合凋落叶相比,L的C含量维持在相对较高的水平且C的释放率较低,说明受混合凋落叶的影响,C含量释放加快,混和凋落叶对C的释放有促进作用,与已有研究结果相似[18]。N是组成蛋白质和氨基酸的基本元素,微生物可以通过氨化和硝化作用将凋落叶中的N转化为植物可以吸收的离子状态。N含量虽表现为上升趋势,但为直接释放模式,这与许多研究结果产生差异;可能存在以下原因,凋落叶分解过程中N元素固定与释放的模式与凋落叶初始N含量有关,养分释放是养分含量和凋落叶干质量共同作用的结果[19-20]。本研究中初始N含量较高,导致N为直接释放模式;P是组成植物遗传物质的重要元素,P的累积和释放与P含量密切相关。分解初期,P呈现淋溶状态,P元素含量下降。分解过程中,P作为限制微生物生长的养分元素而被固定,因此P表现为富集状态。当P含量升高到不在限制微生物生长时会被微生物矿化,导致P元素被释放;K在植物体内多以离子形式存在,易受到淋溶作用呈释放状态,各处理的K含量整体上呈下降趋势;LB、LQ和LBQ的pH呈缓慢增加的趋势,L则相反。凋落叶在微生物的分解作用下,产生富里酸水溶液,凋落叶呈酸性[21]。凋落叶含盐基、灰分较多,对酸性物质起到一定的中和作用,导致土壤pH先降低再缓慢增加。L的pH显著低于LB、LQ和LBQ,说明凋落叶混合能够改善凋落叶分解过程中的酸化程度。
3.2 细菌群落结构变化特征
相关研究表明,在分解过程中,凋落叶营养元素和微环境的变化会引起微生物群落结构的改变[22]。分解初期,土壤优势细菌门为放线菌门、蓝细菌门、拟杆菌门和放线菌门。分解中后期,土壤优势细菌门为放线菌门、拟杆菌门和放线菌门,蓝细菌门相对丰度显著降低,说明分解过程中细菌群落发生了演替[23]。分解前期,不同处理的优势细菌门无显著差异;从分解300 d开始,不同混合凋落物的变形菌门和拟杆菌门相对丰度差异显著。随着分解时间增加,不同混合凋落叶的变形菌门和蓝细菌门相对丰度均减少;凋落叶的放线菌门相对丰度均呈上升趋势。L的拟杆菌门相对丰度呈波动性上升趋势,LB、LQ和LBQ的拟杆菌门相对丰度呈先升高后降低,产生该差异的原因可能是由于细菌作为异养生物,拟杆菌门能够直接参与木质纤维素的降解[24]。不同细菌群落对养分和环境的需求不同,从而产生了不同的生长策略,导致细菌群落随分解时间的变化响应不同[25]。分解过程中,不同混合凋落叶的细菌多样性指数和丰富度指数均呈现上升趋势。这是因为随着凋落物分解,C、N、K等营养物质大量释放,供给微生物生长,导致细菌群落多样性和丰富度增加[26]。有研究表明,细菌在凋落叶分解后期起主要作用[27]。分解过程中,LB、LQ和LBQ的细菌群落丰富度指数高于L,可能是因为混合凋落物为细菌群落提供的分解底物种类也越多,有利于多种不同类型的细菌群落的生长,最终使得LB、LQ和LBQ的细菌丰富度高于L[28]。
3.3 凋落叶微生物与养分的关系
养分是微生物生长的物质条件,养分的变化影响微生物的群落结构。有研究表明,pH和全氮对微生物群落结构有重要影响,与本研究结果一致[29]。pH与优势细菌门(变形菌门、蓝细菌门、拟杆菌门和放线菌门)、细菌多样性指数均存在显著相关,对细菌群落影响较大;凋落叶为细菌生长提供氮源,N通常在凋落叶分解过程中成为限制因素,影响微生物的群落变化[30]。在本研究中N与优势细菌门(变形菌门、蓝细菌门和放线菌门)、细菌多样性指数均存在显著相关。pH和N可能是限制细菌群落结构和凋落叶分解的主要因素。
4 结论
在凋落叶720 d的分解过程中,不同混合凋落叶养分变化趋势一致,N和P含量整体上呈上升趋势,C和K含量变化趋势则相反,pH呈先下降后上升趋势。混合凋落叶(LB、LQ和LBQ)的C和K释放率均高于华北落叶松凋落叶,N和P释放率则相反。华北落叶松凋落叶pH显著低于混合凋落叶(LB、LQ和LBQ)。C、N、K为直接释放状态,P为淋溶-富集-释放状态。华北落叶松、白桦和蒙古栎凋落叶混合分解可以促进华北落叶松凋落叶中C的释放,但对N的释放有一定的抑制作用。凋落叶分解初期,不同处理凋落叶的优势细菌门为变形菌门、蓝细菌门、拟杆菌门和放线菌门;分解300 d后,优势细菌门为变形菌门、拟杆菌门和放线菌门。在凋落物分解过程中,变形菌门和蓝细菌门相对丰度降低,拟杆菌门和放线菌门相对丰度升高。对于4种处理的凋落叶来说,不同分解时间的细菌多样性指数和丰富度指数存在显著差异。细菌多样性指数和丰富度呈上升趋势。凋落叶C含量与放线菌门呈极显著负相关(P<0.01);pH和N含量与细菌多样性指数呈极显著正相关(P<0.01),P与Chao1和ACE存在极显著正相关(P<0.01);K与Shannon指数存在显著负相关(P<0.05)。华北落叶松、白桦和蒙古栎凋落叶混合可以提高部分C释放率,改善凋落叶酸碱度,提高分解过程中细菌多样性。
