屎肠球菌QH06能减轻溃疡性结肠炎大鼠的结肠黏膜损伤
2022-07-18库尔班乃木卡合曼赵健锋穆凯代斯艾合买提王汉铭朱稷蔚潘文涛卡思木江阿西木江
溃疡性结肠炎(UC)是一种慢性复发性炎症性肠道疾病,病因和发病机制至今尚未完全明确。目前认为,遗传易感个体中肠道菌群的异常免疫应答可能在UC的发病机理中起主要作用。由于UC发病过程中肠黏膜屏障的破坏和免疫系统的异常激活均与肠道菌群失衡有关,因此在治疗过程中应用微生态调节剂来调节肠道菌群失衡尤为重要。益生菌是可定植于肠道并在宿主体内发挥有益作用的一类活性细菌,大多数人的益生菌属于乳酸菌属和双歧杆菌属,主要通过调节肠道免疫功能和肠道菌群来发挥作用。
通过将最危险剖面Ⅱ-Ⅱ导入MIDAS/GTS中,并根据表1数据对各种材料属性进行定义.模型为二维数值分析模型,尺寸大小为170 m×80 m,共划分为8 864个单元,15 623个节点.分别设置桩界面接触与锚索界面接触来模拟抗滑桩与土体、预应力锚索与土体的相互作用.同时将教学楼与幼儿园等建筑荷载等效为均布荷载作用在坡体上.最危险Ⅱ-Ⅱ剖面有限元网格模型如图3所示.
屎肠球菌()属肠球菌属,是人及动物肠道中正常菌群的一部分。其一直被认为是医院获得性感染的主要原因,但近期研究发现部分屎肠球菌菌株具有益生作用。研究显示,屎肠球菌定植可改善宿主肠道上皮防御能力,定期摄入屎肠球菌CRL183可减轻DSS诱导的大鼠结肠炎损伤。在饲料中添加屎肠球菌NCIMB11181可以提高饲料转化效率,减少沙门氏菌在宿主肠道中的定植。从发酵饮料中分离得到的屎肠球菌OV3-6也具有良好的益生菌潜力。此外,屎肠球菌在不同动物体内显示出不同的益生作用,其可通过黏附肠道表面形成保护屏障、降低肠道pH、维持菌群平衡,可用于幼畜的肠道保健和动物肠道菌群失调的防治。
研究发现Toll样受体(TLRs)通过对入侵机体的病原体产生免疫应答来维持内环境的稳定,某些常驻肠道细菌亚群通过TLR2信号通路诱导调节性免疫反应。因此益生菌治疗UC过程中肠道菌群和TLR2蛋白表达的变化以及两者之间的相关性关系的检测,为UC发病机制和药物治疗机制的明确提供实验依据。
由上可知,部分屎肠球菌菌株具有肠道保护作用,但屎肠球菌QH06对肠道损伤是否具有修复作用未见报道。基于此,本研究中通过TNBS/乙醇灌肠法建立大鼠UC模型,用屎肠球菌QH06进行灌胃干预,检测结肠组织中炎症相关细胞因子IFN-γ、IL-12、IL-4和IL-10的mRNA和蛋白表达水平及Toll样受体2(TLR2)的蛋白表达水平,利用Illumina Miseq 测序技术对大鼠结肠组织的肠道菌群进行测序并进行生物信息学分析。探讨屎肠球菌对Wistar大鼠UC的干预效果及其相关分子机制,为寻找治疗UC的新方法提供实验基础。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 鼠龄6~8 周的SPF 级雄性Wistar 大鼠,体质量200±20 g(新疆医科大学实验动物中心),适应性饲养1 周,保持室内温度25±3 ℃,相对湿度60%~80%,12 h明暗交替,自由饮食饮水。动物实验经新疆医科大学伦理委员会批准(许可证号:IACUC20180814-15)。
1.1.3 实验药物 屎肠球菌QH06冻干粉购于山东中科嘉亿生物工程有限公司,产品规格:活性屎肠球菌含量≥1×10cfu/g,水分<6%。
sprintf(pageName, "%s%d%s","/ata0a/rPage",fileNumber,".jpg");
1.2.2 分组及给药 36只大鼠随机分为正常对照组(12只)和模型组(24只),模型组大鼠用TNBS/乙醇灌肠法构建大鼠UC模型,模型成功后将模型组大鼠随机分成UC组和屎肠球菌组(组);屎肠球菌组用屎肠球菌QH06灌胃干预,剂量为0.21 g/kg;为了消除灌胃器械造成的实验差异,正常对照组和UC组灌胃等量的蒸馏水,灌胃14 d,2次/d。
1.1.2 主要仪器与试剂 TNBS(Sigma)、乙醇(分析纯,国产)、武汉基因美ELISA 试剂盒(货号:IFN-γ JYM0654Ra、IL-4 JYM0647Ra、IL-10 JYM0654Ra、IL-12 JYM1006Ra)、TLR2抗体(BIOSS,bs1019R)、Trizol RNA 提取试剂(Invitrogen);引物(上海生工基因)、Revert Aid First Strand cDNA Synthesis Kit逆转录试剂盒(Therom Scientific)、SYBRGreen Real-time PCR试剂盒(TaKaRa)、PCR仪(BIO-RAD)、全能型凝胶成像分析仪(BIO RAD-XR),分光光度计(NaNo DroP)、荧光定量PCR 仪(ABI 7500,QuantStudioTM Real-Time PCR System)、荧光倒置显微镜(莱卡)、Illumina高通量测序仪(上海美吉生物)。
1.2 实验方法
1.2.8 免疫组化法检测结肠组织中TLR2的蛋白表达水平 免疫组化实验步骤:制作石蜡切片→烤片1.5 h→二甲苯脱蜡→用梯度酒精进行脱水→自来水冲洗→蒸馏水冲洗→滴加内源性过氧化物酶阻断剂→PBS冲洗3次→柠檬酸修复液来抗原修复→蒸馏水冲洗2次→PBS冲洗2次→封闭→滴加一抗4 ℃过夜→PBS冲洗3次→滴加二抗37 ℃孵育30 min→显色→苏木素复染→脱水→透明→封片→干燥→阅片并使用Image-Pro Plus 6.0对相对光密度(IOD)进行量化。
思维地图类型众多的特点决定了它能应对多种教学场合,也适合学生用于复习巩固。使用思维地图构建相关知识的联系,这本来便是思维发散和训练的过程,能让学生对该学科有一个更清晰完整的系统认知,在应对问题时能快速抓住关键信息,准确找到合理的解决方法,真正达到融会贯通的目标。■
1.2.3 大鼠一般情况及体质量变化 每天观察大鼠的活动力、精神状况、毛色、粪便形状,干预前和干预结束时测定大鼠体质量,进行组间比较。
以小学语文四年级课程《颐和园》为例,课文描述了颐和园的宏伟壮丽,雕梁画栋,色彩斑斓,集多国风情于一体,气势恢宏,属于园林建筑中的经典,不仅让学生了解了各国的文化,了解了我国相关时期的历史和建筑造诣,更使学生了解到了“落后就要挨打”的硬道理。经典毁于战火,是我们不够强大,因此,要励精图治,自强不息。在对这一课程学习时,使用合作学习模式,可以分为多个小组,教师让每个小组对于这篇课文进行研读,然后每个学生写出读后感,每个小组写出读后感,在全体同学面前进行阅读,并由全体同学进行品评,主要的品评依据为文字表达能力、理解能力、朗读能力等,并对学生进行适当指导和奖励,使学生增强学习的兴趣和自信心。
1.2.4 标本采集 禁食24 h的大鼠麻醉后取整段结肠组织并分3部分:(1)高通量测序部分:用无菌眼科剪刀及眼科镊剪取1 cm左右大小的结肠组织,将其装入2 mL无菌冻存管后迅速置于液氮中冻存并用干冰送检;(2)组织病理学部分:剪取一部分结肠组织置于4%的多聚甲醛溶液中固定,用于HE染色;(3)分子实验部分:剪取一部分分装于灭菌EP管中,放入-80 ℃的冰箱保存,以上操作均为纵向剖开结肠组织后进行。
1.2.5 组织病理学检测 用4%的多聚甲醛固定的结肠组织进行脱水、包埋,取4 μm组织切片,进行HE染色,参照文献[14]的组织学评分标标准,由病理科专业人员盲法阅片,评分为4个等级,评分越高,表明黏膜损伤及炎症程度越高(表1)。
1.2.6 RT-qPCR 法检测结肠组织中相关炎症因子的mRNA表达水平 用匀浆机充分研磨大鼠结肠组织,加入1 mL TRIzol,采用氯仿异丙醇法提取结肠组织总RNA,用NanoDrop超微分光光度计测定RNA样品浓度和纯度,并经凝胶成像仪鉴定后参照逆转录试剂盒说明取1μg RNA逆转录成cDNA。在GenBank数据库中查询大鼠IFN-γ、IL-12、IL-4、IL-10等mRNA序列,利用IDT 引物设计网站设计引物(表2)。在ABI 7500(QuantStudioTM Real-Time PCR System)系统下进行PCR扩增,PCR产物通过琼脂糖凝胶电泳鉴定。

1.2.7 ELISA法检测结肠组织中炎症因子和TLR2的蛋白表达水平 将冷冻的结肠组织样品中加入PBS(pH 7.4)后匀浆。样品应在4 ℃下操作。在2000~3000 r/min离心20 min后,收集上清液。分装上清液用于ELISA分析。操作步骤按ELISA试剂盒说明进行,大致如下:(1)标准品的稀释;(2)微孔板中加样;(3)加入HRP结合试剂(空白对照孔除外);(4)温育;(5)配液;(6)洗涤;(7)显色;(8)终止;(9)450 nm处用酶标仪测定吸光度;(10)用标准曲线计算结果。
1.2.1 TNBS/乙醇灌肠法建立大鼠UC 模型 参照文献[12,13]建立大鼠UC模型,5%的TNBS溶入等体积50%的无水乙醇中,用液体石蜡润滑的内径1.5 mm的硅胶灌缓慢注入保持仰卧姿势的大鼠结肠内(离肛门约8 cm处),注入完成后,轻轻拔出硅胶管并立即捏紧大鼠肛门使大鼠呈倒立姿势保持1 min左右,TNBS/乙醇混合液能充分吸收后将大鼠放入干净的清洁笼内,正常对照组大鼠注入相应体积的0.9%氯化钠溶液灌肠,待大鼠自行清醒,自由饮水。造模第3天开始用普通鼠饲料饲养。
1.2.9 结肠组织标本16S rRNA多样性测序 具体流程如下:提取结肠组织总DNA后,对结肠组织总DNA的浓度和纯度进行测定。提取的DNA为模板,对16SrRNA V3-V4可变区进行PCR扩增。引物为338F:ACTCCT ACGGGAGGCAGCAG,806R:GGACTACHVGGGT WTCTAAT;使用AxyPrep DNA Gel Extraction Kit 对PCR产物纯化,使用NEXTFLEXRapid DNA-Seq Kit进行建库,利用Illumina公司的MiseqPE300平台进行测序。
1.3 统计学分析
数据采用SPSS 21.0(IBM SPSS Statistics)软件进行统计,实验数据均采用均数±标准差描述,多组间比较采用单因素方差分析,计量资料服从正态性和方差齐性时采用LSD-方法检验,方差不齐则采用秩和检验,<0.05为差异有统计学意义。
我在口袋中寻找到车钥匙,并把我的手机悄悄放到桌子上——瑞安事先非常清楚地表明,不要带上手机,也不要写下地堡的位置。当我悄悄走向出口时,没人注意到我。我在途中还一把抓起那只装满药物的行李箱。看起来,现在不太可能有其他人会需要它。
2 结果
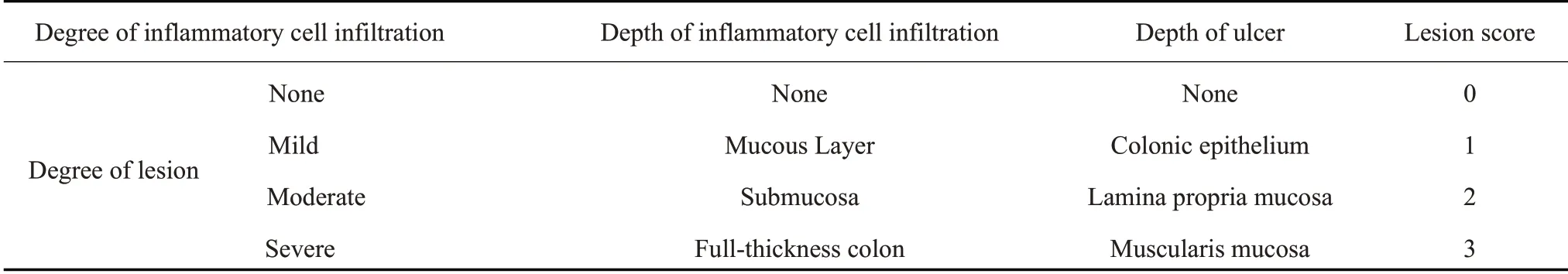
2.1 屎肠球菌对UC大鼠体质量的影响
与正常对照相比,造模组大鼠造模后第2天起出现食欲减退、精神萎靡,活动量减少等现象,大部分大鼠出现稀便、粘液脓血便。造模第2天在正常对照组和UC组中,各随机选择2只大鼠,处理后对其结肠组织进行肉眼观察发现,UC组大鼠结肠组织出现充血、水肿和溃疡等情况。根据一般特征和结肠组织观察结果确定为UC模型造模成功。干预后,随着屎肠球菌干预时间的延长,逐渐出现大鼠增重、活动量增多、大便成形等现象。干预结束后测定的体质量结果显示,与正常对照组相比,UC组大鼠体质量明显降低(<0.01);与UC组相比,屎肠球菌组大鼠体质量有显著升高(<0.05,图1)。
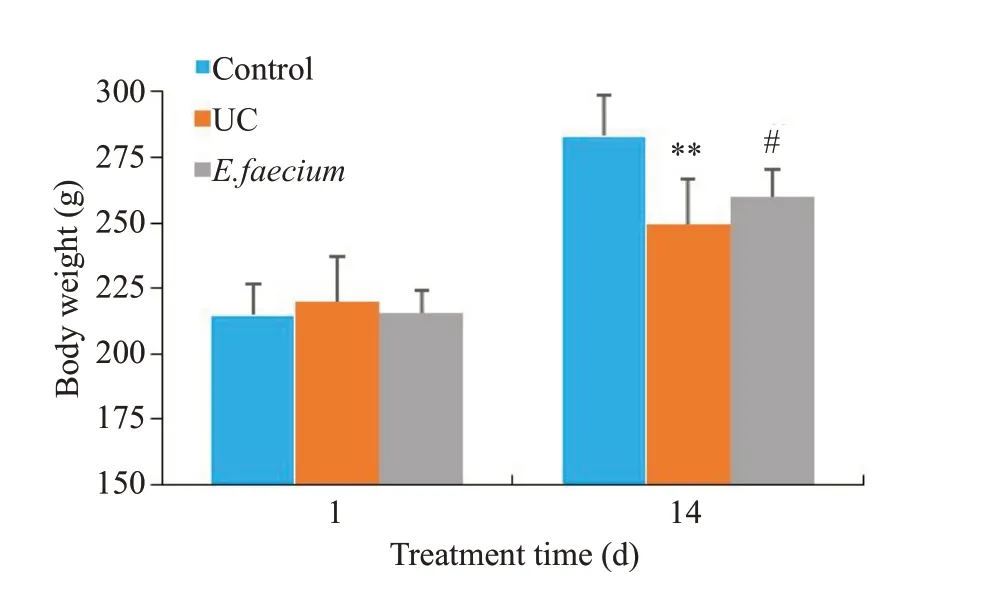
2.2 屎肠球菌减轻UC大鼠结肠组织损伤
与正常对照组相比,UC组大鼠结肠组织炎细胞浸润明显,腺体损伤严重,不同程度的腺体结构消失,溃疡深达肌层,表层可见纤维素样渗出物并夹杂着坏死组织。与UC组相比,屎肠球菌组大多数大鼠结肠组织溃疡面积缩小,见少许糜烂,但黏膜和黏膜下层仍有炎细胞浸润,部分上皮细胞增生和肉芽组织形成,可能是溃疡处于恢复状态,3例大鼠溃疡无明显好转(图2)。
而真实的情况是——有得必有失。Tina夫妇都是看重事业的人,追求更高职位的同时,也牺牲了夫妻甜蜜相处的时光。上司的一个电话就可能破坏了两个人的清闲周末,一次刻不容缓的业务谈判就推迟了早早制定好的出游计划。
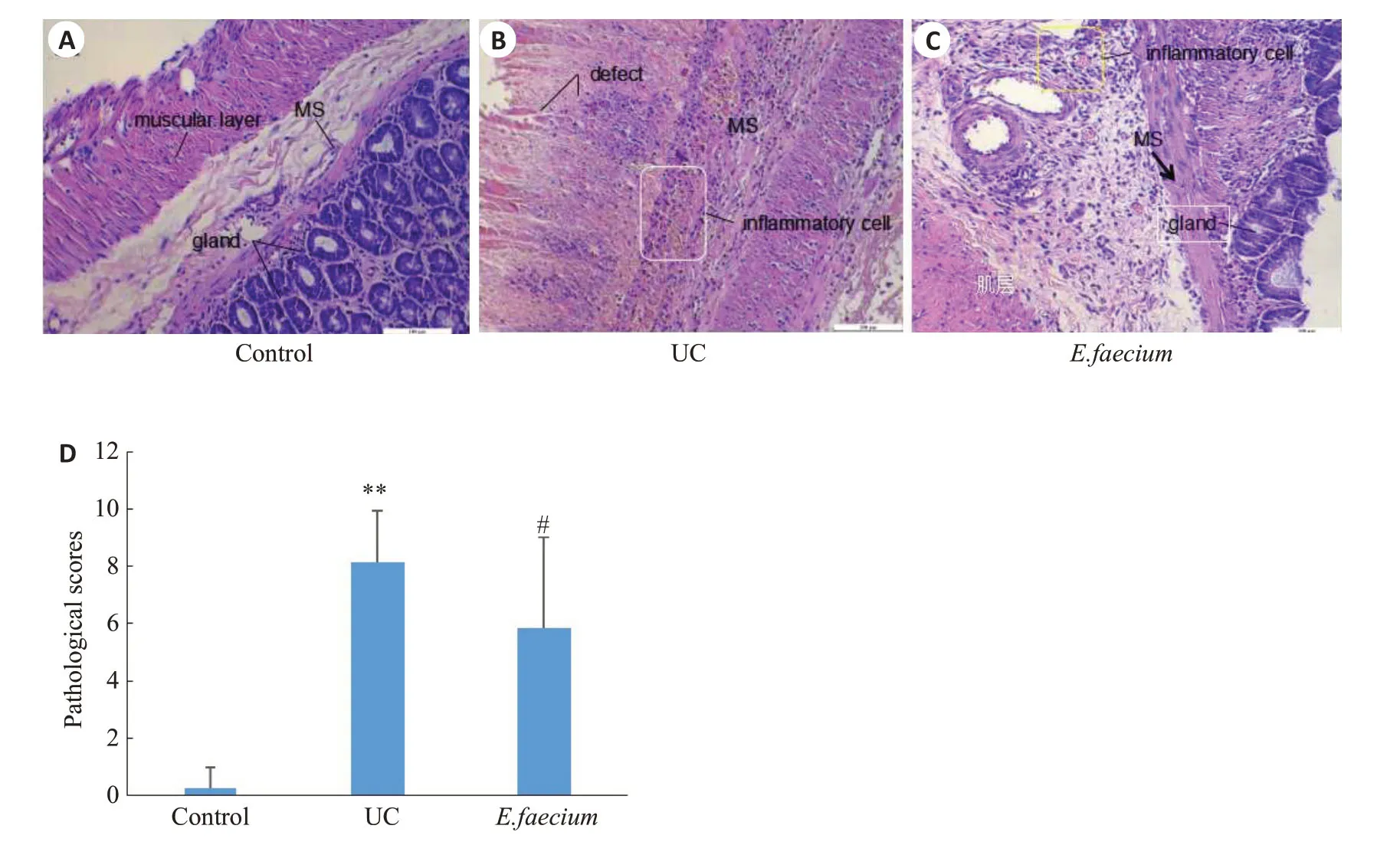
2.3 屎肠球菌对UC大鼠结肠组织中炎症因子表达的影响
采用Simpson、Shannon、Ace、Chao指数比较各组大鼠肠道菌群多样性。Simpson和Shannon反映微生物群落多样性,Ace和chao指数反映微生物群落丰富度。与正常对照组相比,UC组Shannon、Ace和Chao指数均降低(<0.05 或0.01),而Simpson 指数升高(<0.05);与UC组相比,屎肠球菌组Shannon、Ace和Chao 指数均升高(<0.05),而Simpson 指数降低(<0.05)。说明UC组和正常对照组的肠道菌群多样性存在差异,UC组大鼠肠道所含的物种种类低于正常对照组。屎肠球菌QH06能够提高肠道菌群丰富度(表4)。
2.4 屎肠球菌对UC大鼠结肠组织炎症因子mRNA表达水平的影响
与正常对照组相比,UC组中IL-12、IFN-γ和IL-10的mRNA 表达水平均明显上调,差异有统计学差异(<0.05);与UC 组相比,屎肠球菌组大鼠结肠组织IFN-γ和IL-12 的mRNA表达水平明显下调,差异有统计学意义(<0.05,表3)。
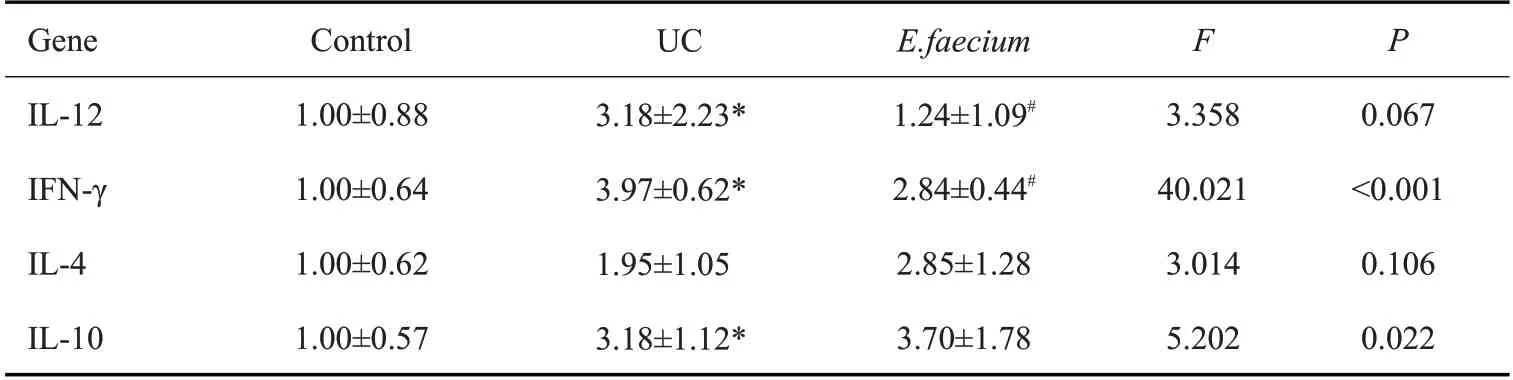
2.5 屎肠球菌对UC大鼠结肠组织中TLR2表达的影响
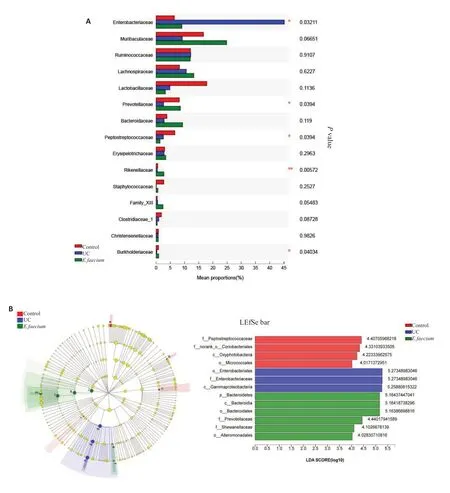
各组大鼠肠道菌群在科水平上进行组间差异检验,结果显示(图8A),相对丰度前15的菌中,,,,和有组间差异;进一步使用LEfSe分析软件对3组样本进行多级物种差异判别分析(LDA),找到与丰度有显著性差异的类群,本次分析中选择LDA 阈值为4 的物种。研究结果显示(图8B),,,和等菌在正常对照组中显著富集。,,在UC组中显著富集;,,,,和在屎肠球菌组中显著富集。
2.1.1 病情观察。在护理过程中护士必须了解患者的既往病史和基础病用药情况,以便进行重点而有针对性的观察和护理,观察患者神志是否清楚,口唇甲床颜色,生命体征变化,出入量平衡情况,痰液色、量、性质,大便颜色等并作好记录,发现变化及时告知医生。2.2.2 体温监测。对于发热的患者做好日常的生活护理,密切观察患者体温变化情况,按医嘱采取有效降温措施,如冰袋降温,温水擦浴。
2.6 屎肠球菌提高UC大鼠肠道菌群多样性
采用Rank-abundance曲线解释物种丰富度和均匀度。从图5A可知,随着样本量的增加,曲线逐渐趋于平缓,说明随着样本量的增加基本不能增加新OTU 数目。UC组曲线宽度小于正常对照组,说明UC组肠道菌群多样性较低。屎肠球菌组曲线宽度大于UC组,说明干预后UC大鼠的肠道菌群多样性升高。Pan和Core分析结果(图5B、C)显示,随着样本量的增加,总OTU和核心OTU的增加趋势逐渐趋于平缓,说明各组样本量满足评估物种所需的总物种和核心物种数的要求。Rarefaction Curve(图5D)和Shannon Curve(图5E)结果显示,本次所测序的数据量合理。

2.7 各组大鼠肠道菌群Alpha 多样性分析
与正常对照组相比,UC组IL-12和IFN-γ的蛋白表达水平明显上调,差异有统计学意义(<0.01),IL-4和IL-10蛋白表达水平无统计学差异(>0.05);与UC组相比,屎肠球菌组大鼠结肠组织IL-12、IFN-γ蛋白表达水平明显下调,差异有统计学意义(<0.01或<0.05),而IL-4蛋白表达水平明显上调(<0.05,图3)。

2.8 各组大鼠肠道物种组成分析
根据Venn图谱分析发现,3组共有832种共有物种,其中正常对照组和UC组共有1031种,正常对照组和屎肠球菌组共有978种,UC组和屎肠球菌组共有893种;其中每组特有的物种有:正常对照组312种、UC组92种、屎肠球菌组181种(图6A);在门水平上,3组共有的优势菌门为厚壁菌门()、变形菌门()和拟杆菌门()(图6B),结果显示,UC组中变形菌门丰度明显高于正常对照组,屎肠球菌干预后其丰度明显下降;同时UC组中厚壁菌门和拟杆菌门丰度明显低于正常对照组,屎肠球菌干预后其丰度升高;在科水平上,正常对照组中丰度大于1%的菌有11 种,UC 组中9 种,屎肠球菌组中11 种;Bar 图(图6C)结果显示,UC 组中丰度最高的菌为,屎肠球菌组中丰度最高的为;在属水平上,UC组中大肠埃希菌.志贺菌属()和克雷伯氏菌属()等条件致病菌的丰度明显升高,屎肠球菌干预后其丰度下降,尤其的丰度下降尤为明显(图6D)。

2.9 与UC发生相关菌群在各组中的差异分析(属水平)
双歧杆菌()和拟杆菌()作为肠道中的优势菌,在营养和免疫调节中发挥关键作用,而阿克曼氏菌可产生短链脂肪酸,并且具有益生元效应。本研究中,以上3种菌属丰度在UC组中均下降,而屎肠球菌QH06干预后丰度升高,其中双歧杆菌组间有统计学差异(<0.01)。的出现通常与癌症的发生有关,而是最典型的致病菌。本研究UC 组大鼠中和丰度均明显升高,屎肠球菌干预后2者丰度明显下降,但在同组不同样本间的组内差异较大,最终导致组间无显著差异(图7)。

2.10 物种差异分析(科水平)
TLR2蛋白主要表达在结肠组织黏膜层、黏膜下层的胞质及胞膜中,为弥漫性黄色颗粒。正常对照组TLR2蛋白弱表达;UC组阳性区域较明显,染色深、分布密集。屎肠球菌组TLR2蛋白有不同程度的阳性表达(图4A~C)。ELISA法检测3组大鼠结肠组织中TLR2蛋白表达情况结果显示,与正常对照组相比,UC组TLR2表达显著上调(<0.01)。与UC组相比,屎肠球菌组TLR2蛋白表达显著下调(<0.01,图4D)。
2.11 肠道菌群与炎症因子、TLR2相关性分析
通过Spearman相关系数分析各组大鼠肠道菌群与细胞因子、TLR2 指标相关性。相关性结果显示(图9),IFN-γ与呈正相关、而与、、、呈负相关;IL-10 与呈负相关;IL-4 和IL-12 与、呈负相关;TLR2 与、和呈负相关。

3 讨论
UC发病过程中免疫系统的异常激活与肠道菌群失衡有关,因此除调节肠道免疫外,辅助应用益生菌、益生元和合生元等微生态调节剂调节肠道菌群失衡在UC的治疗中也尤为重要,其中益生菌通过调节宿主体内的肠道菌群、作用于肠道屏障、调节免疫等途径维持宿主肠道的健康。大多数文献报道的益生菌属于乳酸菌属和双歧杆菌属,而关于屎肠球菌作为益生菌的有效性的信息较少。本研究用屎肠球菌QH06干预TNBS/乙醇诱导的大鼠UC观察结肠组织中相关细胞因子、TLRs以及肠道菌群的变化。
IL-12和IFN-γ作为T细胞介质和UC相关的重要炎性细胞因子,可以诱导CD4T细胞往Th1细胞的方向分化。本研究发现,UC 大鼠结肠组织中IL-12 和IFN-γ的mRNA和蛋白表达水平均上调,说明UC组大鼠结肠组织中Th1细胞活化,释放IL-12和IFN-γ,使促炎因子释放量增多,加速UC的发生发展。CD4T细胞可以被IL-4诱导分化为Th2细胞,Th2细胞分泌IL-4和IL-13介导体液免疫和超敏反应。本研究发现UC组大鼠结肠组织中IL-4的mRNA和蛋白表达量均无显著变化,说明UC组大鼠结肠组织中促炎因子表达量高于抗炎因子,从而导致细胞因子平衡紊乱,促进UC的失衡性发展。益生菌具有调节肠道微生物群、抑制病原菌粘附、增强胃肠道屏障功能、诱导抗炎细胞因子和抑制促炎细胞因子等作用。本研究中,屎肠球菌QH06干预后大鼠结肠组织中IL-12和IFN-γ等促炎因子的mRNA和蛋白表达量均降低,抗炎因子IL-4的蛋白表达量显著上调,说明屎肠球菌QH06具有抑制促炎因子的表达,促进抗炎因子表达的功能。
通过对兰科植物分布信息进行研究分析发现,无叶美冠兰Eulophia zollingeri (Rchb. f.) J. J. Smith、大花无柱兰Amitostigma pinguicula (Rchb. f. et S. Moore) Schltr.、长叶山兰Oreorchis fargesii Finet、广东盆距兰Gastrochilus guangtungensis Z. H. Tsi、芳线柱兰Zeuxine nervosa (Lindl. ) Trimen、紫花鹤顶兰Phaius mishmensis (Lindl.et Paxt.) Rchb. f.为贵州兰科植物新分布。
细胞因子间的平衡可能与TLRs有关,TLRs作为先天免疫的主要模式识别受体,能够识别各种病原体相关的分子,被认为是先天免疫和后天免疫之间的桥梁,当肠道菌群紊乱引起条件致病菌大量繁殖时,病原体识别表达于肠道黏膜多种细胞中的TLRs,通过TLRs介导的信号转导途径诱导相关基因的表达,触发和调节先天免疫并诱导获得性免疫,进而激活肠黏膜的炎症反应造成UC的病情发展。因此肠道菌群、免疫和TLRs相关性研究有利于进一步阐明UC发生发展的分子机制。TLR2作为TLR家族的主要成员,识别与革兰氏阴性和革兰氏阳性细菌的病原相关分子模式,它的激活可能使固有单层的肠单核细胞转变为促炎性效应细胞。研究报道显示,在DSS诱发的IBD小鼠在患病期间,TLR2明显上调,说明TLR2表达的变化和随后的先天免疫应答的改变是IBD发病的原因。本研究结果显示,UC大鼠结肠组织中TLR2表达量明显上调,表达部位主要集中于黏膜层和黏膜下层,而屎肠球菌干预后UC大鼠结肠组织中TLR2表达量下调。研究报道显示,屎肠球菌干预后的健康狗结肠组织活检中TLR2和TNF-a的表达量减少,提示屎肠球菌对UC大鼠结肠组织黏膜损伤的修复作用可能与TLR2介导的信号通路的抑制有关。
肠道菌群紊乱是UC发生的主要原因已被大量的实验证明。目前的理论认为,肠道微生物组的改变会触发异常的黏膜免疫反应并导致慢性肠道炎性疾病的发展。本研究通过高通量测序分析了屎肠球菌干预后的UC大鼠肠道菌群的变化。本研究Rank-abundance曲线和α多样性指数结果显示,UC组大鼠的肠道菌群多样性和丰富度下降,UC状态下大鼠肠道抵御环境变化的能力减弱,肠道菌群发生紊乱。屎肠球菌组Rankabundance曲线和α多样性指数结果均明显高于UC组,屎肠球菌QH06干预后UC大鼠肠道菌群变得更为丰富,这有利于功能相近的物种及时代偿另一种功能缺陷的物种。
随着计算机技术和微电子技术的发展,电机作为自动化控制的执行单元,越来越多地运用在各种领域中,许多控制领域需要对多台电机进行同步协调控制,如军事、航空、机器人控制。特别是近年来,随着嵌入式技术和集成化的发展,其应用范围逐步扩大,逐渐扩展到普通民用行业,如小型雕刻机、运动转台等[1]。在应用中,对速度、位置的精度控制尤为重要,所以对于电机的控制要具有实时性。随着电机控制技术的不断发展,对单个电机的控制已经得到了广泛的应用和发展。但对于多路电机系统,设计一种高性能低成本的控制系统很有必要。针对这种需求,本文设计了一种基于LM3S811的多路电机控制系统。
厚壁菌门会促进食物中的热量和各种营养元素的吸收。常驻胃肠道细菌拟杆菌负责维持黏膜稳态并为黏膜屏障提供保护,而变形菌门为UC组大鼠肠道中主要的优势菌。本研究中UC组大鼠结肠组织中厚壁菌门和拟杆菌门丰度明显下降,同时变形菌门丰度明显升高。UC组大鼠中厚壁菌、拟杆菌等优势菌的多样性及数量的减少和变形菌的增多可能给机会性微生物提供优势,引起侵略性免疫反应,导致UC的恶性发展。属水平研究结果显示,UC 组大鼠中Klebsiella 和Escherichia-Shigella 等条件致病菌丰度明显升高,而双歧杆菌、阿克曼氏菌等益生菌或短链脂肪酸产生菌的丰度下降。在屎肠球菌QH06干预后,此趋势逆转,说明屎肠球菌QH06 对部分条件致病菌的生长具有抑制作用。科水平上进行的差异物种结果显示,肠杆菌科(Enterobacteriaceae),普氏菌科(Prevotellaceae),消化链球菌科(Peptostreptococcaceae),Rikenellaceae 和Burkholderiaceae等物种3组间有差异。其中,UC组肠杆菌科丰度显著高于正常对照组,而肠杆菌科丰度与促炎因子IFN-γ表达量呈正相关。许多研究报道显示,在IBD患者中,潜在有害的变形菌门,特别是肠杆菌科的比例增加,与本研究结果一致。本研究中与UC组相比,屎肠球菌干预后肠杆菌科丰度显著下降,而且正常对照组和屎肠球菌组间无显著差异。其说明屎肠球菌QH06通过抑制肠杆菌的生长影响IFN-γ的表达,抑制异常免疫炎症反应的放大,有利于溃疡的愈合。研究发现,在IBD 患者中Rikenellaceae,Christensenellaceae,Ruminococcaceae和Tannerellaceae等丁酸产生菌的丰度减少,其与肠道炎症的发生和IBD的恶化有关。本研究中,屎肠球菌QH06干预后肠杆菌科丰度下降的同时,为肠上皮提供能量的Rikenellaceae的丰度显著升高,说明屎肠球菌促进肠上皮细胞获得能量,对肠道营养吸收等功能的正常发挥至关重要,此可能为屎肠球菌组大鼠体重上升的原因之一。普氏菌科是一种短链脂肪酸(SCFA)产生菌,可维持肠道屏障的完整性和稳定性,促进胃肠道蠕动。本研究中UC组普氏菌科丰度降低,而屎肠球菌干预后普氏菌科丰度升高,说明屎肠球菌QH06通过提高普氏菌科的丰度,促进SCFA的产生,给予肠上皮细胞提供能量,促进已被破坏的肠道屏障的愈合。Burkholderiaceae丰度在UC大鼠肠道中降低,此结果与结肠癌模型大鼠实验中所获得的结果一致。本研究中屎肠球菌干预后Burkholderiaceae丰度恢复到正常水平,提示屎肠球菌可能促进Burkholderiaceae菌的生长。
研究报道显示,普氏菌主要激活TLR2,进而促进实验性结肠炎的Th1免疫应答,与本研究结果相反。本研究中普氏菌科丰度与TLR2,IFN-γ的表达呈负相关,提示UC大鼠肠道中普氏菌科丰度的降低,有利于TLR2 的过表达,导致Th1 细胞的过度分化,而促进IFN-γ等促炎因子的产生。而屎肠球菌通过促进普氏菌的产生,抑制TLR2过表达和IFN-γ的过量产生,有利于溃疡的愈合。然而,普氏菌科在炎症的产生过程中到底扮演什么样的角色需要进一步研究。
本次研究中屎肠球菌QH06对TNBS诱导的大鼠UC有一定的治疗效果,其对UC的干预作用机制可能与促炎细胞因子和TLR2蛋白表达的抑制有关。
在下塘电站岩体附近施测的5线综合物探剖面较明显地反映出F2、F3断层和已知银铅锌矿体的存在(图4、6),矿体产于高、低阻急剧变化的F3断裂带上,CSAMT剖面较清晰地显示出深部高阻隐伏岩体和低阻隐爆角砾岩的空间形态,隐伏岩体主体埋深均在-300m标高以下,隐爆角砾岩呈陡产状产于F2和F3断裂之间。
