腐食酪螨对阿维菌素的抗性相关基因鉴定与功能分析
2022-07-16曲绍轩骆昕徐平侯子强李辉平林金盛侯立娟蒋宁马林
曲绍轩 骆昕 徐平 侯子强 李辉平 林金盛 侯立娟 蒋宁 马林

摘要: 为揭示腐食酪螨对阿维菌素的抗性形成机制,通过RNA-seq技术获得亚致死剂量阿维菌素胁迫下腐食酪螨转录组序列,鉴定到138个差异表达的基因被注释到解毒代谢中,包括4个谷胱甘肽 S 转移酶基因( GST ),12个细胞色素P450基因(P450)和3个羧酸酯酶基因( CarE )。利用RNAi技术沉默差异表达的11个解毒代谢基因后,腐食酪螨对阿维菌素的敏感性发生显著性变化,毒力指数在0.65~6.05。结果显示, GST 家族中TPGST7、TPGST45和TPGST49以及P450基因TPCYP3A9、TPCYP3A13和TPCYP4C3均参与腐食酪螨对阿维菌素的抗性形成。此外,葡萄糖醛酸转移酶( GLT )家族基因TPGLT28首次被证实参与腐食酪螨对阿维菌素的抗性形成。
关键字: 食用菌害螨; 抗性相关基因; RNAi; 抗药性
中图分类号: S436.46+2 文献标识码: A 文章编号: 1000-4440(2022)03-0617-08
Identification and functional analysis of resistance genes of Tyrophagus putrescentiae Schrank to abamectin
QU Shao-xuan, LUO Xin, XU Ping, HOU Zi-qiang, LI Hui-ping, LIN Jin-sheng, HOU Li-juan, JIANG Ning, MA Lin
(Institute of Vegetable Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: To reveal the farmation mechanism of the resistance of Tyrophagus putrescentiae to abamectin, the transcriptome sequence of Tyrophagus putrescentiae under a sublethal dose of abamectin was obtained by RNA-seq technology. A total of 138 differentially expressed genes were identified and annotated to detoxification metabolism, including four glutathione S transferase genes ( GST ), 12 cytochrome P450 genes (P450) and three carboxylesterase genes ( CarE ). After silencing the 11 differentially expressed genes by using RNAi technology, the susceptibility of the transcriptome sequence of Tyrophagus putrescentiae to abamectin changed significantly, and the virulence index ranged from 0.65 to 6.05. The results showed that TPGST7, TPGST45 and TPGST49 in GST family and P450 genes TPCYP3A9, TPCYP3A13 and TPCYP4C3 were involved in the formation of resistance of T. putrescentiae to abamectin. In addition, the glucuronosyltransferase (GLT) family gene TPGLT28 was first confirmed to be involved in the formation of abamectin resistance.
Key words: mushroom mite pest; resistance-related gene; RNAi; insecticide resistance
螨類害虫个体微小,繁殖力和对环境的适应能力都极强,单一药剂胁迫使螨类很快产生抗药性,已无法达到理想的防治效果 [1-2] 。阿维菌素因其杀虫杀螨活性强、高效低残留等特点而被广泛用于田间包括腐食酪螨在内的害螨防治,导致害螨对其抗药性日益增加 [1,3-4] 。2020年全国农业有害生物抗药性监测结果显示,二斑叶螨(Tetranychus urticae Koch)在中国4省4县市监测地区的种群对阿维菌素已产生了高水平抗性,抗性倍数在304~1 051 ,对虫螨腈、腈吡螨酯也处于中等至高水平抗性 [5] 。由于存在高抗性问题,阿维菌素已不能再用于这些地区二斑叶螨的防治,这与害螨抗药性形成快、增长幅度高紧密相关 [5-6] 。
基于现代科技的发展,转录组测序技术、RNAi技术越来越多地应用于昆虫毒理学研究领域 [7] 。目前,大量研究结果证实害螨通过代谢解毒能力增强、靶标部位敏感性降低等途径产生对阿维菌素的抗性,靶标抗性主要包括谷氨酸氯离子通道 (Glutamate-gated chloride channels , GluCl)、γ-氨基丁酸受体(Gamma-aminobutyric acid receptor,GABAR)和γ-氨基丁酸氯离子通路(GABACls)等,解毒酶家族包括多功能氧化酶( MFO )、谷胱甘肽 S 转移酶( GST )和羧酸酯酶( CarE )等。此外利用基因芯片技术还发现内环裂解双加氧酶( ID-ICD )、丝氨酸蛋白酶( SP )、组织蛋白酶L( L )和P-糖蛋白(P-GP)等与朱砂叶螨(T. cinnabarinus Boiduval)对阿维菌素的抗性形成相关 [6-9] 。
腐食酪螨(Tyrophagus putrescentiae Schrank)是世界性重要粮储害螨之一,分布广,食性杂。近年,随着食用菌“设施化制种+生态出菇”模式的迅速发展,恒温恒湿的发菌环境和稳定的寄主资源,使得腐食酪螨的发生频次不断上升,危害也越来越严重,成为食用菌栽培的最主要害螨之一 [10-11] 。该螨危害毛木耳、黑木耳、银耳、真姬菇、金针菇等食用菌菌丝和子实体,还携带并传播病原菌,短时间内可造成食用菌大幅减产甚至绝产 [12] 。腐食酪螨个体微小,体长在0.4~ 0.6 mm,可从栽培袋或出菇瓶的口端缝隙、出菇孔或接种处进入料中取食菌丝,喷洒的药剂无法有效灭杀袋内或瓶内的螨虫,且缺乏有效的防控措施,导致乱用和滥用杀虫杀螨剂的现象频发,严重制约着食用菌产业的绿色安全生产 [13] 。长期的化学防治,使其对阿维菌素、哒螨灵、有机磷类农药产生了高抗药性 [1-4] ,而有关腐食酪螨对阿维菌素的代谢、解毒及其抗性机制仍不清楚。
本研究利用高通量测序技术对腐食酪螨在阿维菌素胁迫下的转录组进行研究,挖掘和鉴定该螨对阿维菌素的抗性相关基因,并通过RNAi技术进一步明确与抗药性密切相关的基因功能,为揭示腐食酪螨抗药性的分子机制和制定治理策略奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试螨虫 供试腐食酪螨(T. putrescentiae)于2012年采自江苏省丰县师寨镇毛木耳子实体上,转至实验室内,无接触化学药剂,人工气候箱(25 ℃± 1 ℃,相对湿度80%± 5%)中以香菇(Lentinula edodes L.)麦粒种为饲料饲养至今。饲养方法同Qu等 [12] 。
1.1.2 主要试剂与仪器 90%阿维菌素原药购自上海源叶生物科技有限公司,柱式法通用型总RNA提取试剂盒(9767)购自宝生物工程(大连)有限公司,一步法TB Green RT-PCR定量检测试剂盒(RR096A)购自宝生物工程(大连)有限公司。主要仪器有SPX-2501人工气候箱(上海博讯实业有限公司产品)、CFX95 Touch型实时荧光定量PCR仪(BIO-RAD公司产品)、PCR扩增仪(BIO-RAD公司产品)、核酸电泳仪和水平电泳槽(北京市六一仪器厂产品)、显微凝胶成像仪(上海培清科技有限公司产品)、核酸定量仪(NanoDrop One, Thermo Fisher Scientific)。
1.2 试验方法
1.2.1 亚致死剂量阿维菌素处理腐食酪螨 阿维菌素原药(溶于丙酮)用ddH2 O稀释成1 000 mg/L 母液在4 ℃冰箱里避光储存。使用ddH2 O将阿维菌素母液稀释到0.5 ng/L ,采用胃毒触杀联合毒力测定法处理腐食酪螨,具体操作方法同骆昕等 [3] 方法。将0.025 g成螨(约1 500 头)放入养虫瓶内,盖上瓶盖,然后置于人工气候箱(25 ℃、相对湿度75%± 5%、无光照)中饲喂24 h,然后用200目过滤网收集活螨,ddH2 O清洗3次,用滤纸吸干水分后放入1.5 ml的离心管中,液氮中预冷4 h以上,放入-80 ℃ 冰箱中保存,重复3次。对照组,直接取0.025 g饲养在香菇麦粒种中的成螨,ddH2 O清洗3次后,同处理组一样的方式进行样品预冷和保存。
1.2.2 转录组测序和生物学分析 螨虫样品委托华大基因有限公司(深圳)进行总 RNA 提取、质量分析、cDNA文库的建立及测序工作。采用Illumina HiSeq 2500系统进行测序,将拼接的unigenes与NR(NCBI non- redundant protein sequences)、NT(NCBI nucleotide sequences)、Pfam(Protein family)、KOG/COG(Clusters of orthologous groups of proteins)、Swiss-prot(A manually annotated and reviewed protein sequence database)、KEGG (Kyoto encyclopedia ofgenes and genomes)、GO(Gene ontology)等数据库进行基因功能注释。使用DESeq2进行差异基因的筛选,采用FDR法对差异检验的P值作多重假设检验校正得到 Q 值,为了得到显著差异表达的基因,筛选条件為差异倍数(Fold Change)≥2或≤ -2且 Q 值< 0.01,然后通过对差异基因进行GO功能注释和KEGG通路富集分析 [4] 。
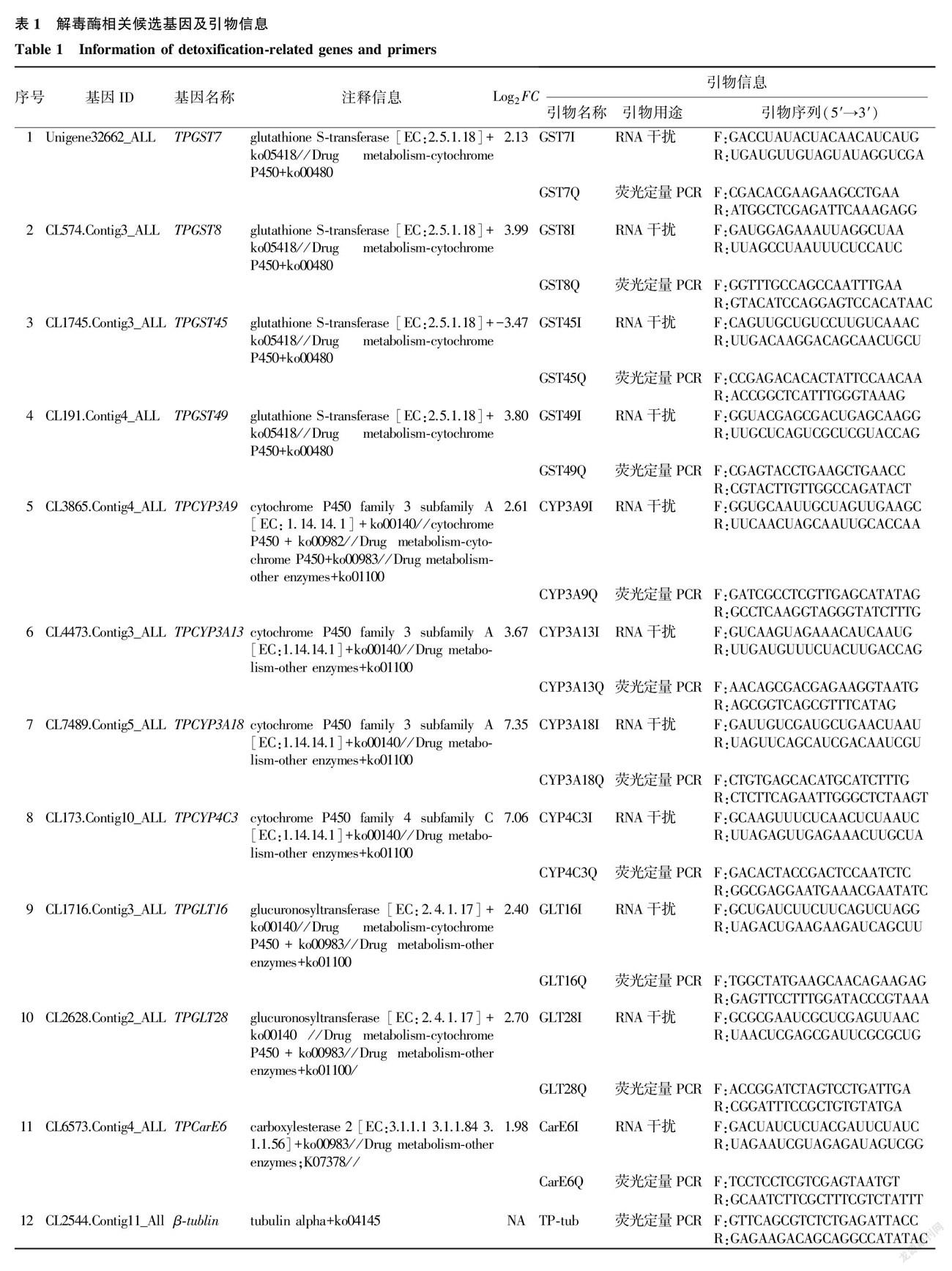
1.2.3 解毒代谢相关基因的鉴定 在转录组序列中搜索解毒代谢相关基因,以关键词谷胱甘肽 S 转移酶( GST )、细胞色素P450(P450)和羧酸酯酶( CarE )等进行搜索。筛选差异倍数大于4、FDR值< 0.01且被注释在Drug metabolism-cytochrome P450(ko01100、ko00983或ko00480等)通路或Drug metabolism-other enzymes(ko01100、ko00983、ko1049、ko7383或k15743等)通路或metabolism of xenobiotics by cytochrome P450(ko00980或ko00982)通路。根据NR的注释结果和KEGG通路的分析,过滤掉短片段和等位基因后,将拥有完整开放阅读框的基因序列作为进一步研究基因功能的候选序列 [2,4,14-15] 。
1.2.4 候选的解毒代谢相关基因的功能分析 通过siRNA诱导的RNA干扰来验证候选基因在腐食酪螨对阿维菌素抗性中的作用。siRNA序列利用在线工具(http://biodev.extra.cea.fr/DSIR/DSIR.html)设计,靶向序列为19个碱基,在RNA的3′端加dTdT垂悬(引物见表1) [14] 。siRNA合成由南京擎科生物科技有限公司完成,用Rnase-free水将siRNA引物稀释成100 μmol/L (1.0 μg/μl ),保存于-80 ℃ 冰箱备用。
参照文献[3]、[15]建立的饲喂法将siRNA导入腐食酪螨体内进行RNA沉默分析,这里我们将叶片换成香菇麦粒种,每个处理5粒麦粒种。60目过滤筛收集腐食酪螨成螨(3~ 5 d),然后用ddH2 O清洗4次后用250目纱网收集,吸干纱网上水分,转置2.0 ml的离心管中饥饿24 h。将100头成螨放入25 ml的养虫瓶,分别用500 ng/μl 、200 ng/μl 、50 ng/μl 和25 ng/μl 的siRNA进行基因沉默,带上盖子饲喂24 h后,采集螨虫样品用于RNA提取,随后RT-qPCR分析候选的解毒酶基因表达水平,分析最佳的siRNA饲喂剂量。重复 3 次,以ddH2 O处理的麦粒种饲喂的螨虫为对照。以腐食酪螨 β-tublin 基因为内参(引物见表1),一步法RT- qPCR反应条件为:逆转录42 ℃温育5 min,95 ℃ 10 s终止反应;PCR扩增:95 ℃预温育5 s后,60 ℃ 20 s,循环40次,熔解曲线65~ 95 ℃,每15 s升温0.3 ℃。采用 2 -△△ Ct 方法计算基因的相对表达量 [15] 。
阿维菌素母液用ddH2 O稀释成20.0 mg/L 、10.0 mg/L 、2.0 mg/L 、1.0 mg/L 和0.5 mg/L 5个质量浓度梯度备用,采用胃毒触杀联合毒力测定法处理腐食酪螨,具体操作方法同骆昕等 [3] 方法。处理组根据上述试验确定的最佳剂量siRNA分别饲喂腐食酪螨成螨24 h后,将100头转到含不同质量浓度阿维菌素药剂的养虫瓶内,24 h后观察腐食酪螨的死亡数量,每个siRNA处理重复3次,对照组为清水处理 [15] 。
1.3 数据分析
以上测得的数据采用Excel 2010 进行整理。单因素方差分析( one-way ANOVA) 和Student-Newman-Keuls (SNK) 检验后进行多重比较( P = 0.05),使用SPSS 21.0软件完成。毒力测定所得数据用Excel软件进行相关分析和回归分析,得出相关系数、毒力回归方程( Y =a x +b)、 LC 50 值及其95%置信区间。
2 结果与分析
2.1 腐食酪螨的转录组测序结果
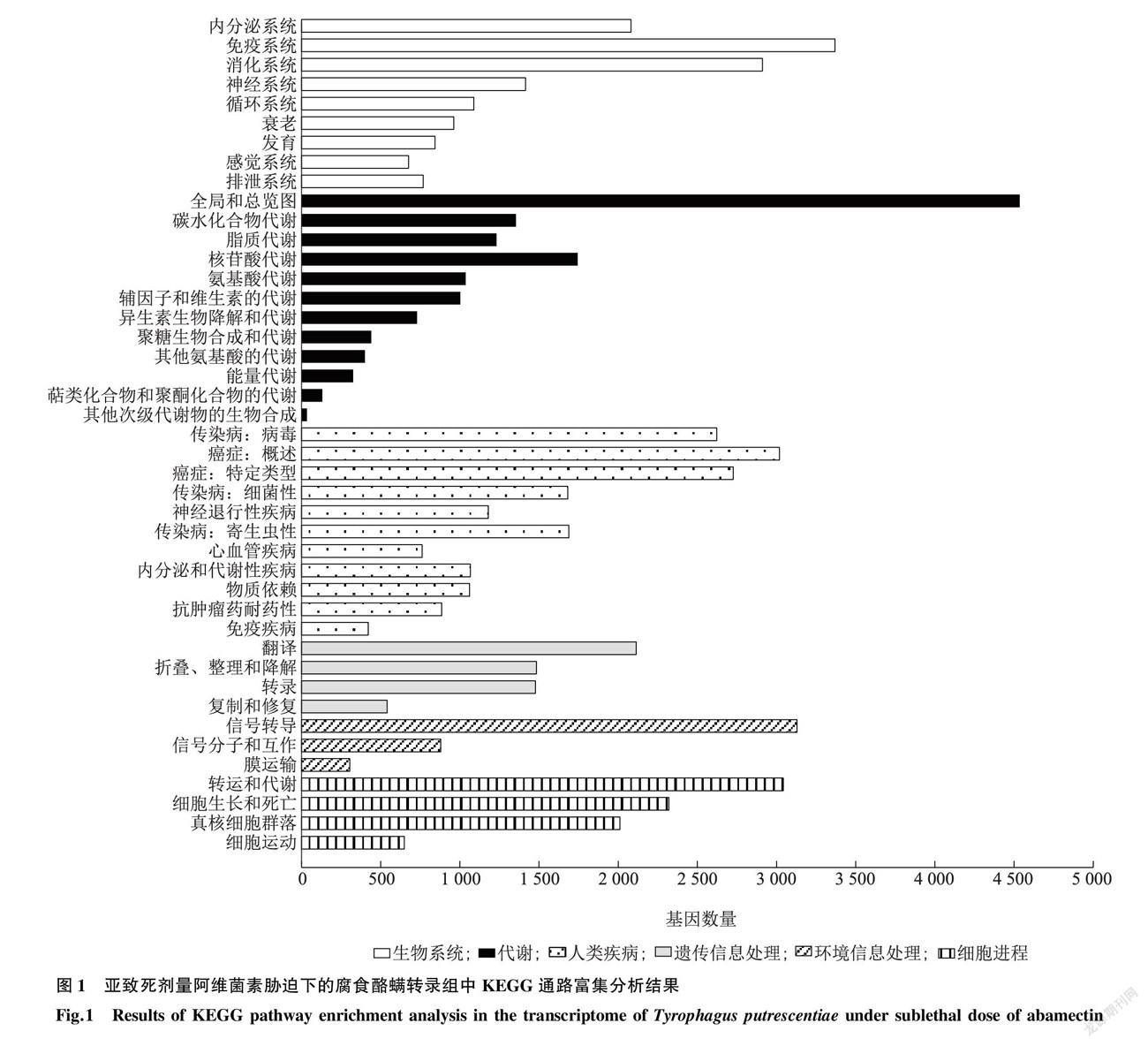
经测序质量控制,6个样品共得到37.25 Gb数据,组装并去掉冗余后得到62 268 个Unigene,总度、平均度、50% contig总长度(N50)以及G+C含量分别为82 154 640 bp、1 319 bp、2 360 bp和48.36%。然后将Unigene比对到七大功能数据库进行注释,最终分别有37 332 (NR:59.95%)、22 143 (NT:35.56%)、29 589 (SwissProt:47.52%)、28 621 (KOG:45.96%)、29 636 (KEGG:47.59%)、13 224 (GO:21.24%)以及33 530 (Pfam:53.85%)个Unigene获得功能注释。使用Transdecoder检测出38 791 个蛋白质编码序列(Coding sequence,CDS)。使用DESeq2进行对照组与处理组间的差异表达分析,将 Fold Change ≥2 或≤-2且 FDR < 0.01 作为筛选标准,统计分析所得的差异基因数量,共鉴定出差异基因14 435 个,其中上调表达1 188 个,下调表达13 247 个。进一步对差异表达基因进行聚类分析,KEGG Pathway富集分析结果显示,亚致死剂量阿维菌素处理腐食酪螨后,差异基因在信号传导、免疫系统、内分泌系统、药物代谢和传染性疾病相关通路富集(图1)。GO 富集分析发现受阿维菌素胁迫后腐食酪螨在涉及结合、催化活性、细胞过程、新陈代谢过程、ATP结合、解旋酶活性等生物过程、细胞组分和分子功能组中大量富集(图2),有138个差异表达的基因被注释到解毒代谢中。
2.2 腐食酪螨转录组中解毒代谢相关基因分析
通过比对GO、KEGG和KOG数据库注释的序列,在亚致死剂量阿维菌素胁迫下腐食酪螨转录组中发现73个谷胱甘肽 S 转移酶( GST )unigene、296个细胞色素P450(P450)unigene和97个羧酸酯酶( CarE )unigene等解毒代谢相关基因。过滤掉短片段、等位基因后,共鉴定到30个 GST unigene,全部与Drug metabolism-cytochrome P450通路、metabolism of xenobiotics by cytochrome P450通路有關且具有完整的ORF;鉴定到114个P450 unigene,其中22个P450 unigene与Drug metabolism-cytochrome P450通路相关,18个P450 unigene与Drug metabolism-other enzymes通路相关,24个P450 unigene与metabolism of xenobiotics by cytochrome P450通路相关。根据KOG注释结果,对P450 unigene进行分类,其中46个unigene属于Cytochrome P450 CYP3/CYP5/CYP6/CYP9 subfamilies(KOG0158),13个unigene属于Cytochrome P450 CYP4/CYP19/CYP26 subfamilies(KOG0157);鉴定到68个 CarE unigene,其中6个 CarE unigene与Drug metabolism-other enzymes通路有关。
解毒代谢相关基因中鉴定到的P450基因数和羧酸酯酶基因数分别占3种解毒酶基因的 53.8%和32.1%,远多于谷胱甘肽 S -转移酶基因的数量,说明这2类解毒酶在腐食酪螨解毒代谢过程中有着极其重要的地位。
2.3 候选的解毒代谢相关基因的功能分析
从上述鉴定到的解毒代谢相关基因中筛选差异倍数大于4、FDR<0.01且被注释在Drug metabolism-cytochrome P450通路或Drug metabolism-other enzymes通路或metabolism of xenobiotics by cytochrome P450的基因作为候选基因(表1),用于进一步研究其在腐食酪螨对阿维菌素抗性的作用。
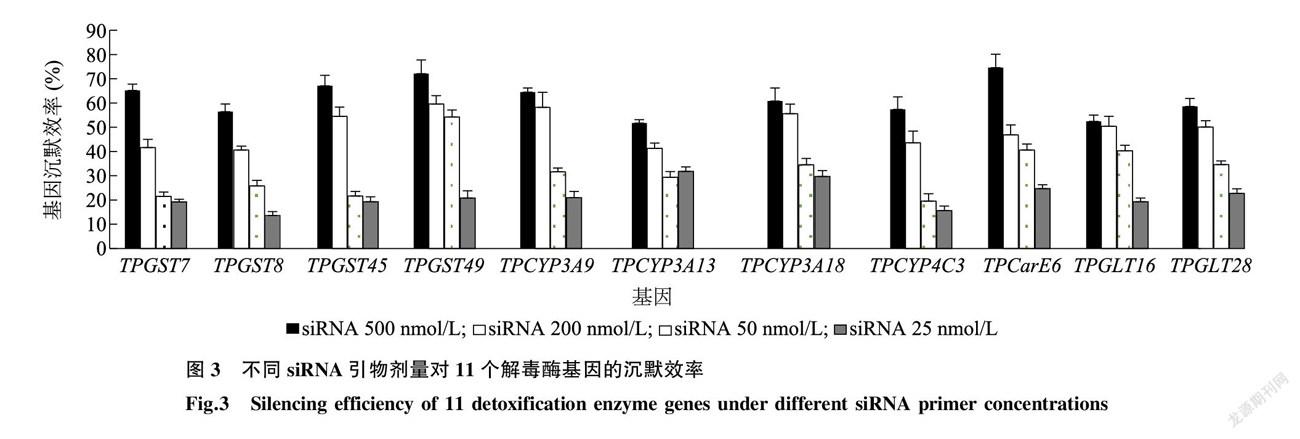
腐食酪螨对阿维菌素抗性相关的11个基因包括4个 GST 家族基因(TPGST7、TPGST8、TPGST45和TPGST49)、4个P450家族基因(TPCYP3A9、TPCYP3A13、TPCYP3A18和TPCYP4C3)、1个羧酸酯酶基因(TPCarE6),2个葡萄糖醛酸转移酶( GLT )基因TPGLT16和TPGLT28,分别用siRNA引物干扰24 h后,进行沉默效率测定。
RT-qPCR结果表明,不同siRNA剂量饲喂腐食酪螨成螨均使靶标基因的表达量降低(图3),500 nmol/L siRNA可最高降低靶标基因表达量的74.6%,沉默效率在51.7%~ 74.6%,200 nmol/L 剂量对靶标基因的沉默效率在40.6%~ 58.2%,50 nmol/L 和25 nmol/L 剂量对靶标基因的沉默效率较低(19.2%~ 40.3%)。因此,选择500 nmol/L 剂量对靶标基因进行沉默。
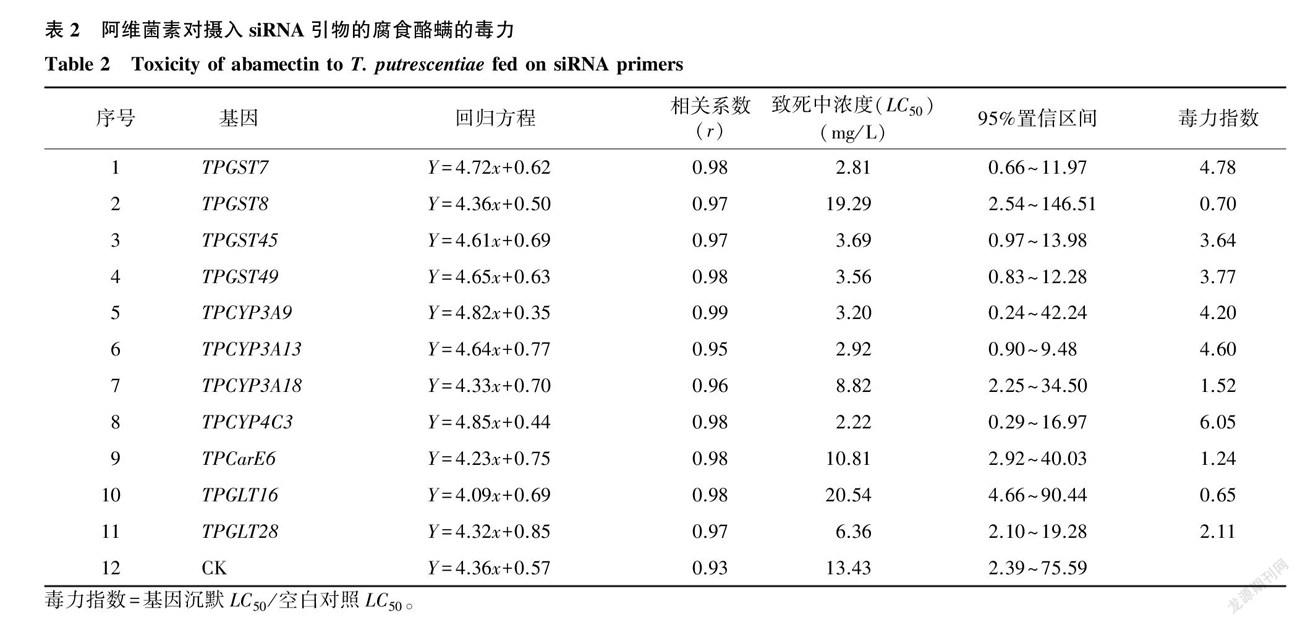
RNAi技术沉默差异表达的11个解毒代谢相关基因后,腐食酪螨对阿维菌素的敏感性也发生显著性变化(表2)。 GST 家族基因TPGST7、TPGST8、TPGST45和TPGST49沉默后,阿维菌素对腐食酪螨的致死中浓度(LC50 )从未干扰时的13.43 mg/L 最低下降到2.81 mg/L ,毒力指数分别为4.78、0.70、3.64和3.77;P450家族基因TPCYP3A9、TPCYP3A13、TPCYP3A18和TPCYP4C3沉默后,阿维菌素对腐食酪螨的LC50 最低下降到2.22 mg/L ,毒力指数分别为4.20、4.60、1.52和6.05;羧酸酯酶基因TPCarE6沉默后的毒力指数为1.24;2个 GLT 家族基因TPGLT16和TPGLT28沉默后的毒力指数分别为0.56和2.11。结果表明,沉默 GST 家族基因TPGST7、TPGST45和TPGST49,P450家族基因TPCYP3A9、TPCYP3A13和TPCYP4C3,以及 GLT 家族基因TPGLT28后,腐食酪螨对阿维菌素的敏感性提高,说明这些基因很可能参与了腐食酪螨对阿维菌素抗性的形成。
3 讨 论
阿维菌素是一种具有良好活性的杀虫杀螨剂,被广泛用于农业害虫、害螨以及卫生害虫的防治 [16-17] ,对其抗性机制研究是杀虫剂毒理学的热点之一 [7] 。目前,已证实P450家族中的CYP6、CYP9、CYP4基因是蚊虫产生阿维菌素抗性的重要因素 [18] ; GST 、P450、 CarE 等参与农业害虫对阿维菌素的代谢抗性 [6-8] ;果蝇和二斑叶螨的P-GP蛋白通过诱导几丁质合成酶降低阿维菌素的穿透性而增强抗性 [9] ;在害螨中,位于二斑叶螨中肠上层细胞的CYP392A16是阿维菌素抗性形成的主效基因,该基因也同样介导果蝇对阿维菌素的抗药性 [19] 。
有关腐食酪螨的抗药性研究较少,仅报道了腐食酪螨对磷化氢及多种常用的杀虫剂产生抗性,但其抗药性机理研究甚少 [1, 20] 。本研究对亚致死剂量阿维菌素胁迫下的腐食酪螨转录组进行了测序,获得了解毒代谢相关基因表达模式,鉴定到30个 GST 、114个P450和68个 CarE 基因,发现被注释到解读代谢通路上的4个 GST 、12个P450和3个 CarE 基因差异表达。利用siRNA介导的RNA干扰技术分析了沉默差异表达基因对阿维菌素毒力的影响,结果证实了 GST 家族中的TPGST7、TPGST45和TPGST49和P450家族中的TPCYP3A9、TPCYP3A13和TPCYP4C3在腐食酪螨对阿维菌素的抗性形成中起重要作用。其中,P450家族中的3个基因属于CYP3和CYP4基因家族。大量研究结果证明GST和P450家族基因参与杀虫剂的解毒代谢,这些基因的过表达是害虫和害螨产生对阿维菌素、吡虫啉、噻虫嗪和毒死蜱等不同杀虫剂交互抗性的重要因素 [21-22] 。此外,沉默葡萄糖醛酸转移酶( GLT )家族基因TPGLT28后,腐食酪螨对阿维菌素的敏感性提高,毒力指数为2.11,被证实也参与了腐食酪螨对阿维菌素抗性的形成,但這类家族基因的抗性作用机制目前尚未报道。本研究通过转录组和RNAi分析挖掘出参与腐食酪螨对阿维菌素抗性形成的重要基因,为今后解析腐食酪螨对阿维菌素抗药性机理提供了依据。
参考文献:
[1] 周 红,丁 伟. 螨类化学控制存在的问题及其对策[J]. 植物医生, 2020, 33(1):27-32.
[2] 周兴隆,杨顺义,李静静,等. 二斑叶螨多重抗性品系的选育及其解毒酶活力分析[J]. 西北农林科技大学学报(自然科学版), 2017, 45(6): 134-140.
[3] 骆 昕,曲绍轩,马 林,等. 六种杀螨剂对罗宾根螨和腐食酪螨的室内毒力测定[J]. 食用菌学报, 2018, 25(2):132-136.
[4] XU Z F, ZHU W Y, LIU Y C, et al. Analysis of insecticide resistance-related genes of the Carmine spider mite Tetranychus cinnabarinus based on a de novo assembled transcriptome[J]. PLoS One, 2014,9(5):e94779.
[5] 张 帅. 2020年全国农业有害生物抗药性监测结果及科学用药建议[J]. 中国植保导刊, 2021, 41(2): 71-78.
[6] 沈一凡,沈慧敏,岳秀利,等. 二斑叶螨抗阿维菌素品系选育及其解毒酶系活力变化[J].植物保护, 2014, 40(5): 44-48,74.
[7] 伍一军. 近二十年我国杀虫剂毒理学研究进展——昆虫对杀虫剂的抗性研究[J]. 应用昆虫学报, 2020, 57(5): 995-1008.
[8] KWON D H, YOON K S, CLARK J M, et al. A point mutation in aglutamate-gated chloride channel confers abamectin resistance in the two-spotted spider mite, Tetranychus urticae Koch[J]. Insect Molecular Biology, 2010, 19(4): 583-591.
[9] XU Z F, SHI L, PENG J F, et al. Analysis of the relationship between P-glycoprotein and abamectin resistance in Tetranychus cinnabarinus (Boisduval)[J]. Pesticide Biochemistry and Physiology, 2016, 129: 75-82.
[10] JEONG Y K, LEE H, LEE S J, et al. Molecular cloning and the allergenic characterization of tropomyosin from Tyrophagus putrescentiae [J]. Protein and Peptide Letters, 2007, 14: 431-436.
[11] KHERADMAND K, KAMALI K, FATHIPOUR Y, et al. Development, life table and thermal requirement of Tyrophagus putrescentiae (Astigmata: Acaridae) on mushrooms[J]. Journal of Stored Products Research, 2007, 43: 276-281.
[12] QU S X, LI H P, MA L, et al. Effects of different edible mushroom hosts on the development, reproduction and bacterial community of Tyrophagus putrescentiae (Schrank) [J]. Journal of Stored Products Research, 2015, 61: 70-75.
[13] QU S X, WANG X F, LI H P, et al. A Gustatory receptor used for rapid detection of Tyrophagus putrescentiae in fungi hosts[J]. Scientific Reports, 2018, 8(1): 11425.
[14] KENNERDELL J R, CARTHEW R W. Use of ds RNA-mediated genetic interference todemonstrate that frizzled and frizzled 2 act in the wingless pathway[J]. Cell, 1998, 95 (7): 1017-1026.
[15] 敖已倩云,申光茂,王夢瑶,等. 朱砂叶螨 β-COP和Sro 基因鉴定及其沉默致死效果[J].中国农业科学, 2017 ,50(18): 3529-3539.
[16] 林海蔚,韩慧霖,罗 茵,等. 阿维菌素B2a衍生物类皮雷菌素对草地贪夜蛾的室内毒力[J].南方农业学报,2020,51(6):1287-1292.
[17] 姚晶晶,陈丽君,王明锐,等. 西瓜中杀线虫剂农药残留及风险评估[J].江苏农业科学,2020,48(6):168-172.
[18] 彭 荟,刘宏美. 细胞色素P450介导蚊虫代谢抗性及防治应用的相关研究进展[J].中国热带医学, 2022, 22(1): 79-83.
[19] PAPAPOSTOLOU K M, RIGA M, SAMANTSIDIS G R, et al. Over-expression in cis of the midgut P450 CYP392A16 contributes to abamectin resistance in Tetranychus urticae [J]. Insect Biochemistry and Molecular Biology, 2022, 142: 103709.
[20] 剪福记. 储藏物螨类熏蒸防治方法研究状况及进展[J]. 粮食储藏, 1996, 25(3): 3-10.
[21] 朱 江,邱星辉. 昆虫抗药性相关细胞色素P450基因的表达调控机制[J]. 昆虫学报, 2021, 64(1): 109-120.
[22] SHEN J, LI Z, LI D, et al. Biochemical mechanisms, cross-resistance and stability of resistance to Metaflumizone in Plutella xylostella [J]. Insects, 2020, 11(5): 311.
(责任编辑:张震林)
收稿日期:2021-11-16
基金项目:财政部和农业农村部国家现代农业产业技术体系项目(CARS-20);国家自然科学青年基金项目(32001911);江苏省农业科技自主创新基金项目[CX(21)2021]
作者简介:曲绍轩(1982-),女,辽宁大连人,博士,副研究员,主要从事食用菌有害生物防治研究。(Tel)025-84390159;(E-mail)qusx@jaas.ac.cn
通讯作者:马 林,(E-mail)malin1590@sina.com
