斑马鱼黑色素瘤模型研究进展
2022-07-15刘诗成张瑞唐景峰陈兴珍
刘诗成,张瑞,唐景峰*,陈兴珍*
(1. 湖北工业大学生物工程与食品学院,武汉 430068;2. 湖北工业大学科技部/教育部细胞调控与分子药物“111”引智基地,武汉 430068)
斑马鱼(Danio rerio)是生活在印度和南亚的热带淡水鱼,成年野生型雄性斑马鱼身体细长,雌性斑马鱼腹部有微微隆起,长度3 ~6 cm,背部有深色条纹纵横类似斑马,寿命约为3 ~5 年。 斑马鱼具有其他模式动物(如小鼠)所不具备的天然优势,例如体外授精、体外发育、性成熟快、繁殖力强及饲养成本低。 斑马鱼最独特的优势是斑马鱼胚胎发育在体外进行,早期胚体透明,适用于整体成像和实时活体观察[1]。
斑马鱼在生命科学研究领域发挥着越来越明显的作用,因为其基因组与人类基因组有着高度同源性,在调控疾病的一些信号通路高度保守,在血液、视觉、神经系统等方面与人类有着相似的机制[2-4]。 使得其本身可以作为模式生物应用于大部分人类的生态和疾病研究。 同时,因为现阶段各种针对性基因下调技术或者敲除技术的发展,更高效的异种移植技术,极大程度地推进了斑马鱼在各种疾病机制与病理上的研究进度。
恶性黑色素瘤是较为常见的恶性皮肤癌的一种,是目前全球增速最快的恶性肿瘤,且具有高度转移性以及强致死性。 它们遍布全身,通常存在于皮肤中,部分还可渗透进葡萄膜,脑膜和粘膜组织等组织[5]。 中国黑色素瘤患者在不断增多且呈年轻化,5 年生存率仅为65%,远低于欧美发达国家的80%。 目前对于黑色素瘤的治疗主要还是外科手术,早期黑色素瘤患者经过手术治疗可以获得较好的控制[6]。 然而,近几十年来对中晚期黑色素瘤的治疗尚未有效果明显的治疗方法。 除大剂量注射IL-2 和达卡巴嗪以外,世界各国还未批准过任何一种新药用于晚期黑色素瘤患者的治疗。 黑色素瘤发生受到多种基因的调控,比如黑色素细胞诱导转录因 子 (melanocyte inducing transcription factor,Mitf)、B-Raf 原癌基因(B-Raf proto-oncogene,serine/threonine kinase,BRAF)、细胞质多聚腺苷酸化原件结合蛋白4 (cytoplasmic polyadenylation element binding protein 4,CPEB4)等[7]。 黑色素瘤极易发生转移,初期进入到皮下组织。 之后色素瘤细胞会通过血管系统和淋巴系统扩散至继发部位[8]。
当前,利用斑马鱼模型研究黑色素肿瘤,有一系列的报道。
1 斑马鱼作为动物模型研究黑色素瘤的优势
目前常用的模式生物有果蝇、酵母、小鼠、斑马鱼等。 黑色素瘤是皮肤癌的一种,黑色素前体细胞的胚胎发育在小鼠上高度保守,这使得小鼠更适合模拟人黑色素瘤的病理特征。 目前主要是小鼠黑色素瘤模型,通常是将黑色素瘤细胞注入裸鼠体内来观察成瘤情况。 恶性黑色素瘤的高转移性一直是棘手的问题,肿瘤的转移以及微环境间的相互作用对肿瘤的治疗有着很大的影响,小鼠模型在实时追踪肿瘤以及观测微环境变化这一方面还是有一定的限制[9-10]。
斑马鱼作为在机体内研究黑色素肿瘤发生和发展的模型具有独特的优势。 斑马鱼与人类黑色素细胞相关的信号通路高度保守,透明的转基因斑马鱼可以应用活体成像帮助我们更好的观察体内的黑色细胞变化。 斑马鱼和哺乳动物的黑色素细胞高度相似。 在这两个类群中,黑色素细胞前体(黑素母细胞,起源于背部的神经嵴细胞的一个子集)迁移到它们在动物皮中的最终目的地。 调节黑素细胞的规格,增殖,存活,迁移。 参与分化成黑素细胞这一过程的蛋白质在序列和功能上高度保守。恶性黑色素瘤的发生和转移,涉及到Ras/Raf/MEK/ERK(MAPK)和PI3K/AKT 多种信号通路的调控,斑马鱼为这类研究提供了一个可靠的载体[11]。
斑马鱼作为黑色素瘤的模式生物,在黑色素瘤的相关调控途径中与哺乳动物具有高度同源性,例如小眼症相关转录因子 Mitf。 Raf/Ras/PI3K-AKT等多种黑色素瘤发生相关信号通路高度保守[12]。相较于小鼠模型,斑马鱼因其通体透明可以更好地观察色素的沉积,血管内的细胞流动,同时也可以实时观察黑色素瘤的转移,这一直是肿瘤研究的热点。 并且早期的胚胎没有成熟的自体免疫系统,可通过异种移植肿瘤,达成更快的成瘤速度,使得用更短的实验周期来检测药物效果。 同时斑马鱼所需要的实验面积相较于小鼠需要的更少,以及遗传易操作性等多方面优势使得斑马鱼模型为疾病的研究提供了更好的帮助。
2 斑马鱼黑色素瘤模型的建立
当前,已利用斑马鱼模型建立了多种人类疾病模型(图1)[9,13]。 科学家已开发出多种实验技术以建立斑马鱼黑色素瘤模型。 主要方法包括化学诱变方法,利用基因编辑技术构建特异的转基因模型和异种移植的方法。
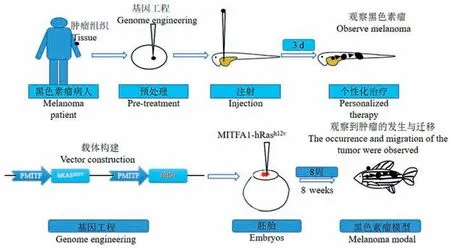
图1 斑马鱼黑色素瘤模型的建立流程图Figure 1 Flow chart of zebrafish melanoma model
2.1 异种移植斑马鱼模型的建立
斑马鱼在早期的时候尚未形成成熟的免疫系统,肿瘤异种移植的成功率较高,利用这个优势可以在短时间内让斑马鱼获得人类肿瘤细胞,模拟肿瘤在体内环境的“运动”。 运用斑马鱼异种移植模型可以在初期对药物进行筛选,同时可以利用这个特点来观察肿瘤细胞的转移。
Casper 品系的斑马鱼敲除了线粒体内膜蛋白(mitochondrial inner membrane protein,ROY)和黑色素细胞诱导转录因子( melanocyte inducing transcription factor a,NACRE),使其色素生成能力缺失[14],通体透明,易于观察。 Zhang 等[15]基于转基因技术使黑色素瘤细胞系与基因敲除的透明斑马鱼相结合,将斑马鱼特异性黑色素瘤细胞系(ZMEL1-GFP)通过不同部位注射入Casper 斑马鱼体内,观察黑色素瘤与脂肪细胞相关作用。
建立斑马鱼异种移植模型,可以将荧光标记好的人类转移性黑色素瘤细胞移植到囊胚期斑马鱼卵黄囊中。 移植的卵细胞表现出存活,增殖,运动性,能够分裂但不发展肿瘤,也没有整合进入器官。细胞散布在整个囊胚的间隙中,通常被定义为原发肿瘤细胞。 之前有发现一种从在牛肝菌蘑菇中提取出的新型凝集素(boletus edulis lectin β-trefoil,BEL β-Trefoil)存在着抗肿瘤的作用,为了研究BEL β-Trefoil 对黑素瘤迁移能力的影响,Valenti 等[16]在胚胎受精2 d 后用Tricaine(三卡因)麻醉,将培养好的肿瘤细胞与BEL β-Trefoil 孵育,后经显微注射技术,注射到麻醉后的斑马鱼幼虫卵黄囊中,在不同的注射时间后观察,发现BEL β-Trefoil 可以有效地降低黑素瘤在斑马鱼体内的扩散和转移。 Ogryzko等[17]建立斑马鱼异种移植黑色素瘤模型,使用电脑软件在斑马鱼体内对黑色素瘤细胞与巨噬细胞之间的相互作用进行成像处理,发现了巨噬细胞会与黑色素瘤相互作用,通过血管内运输,从而转移到更远的地方。
斑马鱼的适宜温度为28℃,而肿瘤细胞的适宜温度为37℃。 这种差异使得异种移植技术不能长久的观察肿瘤细胞变化,肿瘤细胞生长受到影响。最近新发现了1 种敲除了DNA 依赖性蛋白激酶的催化亚基 (protein kinase,DNA-activated,catalytic subuni,PRKDC)和白细胞介素 2 受体(interleukin 2 receptor,gamma a,il2rga)的斑马鱼模型[18],可以让斑马鱼适应人体温度37℃,并利用该模型结合Casper 鱼系。 直接从患者处得到肿瘤细胞,在斑马鱼体内观察生长发育的研究,为个性化治疗提供一种有效思路。
2.2 斑马鱼黑色素瘤转基因模型的建立
在斑马鱼中,有两个Mitf 基因(Mitfa 和Mitfb),Mitfa 对于神经C 衍生的黑素细胞的发育至关重要。基于转基因技术,将特异性黑色素瘤细胞系与基因敲除的透明斑马鱼相结合,Kim 等[19]建立了一个由神经特异性Mitfa 启动子驱动的人BRAFV600E基因,并融合荧光蛋白的转基因斑马鱼品系,从而获得了带绿色荧光标记的斑马鱼特异性黑色素瘤细胞系——ZMEL1-GFP。 将 ZMEL1-GFP 癌细胞注射到斑马鱼体内。 21 dpf,100%的局部植入的皮肤肿瘤出现色素异常堆积,黑色素瘤出现转移并表现出了分化特征[19]。 绿色荧光追踪了黑色素瘤的转移,肿瘤色素沉积的表型标志了黑素瘤的分化,利用该模型可以实时观察肿瘤转移过程中的分化状态,帮助我们更好的认识黑色素瘤细胞在机体内迁移的过程,因此,此模型可以更好的帮助医疗人员了解疾病发生的进程。 在人类黑色素瘤细胞中经常发现BRAF 和 NRAS 的 激 活 突 变。 Mitfa 驱 动 的NRASQ61K,在P53 缺失的情况下,也可以稳定的观察到黑色素瘤的生成。 Kita 在发育中的黑素细胞组细胞中表达, 在 Kita 启动子下表达致癌基因HRASG12V。 2 ~4 周后黑色素细胞在尾部积累,并逐渐形成黑色素瘤[13]。 目前使用的各种斑马鱼黑色素瘤模型都与人类黑素瘤模型有一定的相似性,都在黑色素瘤的研究中取得了一定的进展。 对比各个模型发现影响黑色素瘤的更高的渗透率和更早的发作可能是由于癌基因表达的水平和持续性,而不是由于Kita 和Mitfa 两个启动子的细胞特异性不同。 Scahill 等[20]发现7 个月大的赖氨酸(K)特异性脱甲基酶2Aa(lysine(K)-specific demethylase 2Aa,kdm2aa)缺陷型的鱼可以生成肿瘤,同时发现了黑色素细胞的异常沉积,也是目前发现的第1 个单基因敲除的黑色素瘤动物模型。
3 斑马鱼在黑色素瘤研究中的应用
3.1 黑色素瘤药物安全性评价模型
斑马鱼因其体型小,胚胎透明,一次繁殖可以多达几百条。 同时斑马鱼和哺乳动物在药物毒性评估上具有高度一致性[21]。 这些优势使得斑马鱼可以在多孔板内进行高通量的药物安全性测试,测试各种药物浓度的危险范围及其可能的副作用,一方面可以检查药物对动物发育表型的不利影响,另一方面通过荧光显微镜观察肿瘤的动态。 根据各种药物的性质不同,给药方式可以采用水溶,卵黄注射或血液循环注射等方式。 一般来说,判断药物毒性可以通过观察心跳变化,生长发育变化等方法。
Fisetin 是一种膳食类黄酮,在抗关节炎和抗癌活性都有一定的作用,为了探究Fisetin 对黑色素细胞的作用,使用24 hpf 的斑马鱼,用不同浓度的Fisetin 进行处理,同时用立体显微镜观察幼虫的体形与心率,算出每组的每分钟平均心跳数,可以发现心率与对照组无差,但同时黑色素细胞有增多。再用FH535(WNT/β-catenin 抑制剂)处理后加入Fisetin 发现FH535 显著下调了Fisetin 诱导的斑马鱼幼虫中黑色素的生成,同样无明显心脏变化。 证实了Fisetin 可以在没有毒性的情况下作用于Gsk-3β,抑制其活性,阻断对于β-catenin 的降解,来促进斑马鱼幼虫黑色素的生成[22]。 荜茇酰胺(piperlongumine,PL),一种天然生物碱,可以通过增加活性氧水平,来选择性杀死癌细胞。 对6 hpf 的斑马鱼胚胎进行了不同浓度的药物处理,虽然PL 在一定程度上对斑马鱼胚胎黑色素产生有抑制作用,可高浓度的PL 使斑马鱼幼虫有明显的脊柱弯曲,PL 表现出了极大的发育毒性[23],高通量的斑马鱼药物筛选实验大大提高了人类药物的安全性。
传统的肿瘤药物往往带有强烈的副作用,药物到达患病处也会受到多种生物学阻碍[24]。 纳米治疗技术的发展,可以将药物靶向到患病部位,减少药物副作用,这将对癌症治疗提供更高效安全的方法。 斑马鱼模型的无创实时成像技术将为这项技术提供一个很好的帮助。 Kocere 等[25]验证了载药纳米颗粒在斑马鱼体内的功能。 在显微镜下可以看到斑马鱼体内纳米颗粒协助药物聚集到了血管周围的肿瘤区域,并有效减少了癌细胞的增殖与凋亡,保证了更高的存活率,大大降低了肿瘤药物的毒性。
针对不同的药物,要采取不同的给药方式,以达到最好的效果。 TLD1433 化合物作为光敏剂可以治疗结膜黑色素细胞[26],使用3 种不同的给药方式:水溶暴露、静脉注射和眼后注射,观察各个部位的最大耐受剂量,同时在高剂量下评判该药物的治疗效果,发现在经眼后注射中,该药物对眼部的异位肿瘤有着明显的抑制作用。 硫磺粉菌凝集素(laetiporus sulphureus lectin,LSL)被发现广泛存在于传统药物中,与其同类型的乙醇提取物(ethanol extract,LSE)共同作用能有效抑制肿瘤生长发育,为了验证LSL 的发育毒性,将6 hpf 的斑马鱼胚胎暴露在不同浓度的LSL 和LSE 中,120 hpf 后检查存活胚胎的心率无异常,在400 mg/mL 的高剂量下仍没有诱导出毒性。 目前,骨髓抑制和中性粒细胞减少是目前多数抗癌药会让患者引起的副作用。 使用转基因型斑马鱼胚胎Tg(mpx:GFP)进行了LSL 和LSE 的骨髓毒性评测,处理后使用荧光显微镜观察,相较于目前市面上的一些抗肿瘤药物,没有发现中性粒细胞减少等副作用,证实了LSL 和LSE 不是影响中性粒细胞减少的原因,证明了LSL 和LSE 无毒性[27],为LSL 用作抗黑色素瘤的安全佐药作出了一定贡献。
3.2 黑色素瘤生成机制的研究
Mitf 是黑色素瘤整个调节网络的中心位置[28],且Mitfa 是黑色素存活和分化的主要调节因子。 同时Mitf 影响了多条黑色素瘤相关的信号通路,例如bmp 信号通路的抑制会影响到Mitfa 表达,导致黑色素细胞的降低[29]。 之前也有发现低Mitf 活性加上P53 突变可以导致黑素瘤的发生[30]。 Santoriello等[31]在斑马鱼珍珠母突变型(Mitfa-/-)中培养了Kita-GFP-Ras 鱼系,9 个月后观察到没有黑素瘤的形成。 足以发现Mitfa 表达对于黑素细胞存活的重要性,而致癌因子HRASV12的突变不足以使黑色素瘤生成。 Lister 等[32]使用条件性Mitfa 温度敏感的斑马鱼突变体(Mitfavrc7)模型揭示了Mitf 在黑素瘤中的作用,该模型会因为温度的不同调节体内Mitf的活性,通过控温将温度控制在32℃时关闭Mitfa活性发现黑素瘤消退,但在将水温重新调回到26℃以下时,黑色素瘤仍旧会出现,这一现象表明靶向Mitf 活性可能是一种有效的抗黑色素瘤机制。Taylor 等[33]用色素作为标记,从胚胎头部观察黑色素细胞的发育。 再结合热敏感斑马鱼突变体Mitfavrc7,观察斑马鱼胚胎发育出黑色素细胞后追踪不同的Mitf 活性下的斑马鱼黑色素细胞分化生长,发现Mitf 的活性变化可以使黑色素细胞分裂的增加,进一步说明了Mitf 在黑色素瘤中的重要地位。
BRAF 作为Raf 家族中的一员,有超过80%的黑色素瘤患者存在 BRAF 或 RAS 突变[13],且在MAPK 信号通路中有着一定的影响。 从数据上看,很大一部分黑色素瘤患者有发生BRAFv600E的突变[34]。 目前,针对BRAF 突变患者的治疗也是以抑制MAPK 和BRAF 为主,尽管有很好的效果,但耐药性的发展使得效果不持久也一直是研究的重点。Das 等[35]发现AXL 受体酪氨酸激酶(AXL receptor tyrosine kinase,AXL)和细胞质膜小凹蛋白(caveolin-1,CAV-1)与蛋白耐药性有关,同时受到 TH1579(MTH1 抑制剂)的影响。 利用斑马鱼异种移植模型,观察药物联合TH1579 可以有效增强对黑素瘤的抑制作用,为药物治疗的耐药性提供了一种解决方案。
3.3 黑色素瘤转移机制的研究
黑色素瘤是皮肤癌中转移能力较强的一种,其高致死性也是因为转移所导致的。 肿瘤的转移通常包括了血管内,淋巴道等途径,恶性黑色素瘤常常表现出较强的血管倾向性[36]。 转移性黑色素瘤的患者治愈后存活率低,癌症的转移问题也一直是国内癌症研究的热点。 斑马鱼被认为是最好的观察肿瘤转移过程的模式生物,因为其体态透明。 利用斑马鱼黑色素瘤模型可以很好的在显微镜下实时观察到肿瘤由原发到继发的整个转移过程,这在小鼠肿瘤模型中很难办到,大量的数据可以更直观的评估肿瘤转移的能力。 为了评估细胞的扩散,通常将分散在整个鱼体内的细胞被定义为转移细胞,而聚集在注射部位卵黄囊间隙的细胞为非转移细胞。 利用斑马鱼模型可以更好的揭示肿瘤转移方式,帮助我们更好的研究肿瘤运动。
将BEL β-Trefoil 与肿瘤细胞一同注射到斑马鱼体内明显可以看到对细胞扩散和转移形成有一定的抑制作用[16],最后,通过分析总的RNA 水平,以及 RUNX 家族转录因子 2 ( RUNX family transcription factor 2,RUNX2)的表达水平,发现BEL β-Trefoil 可以通过抑制 RUNX2(其 Hunt 结构域与黑色素瘤的增殖和迁移有关)来达到抑制肿瘤细胞扩散转移的作用[37-38]。
丝氨酸肽酶抑制剂(serine peptidase inhibitor,Kunitz type 1,Spint1)突变存在于10%的皮肤黑色素瘤患者中。 用 Spint1ahi2217/hi2217的母鱼[39]分别与Spint1a+/+(野生型)和Spint1ahi2217/hi2217的公鱼杂交,对比与野生型杂交,发现Spint1 缺陷型会显著增加皮肤黑色素瘤的发生率,对成年斑马鱼注射Spint1a缺失的皮肤黑色素瘤细胞也能观察到更强的侵袭性。 用斑马鱼模型揭示了 Spint1 对黑素瘤的调节[34]。 Bcl-2 家族中的Bcl-xl 是一种常见的抗凋亡蛋白。 有研究指出葡萄膜黑色素瘤细胞逃避治疗诱导的凋亡的主要手段之一是通过上调生存Bcl-2家族蛋白中的 Bcl-Xl[40-41]。 除了抗凋亡外,Gabellini 等[42]还发现Bcl-xl 可以调节肿瘤转移的过程,通过NF-κB 途径来影响白细胞介素-8(C-X-C motif chemokine ligand 8,CXCL8)的分泌,CXCL8 可以通过激活CXCR1 与CXCR2 受体来影响黑色素瘤的进展,将稳定表达Bcl-xl 蛋白的黑色素细胞异种移植到斑马鱼卵黄囊中,对比干扰CXCL8 细胞表面受体CXCR1,发现在干扰CXCR1 后斑马鱼黑色素瘤未发生明显侵袭,说明Bcl-xl 调控肿瘤侵袭依赖CXCL8 的分泌,进一步揭示了Bcl-xl 调控黑色素瘤转移机制。
4 总结与展望
目前,已利用斑马鱼建立了多种黑色素瘤模型用于相关的研究。 近年来,更多的研究定位于通过可视化的斑马鱼体内,观察肿瘤形成与治疗,同时随着新型转基因型斑马鱼模型的出现,给人类移植细胞提供了一个合适的观察场所。 同时,斑马鱼作为黑色素瘤模型,基因编辑后的成年鱼也能保持全身透明,便于观察。 纳米治疗技术的发展,可以靶向到患病部位,更好的减少药物副作用,这将对癌症治疗提供更有效更安全的方法,斑马鱼模型的无创实时成像技术将为这项技术提供一个很好的帮助。 相信随着科学进步,斑马鱼的应用将会更多的被开发,也将为疾病的解决提供更多的可能性。