草地贪夜蛾核型多角体病毒对我国草地贪夜蛾不同地理种群毒力的比较分析
2022-07-14程露强靳雯怡方分分陈新中秦启联徐建祥
程露强,靳雯怡,郭 琳,方分分,陈新中,秦启联,徐建祥,张 寰*
(1. 扬州大学园艺与植物保护学院,江苏扬州 225009;2. 中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室,北京 100101;3. 河南济源白云实业有限公司,河南济源 454652;4. 河北大学生命科学学院,河北保定 071002)
草地贪夜蛾Spodopterafrugiperda(J.E. Smith)原产美洲热带和亚热带地区,在巴西造成玉米ZeamaysL.减产34%,年损失40亿美元(Jingetal., 2020)。自2018年底至2020年8月31日,在全国27个省1 338个县(全国农技推广网, 2020)发现草地贪夜蛾,对我国玉米等农作物构成严重威胁。由于对寄主植物的偏好不同,草地贪夜蛾在原发地分化为玉米型和水稻型。目前,分子标记是鉴定草地贪夜蛾不同亚型的主要手段,其中来自于线粒体的细胞色素C氧化酶亚基Ⅰ基因(cytochrome c oxidase subunit Ⅰ,COI)以及位于Z染色体上的磷酸丙糖异构酶基因(triose-phosphate isomerase,Tpi)是最常用且最成熟的标记基因(张磊等, 2019)。
草地贪夜蛾核多角体病毒Spodopterafrugiperdamultiplenucleopolyhedrovirus(SfMNPV)专一性侵染草地贪夜蛾,制成病毒杀虫剂后,具有无污染、环境友好、持效性长等优点,是化学防治的良好补充。迄今为止,国内外已从不同地区的草地贪夜蛾中分离到多个SfMNPV毒株,虽然这些毒株核苷酸序列相似性高达99.35%(Arive, 2014),但这些分离株对草地贪夜蛾的毒力和感染宿主后的表型往往存在较大差异。例如,SfMNPV-6nd毒株不会引起宿主表皮液化,与高毒力毒株SfMNPV-19相比,两毒株的LC50差异不显著,但SfMNPV-6nd杀死2龄幼虫所需的时间长于SfMNPV-19(Vieiraetal., 2012)。此外,不同种群草地贪夜蛾对同一SfMNPV毒株的敏感性也不同。例如,生物测定法评价SfMNPV对玉米型和水稻型草地贪夜蛾幼虫毒力的结果表明,玉米型和水稻型草地贪夜蛾对SfMNPV表现出不同的敏感性水平(Pophametal., 2021)。这一现象在家蚕Bombyxmori与家蚕核型多角体病毒Bombyxmorinucleopolyhedrovirus(BmNPV)(张远能等, 1982; 陈克平等, 1991)、甜菜夜蛾Spotopteraexigua与甜菜夜蛾核型多角体病毒Spotopteraexiguamultiplenucleopolyhedrovirus(SeMNPV)(李广宏等, 2006)、茶尺蠖Ectropisobliqua与茶尺蠖核型多角体病毒Ectropisobliquanucleopolyhedrovirus(EoNPV)(席羽等, 2011)等其它鳞翅目昆虫在与杆状病毒的互作中也有发现和报道。
昆虫消化道是一个复杂的微环境,包括食物、肠液以及肠道微生物菌群。核型多角体病毒(nucleopolyhedrovirus,NPV)只有在鳞翅目昆虫中肠的碱性环境和蛋白酶的作用下,才能解离和释放包涵体来源型病毒粒子(occlusion-derived virion,ODV)(Slacketal., 2006; Rohrmann, 2019)。因此,肠道微环境对宿主感染NPV有一定影响。殷灿(2014)发现,随着溶剂pH升高,美国白蛾核型多角体病毒Hyphantriacuneanucleopolyhedrovirus(HcNPV)包涵体(occlusion bodies,OBs)杀死宿主的时间(LT50)逐渐缩短,提示HcNPV包涵体的解离对宿主美国白蛾Hyphantriacunea感染速度和致病力均有影响。另有研究发现,沃尔巴克氏菌Wolbachia可以提高甜菜夜蛾对SeMNPV的敏感性(Grahametal., 2012)。SeMNPV感染增加了甜菜夜蛾幼虫的肠道菌群负荷,增强了病毒的毒力和致病性(Jakubowskaetal., 2013),提示宿主的中肠微生物种类可影响宿主对NPV感染的敏感性。本文首先测定了我国4个地理种群草地贪夜蛾的基因型,随后探讨了不同地理种群草地贪夜蛾肠道微环境对其对SfMNPV的敏感性的影响。
1 材料与方法
1.1 实验材料
1.1.1供试昆虫
云南德宏、广东广州种群由中国科学院动物研究所昆虫病毒组提供,广西钦州、西藏林芝种群由中国农业大学昆虫生理生化与毒理实验室高希武教授提供,上述4个种群在河南济源白云实业有限公司建立草地贪夜蛾种群,使用人工饲料在25℃饲养。
1.1.2供试病毒
供试病毒毒株于2019年从云南德宏州玉米田采集的草地贪夜蛾幼虫病死虫尸中分离,经纯化、测序,鉴定为SfMNPV,命名为SfMNPV-KYc01,现保藏于中国科学院动物研究所昆虫病毒组,在济源白云实业有限公司保种并用于生物测定。
1.2 实验方法
1.2.1草地贪夜蛾种群遗传多样性鉴定
分别收集建立室内种群4个种群的草地贪夜蛾6龄幼虫各3头的血细胞,分别提取DNA用于PCR反应,使用PrimeSTAR©Max DNA Polymerase(Takara,货号:R45Q)进行PCR扩增,使用COI引物(5′-TTCGAGCTGAATTAGGGACTC-3′;5′-GATGTAAAATATGCTCGTGT-3′)和Tpi引物(5′-GGTGAAATCTCCCCTGCTATG-3′;5′-AATTTTATTA CCTGCTGTGG-3′)(张磊等, 2019),每个PCR使用50 μL反应体系,含PrimeSTAR Max (2×) 25 μL,20 pmol引物和70 ng细胞DNA模板。PCR扩增反应条件为在94℃初始变性2 min后,98℃ 10 s,55℃ 5 s,72℃ 5 s进行35个循环,最后一个循环进行68℃延伸5 min。所得产物用1%琼脂糖凝胶电泳检测,将电泳呈阳性的PCR产物送至华大基因公司测序。
1.2.2生物测定
SfMNPV多角体使用血球计数板计数后,使用浓度梯度稀释为以下5个浓度:1.28×107、2.56×107、5.12×107、1.024×108、2.048×108OBs/mL。
15孔板养虫盒提前倒入融化的饲料,制作饲料平板,加入100 μL稀释好的病毒液,空白对照加等量无菌去离子水,涂布均匀,再用已消毒的镊子将草地贪夜蛾4龄幼虫转移至已加入病毒的饲料平板内。每个浓度60头,共360头。然后转移至温度26℃±1℃,相对湿度65%±5%的条件下继续培养。6 d开始检查试虫死亡情况,直至第10天。
1.2.3添加荧光增白剂FB28或链霉素进行生物测定
荧光增白剂处理:实验分为3组进行,CK0:在人工饲料中添加100 μL 2% FB28;CK1:人工饲料中添加100 μL 3.6×107PIB/mL SfMNPV;实验组:人工饲料中添加100 μL含2% FB28和3.6×107PIB/mL的SfMNPV。取长势一致的广西和西藏种群草地贪夜蛾4龄初期幼虫,分别接入上述3组人工饲料中,3个重复,每个重复10头虫。第6天开始每天检查试虫死亡情况,直至第10天。
链霉素处理:在人工饲料中添加100 μL含200 mg/L链霉素和5×107PIB/mL SfMNPV,对照不含链霉素,接入长势一致的广西和西藏种群草地贪夜蛾4龄初期幼虫,第6天开始每天检查试虫死亡情况,直至第10天。
1.2.4幼虫体内注射草地贪夜蛾出芽型病毒
SfMNPV的BV由Sf9细胞扩增,使用空斑计数法计数BV浓度。
取大小一致的广西和西藏草地贪夜蛾4龄幼虫在双蒸水中浸泡麻醉,在幼虫腹足位置用微量采血吸管注射5 μL SfMNPV BVs(2 700 PFU,plaque forming unit),阴性对照组注射等量的细胞培养液,置于15孔养虫盒内饲养,3个重复,每重复30头。10 d后检查试虫死亡率。
1.2.5中肠肠液pH测定
参考Haas-Stapletonetal.(2003)中肠pH测定方法并稍作改进,取广西和西藏种群草地贪夜蛾5龄幼虫,用剪刀、解剖针和尖嘴镊剖开虫体,剥去中肠组织,将围食膜包裹的肠道内容物转移至1 mL无菌双蒸水中,吹打震荡使肠道内容物全部溶解在水里,挑去围食膜碎片,2 000 g离心10 min,用pH计测量上清液pH,每个种群测量30次,每次1头草地贪夜蛾幼虫。
1.2.6肠道菌群16S rDNA测序
草地贪夜蛾广西和西藏种群各选择健康的草地贪夜蛾6龄幼虫12头,浸泡于75%乙醇中消毒,蒸馏水漂洗3次。在超净工作台上解剖其肠道内容物。每个种群设置3个样本,每个样本2头虫,共6个样本。于在-80℃冰箱中保存备用。根据E.Z.N.A.©soil DNA kit (Omega Bio-tek, Norcross, GA, U.S.)说明书进行微生物群落总DNA抽提,PCR扩增和Illumina HiSeq测序。以16S rDNA的V3-V4区域作为扩增和测序的目的片段,引物序列为:515F:5′-ACTCCTACGGGAG GCAGCA-3′,806R:5′-GGACTACHVGGGTWTCTA AT-3′(徐天梅等, 2020),扩增程序如下:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃ 延伸30 s),然后72℃稳定延伸10 min,最后在4℃进行保存(PCR仪:ABI GeneAmp©9700 型)。PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mM dNTPs 2 μL,上游引物(5 μM)0.8 μL,下游引物(5 μM)0.8 μL,TransStartFastPfuDNA聚合酶0.4 μL,模板DNA 10 ng,无菌去离子水补足至20 μL。每个样本3个重复。文库构建及数据处理基于llumina HiSeq测序平台,利用双末端测序(paired-end)的方法,构建小片段文库并进行测序。对原始数据进行拼接,将拼接得到的序列进行质量过滤,并去除嵌合体,得到高质量的tags序列(上海美吉生物医药科技有限公司)。
1.3 数据处理
PCR测序结果用DNAMAN 9.0和NCBI数据库下载草地贪夜蛾玉米型和水稻型COI和Tpi序列进行比对。
校正死亡率(%)=(病毒处理组死亡率-对照组死亡率)/(100%-对照组死亡率)×100,用SPSS 22.0对生物测定结果死亡率与浓度基于Probit回归模型计算LC50,同样方法Probit回归分析接种最高病毒浓度下草地贪夜蛾幼虫死亡率与时间并计算LT50。对注射SfMNPV的BVs后死亡率、草地贪夜蛾肠道pH值采用单因素方差分析差异显著性。
肠道微生物鉴定和多样性分析使用Flash(v1.2.11)进行pair-end双端序列拼接,Qiime(v1.9.1)生成各分类丰度表,Uparse(v7.0)对序列在97%的相似度水平下进行聚类、获得运算的分类单元(Operational Taxonomic Units,OTUs),Usearch(v7.0)进行OTU统计,通过PICRUSt对OTU丰度表进行标准化并基于Silva(细菌)和UNITE(真菌)分类学数据库对OTU进行分类学注释,RDP Classifier(v2.11)进行序列分类注释。
2 结果与分析
2.1 草地贪夜蛾不同地理种群遗传多样性分析
COI基因序列长度约780 bp,Tpi基因序列长度约380 bp,凝胶电泳检测如图1所示,条带大小正确无杂带,可用于后续测序验证。
COI部分序列比对结果表明,草地贪夜蛾云南、广东和西藏种群与NCBI上Rice strain(Sequence ID: HM136598.1)序列完全一致,属于水稻型;而广西种群存在16个位点的差异(图2),并与NCBI上Corn strain(Sequence ID: HM136592.1)序列一致,属于玉米型。

图2 我国草地贪夜蛾4个地理种群COI部分序列比对Fig.2 Sequence alignment of COI partial sequence of four geographical populations of Spodoptera frugiperda
Tpi部分序列比对结果表明,云南、广东、广西和西藏4个种群序列完全相同,且与NCBI上Corn Strain(Sequence ID: KT336238.1)序列一致,都属于玉米型。
2.2 草地贪夜蛾不同地理种群对草地贪夜蛾核型多角体病毒的敏感性
4个不同种群4龄幼虫对SfMNPV存在敏感性差异。从LC50值分析(表1),广西种群显著高于西藏、云南和广东种群,广西种群LC50是西藏种群的37倍;LT50趋势与LC50大致呈正相关(表2),广西种群LT50为9.5 d,西藏种群LT50为 7.3 d,表明广西种群敏感性最低,西藏种群敏感性最高。

表1 SfMNPV对不同地理种群草地贪夜蛾4龄幼虫的半致死浓度Table 1 Toxicity of SfMNPV to 4th instar larvae of Spodoptera frugiperda in different geographic populations
表2 SfMNPV对不同地理种群草地贪夜蛾4龄幼虫的半致死时间Table 2 Toxic effects of SfMNPV on 4th instar larvae of Spodoptera frugiperda in different geographic populations
2.3 荧光增白剂对草地贪夜蛾口服感染SfMNPV的影响
饲料中单独添加2%荧光增白剂FB28不会造成草地贪夜蛾4龄幼虫的死亡,但添加FB28对草地贪夜蛾感染SfMNPV有一定影响。其中,FB28对广西草地贪夜蛾感染SfMNPV有增效作用:7 d以后,添加了FB28的实验组死亡率显著高于对照组(图3-A)。而西藏种群实验组的死亡率稍高于对照组,但不具备统计学意义,可能是由于病毒的接种浓度显著高于西藏种群的LC50,导致FB28处理对病毒感染增效作用不明显(图3-B)。比较FB28对草地贪夜蛾不同种群感染SfMNPV的影响,发现添加FB28并接种相同病毒浓度下,广西种群因病毒感染的死亡率稍低于西藏种群,但不存在统计学意义的显著性差异(图3-C),说明添加了FB28抵消了草地贪夜蛾不同地理种群对SfMNPV的敏感性差异,提示不同地理种群对SfMNPV的敏感性不同可能是宿主围食膜的差异导致的。

图3 FB28处理对草地贪夜蛾广西种群和西藏种群感染SfMNPV的影响Fig.3 Effect of FB28 treatment on SfMNPV infection of Spodoptera frugiperda in Guangxi and Tibet注:A,添加FB28对草地贪夜蛾广西种群感染SfMNPV具有增效作用;B,添加FB28对草地贪夜蛾西藏种群SfMNPV感染增效作用不显著;C,FB28和SfMNPV共处理对草地贪夜蛾不同种群的影响不显著。Note: A, Addition of FB28 had a synergistic effect on the infection of SfMNPV by S. frugiperda Guangxi strain; B, Addition of FB28 to Tibetan population of S. frugiperda had no significant synergistic effect on SfMNPV infection; C, Effect of co-treatment of FB28 and SfMNPV on different populations of S. frugiperda.
2.4 添加链霉素对草地贪夜蛾口服感染SfMNPV的影响
在食物中添加链霉素能杀死甜菜夜蛾肠道中大部分细菌(Jakubowskaetal., 2013)。因此,本文中添加链霉素以消除宿主肠道细菌,对比死亡率差异,以描述肠道细菌对宿主感染SfMNPV的影响。其中,广西种群草地贪夜蛾在添加链霉素后6 d死亡率显著低于对照组,7~10 d死亡率与对照组无显著性差异(图4-A);西藏种群实验组与对照组死亡率无显著性差异(图4-B)。这说明肠道细菌可能并非直接参与草地贪夜蛾宿主拮抗SfMNPV作用。
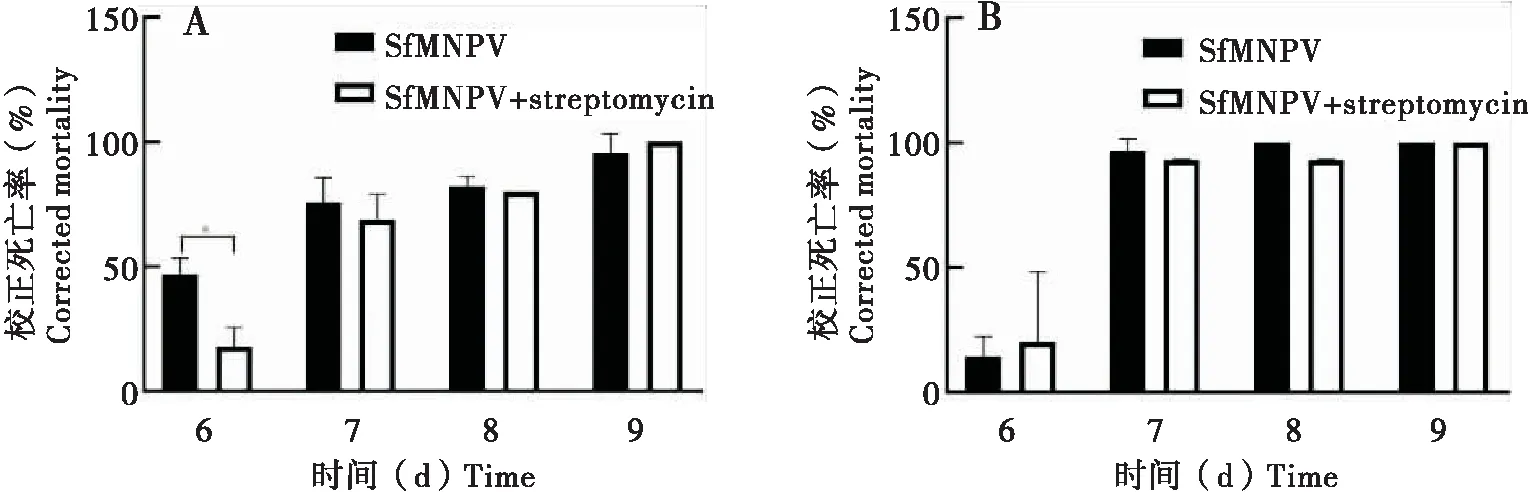
图4 链霉素处理对草地贪夜蛾广西种群和西藏种群感染SfMNPV的影响Fig.4 Effect of streptomycin treatment on SfMNPV infection of Spodoptera frugiperda in Guangxi and Tibet注:A,广西种群;B,西藏种群。Note:A,Guangxi strain;B,Tibet strain.
2.5 出芽型病毒对草地贪夜蛾高敏感种群和低敏感种群的致死率
注射SfMNPV BVs后,草地贪夜蛾广西种群和西藏种群4龄幼虫死亡率无显著性差异(图5),说明跳过原发感染阶段,两种群对BVs的免疫能力相当,表明两者对SfMNPV敏感性差异不在次级感染阶段,而是可能发生在多角体进入草地贪夜蛾消化道引起的原发感染阶段。
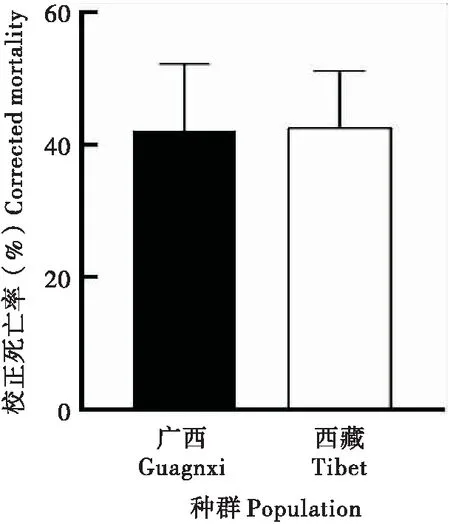
图5 草地贪夜蛾高敏感种群和低敏感种群4龄幼虫注射SfMNPV BVs死亡率Fig.5 Mortality rate of Spodoptera frugiperda after injection of SfMNPV BVs in different geographic populations
2.6 草地贪夜蛾不同地理种群肠道pH及菌群种类分析
广西种群和西藏种群中肠肠液pH存在显著性差异(图6-A),广西种群pH均值8.999,西藏种群pH均值9.160。广西种群pH值低,提示会抑制ODV的释放效率,进而导致广西种群对病毒的敏感性低。
广西和西藏种群在97%的相似度水平下聚类共获得639个OTUs(Operational Taxonomic Units)。其中广西种群聚类共获得488个OTUs;西藏种群聚类共获得151个OTUs,广西种群与西藏种群之间共有的OTUs数目为132个(图6-B)。广西种群肠道菌种类多于西藏种群。
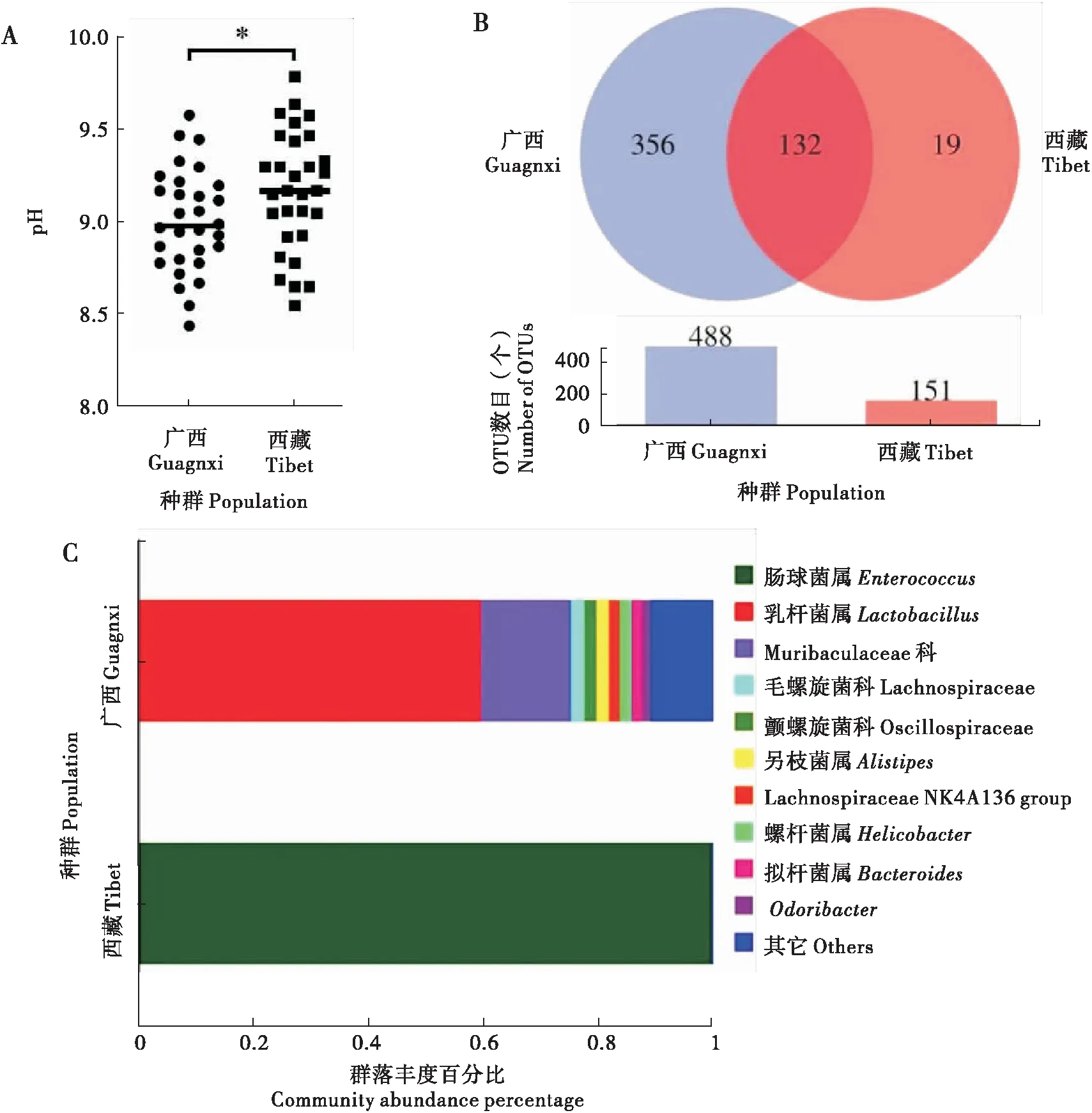
图6 草地贪夜蛾广西种群和西藏种群肠液pH及肠道细菌物种和菌落Fig.6 pH value, species and community of intestinal bacterial of Spodoptera frugiperda in Guangxi and Tibetan population
在科属水平上,广西种群肠道菌主要为乳杆菌属Lactobacillus(59.46%)、Muribaculaceae科(15.77%)、毛螺旋菌科Lachnospiraceae(2.35%)、颤螺旋菌科Oscillospiraceae(2.14%)、另枝菌属Alistipes(2.07%)、Lachnospiraceae NK4A136 group(2.04%)、螺杆菌属Helicobacter(1.93%)、拟杆菌属Bacteroides(1.76%)、Odoribacter(1.57%)和其它(10.92%),优势菌主要为乳酸菌Streptococcuslactis,而西藏种群肠道菌主要为肠球菌Enterococcus(99.71%)(图6-C)。提示广西种群相较于西藏种群肠道乳酸菌丰度高,导致肠液pH值低(图6-A),从而影响草地贪夜蛾广西种群对SfMNPV的敏感性。鉴于两组群肠道菌群存在明显差异,可能存在其它微生物影响宿主对病毒的敏感性,有待进一步验证。
3 结论与讨论
据报道,不同宿主基因型导致对病毒敏感性存在差异,例如,席羽等(2011)发现,在浙江、湖南、湖北和江苏7个不同地理种群茶尺蠖对EoNPV敏感性存在显著差异,并基于线粒体COI和COII基因序列分析,茶尺蠖地理种群存在遗传分化(席羽, 2011)。最近的研究通过生物测定评价了几种SfMNPV毒株对玉米型和水稻型草地贪夜蛾幼虫的毒力,结果表明,玉米型和水稻型草地贪夜蛾对SfMNPV的敏感性不同。玉米型草地贪夜蛾幼虫对SfMNPV不同毒株敏感性差异较大;而水稻型草地贪夜蛾幼虫对不同SfMNPV毒株的敏感性相对稳定(Pophametal., 2021)。本研究发现广西种群COI和Tpi鉴定结果都为玉米型,另外的云南、广东、西藏种群COI为水稻型,Tpi为玉米型,属于杂合玉米型(图2),与目前国内各地对草地贪夜蛾基因型的鉴定结果一致(徐丽娜等, 2019; 张磊等, 2019; 王亚如等, 2020)。生物测定结果表明,玉米型的广西种群的草地贪夜蛾对SfMNPV口服感染敏感性最低,而杂合玉米型的西藏种群的敏感性最高(表1和表2)。
虽然不同地理种群草地贪夜蛾对SfMNPV的敏感性存在差异,但是幼虫直接注射SfMNPV BVs后,广西种群(低敏感性)和西藏种群(高敏感性)感染SfMNPV的死亡率无显著差异(图3),表明敏感性差异并不发生在系统感染阶段,而是发生在SfMNPV经口进入中肠的原发感染阶段。
国内不同地区草地贪夜蛾肠道菌群差异已有相关报道,重庆种群分离的可培养肠道细菌为克雷伯氏菌属KlebsiellaTrevisan、不动杆菌属Acinetobacter、假单胞菌属Pseudomonasadaceae、肠杆菌属EnterobacterHormaecheandEdwards和气单胞菌属Aeromonas5属(唐运林等, 2019),云南省蒙自地区的草地贪夜蛾幼虫肠道分离到的细菌为克雷伯氏菌属、肠球菌属、沙雷氏菌属Serratia和摩根菌属Morganella4属(李青晏等, 2020)。云南省宝藏镇的草地贪夜蛾肠道优势属菌为艾克曼菌属Akkermansia,丰度为12.80%;而云南省嵩明县的草地贪夜蛾肠道优势属菌为肠球菌属,丰度为46.99%(徐天梅等, 2020)。本研究中对肠道微环境研究发现,对SfMNPV低敏感的广西种群肠液pH显著低于高敏感的西藏种群(图6-A)。两者肠道菌群也存在显著差异,广西种群肠道菌种类和丰度显著高于西藏种群(图6-B),前者优势菌为乳酸菌,从而导致其肠液pH值低;后者主要为肠球菌(图6-C)。本试验的结果与上述报道产生差异的原因,可能是草地贪夜蛾材料来源不同,有野外采集、室内采用寄主植物饲养或人工饲料饲养,肠道菌群差异可能是不同地域环境条件及寄主植物和食料条件的不同造成,而本研究所用草地贪夜蛾全部使用人工饲料进行饲养,龄期和外部环境条件也完全相同,造成肠道菌群差异可能是由于不同草地贪夜蛾肠道环境差异造成细菌对其适应性不同。另外,在饲料中添加链霉素去除肠道菌群,对草地贪夜蛾感染SfMNPV的作用不明显(图4-C),说明肠道菌群可能并非直接参与宿主拮抗SfMNPV。但是添加荧光增白剂后,消除了广西种群和西藏种群口服SfMNPV的敏感性(图4-A, B),结合荧光增白剂对围食膜具有一定破坏作用,一定程度上表明造成草地贪夜蛾不同地理种群对SfMNPV的敏感性可能是由于宿主围食膜的差异导致的。
综上所述,根据草地贪夜蛾不同地理种群的基因型、肠道微环境和对病毒的敏感性规律来看,草地贪夜蛾广西种群属于纯合玉米型,其肠道菌群种类和丰度高,优势菌为乳酸菌,中肠肠液pH值较低,对SfMNPV的敏感性低;而云南、广东和西藏种群属于杂合玉米型,其中西藏种群对SfMNPV的敏感性最高,其肠道菌群种类和丰度低且主要为肠球菌,肠液pH较高。这是否是普遍规律以及这些条件是如何相互影响尚不清楚,有待进一步探索。
