超声造影联合声触诊组织量化技术鉴别肝血管瘤与肝细胞癌价值研究*
2022-07-14王晶,张洁,赵静
王 晶,张 洁,赵 静
原发性肝癌(PLC)具有较高的发病率,其中肝细胞癌(HCC)占比约为90%,病死率高。近年来,随着人们生活方法的改变,HCC患病群体日益增多,且呈现出低龄化的趋势[1]。据相关报道显示,HCC患病群体广泛分布于亚洲、非洲、欧洲南部等地区,每年死亡人数约为38万[2,3]。外科手术为首选的治疗方案,但该病发病初期具有起病隐匿的特点,不易被发现,至确诊时大部分患者已进展至中晚期,此时已不再适宜行外科手术治疗。肝脏良恶性占位性病变的鉴别也是诊治过程中的关键。超声造影(contrast-enhanced ultrasonography,CEUS)为现阶段鉴别肝脏良恶性病变的常用方法,可在造影剂辅助下对病灶的数目、数量和病灶区域微循环血流灌注情况进行观察,鉴别的准确率较高,目前已广泛应用于临床[4,5]。然而CEUS检查也存在一定的局限性,如重复性较差,对于肝内多发占位需行多次造影剂注射、观察,甚至部分患者对造影剂过敏,因此有必要积极寻找其他有效的影像学评估方法用于肝脏病变良恶性的鉴别[6]。声触诊组织量化技术(virtual touch tissue quantification,VTQ)为近年新出现并应用于临床的弹性成像技术,可依据组织的弹性系数对病变的良恶性进行评估,在乳腺癌[7]、甲状腺结节[8]良恶性的评估中均表现出较高的准确性。我们采用CEUS和VTQ检查评估肝脏占位性病变,旨在为HCC的诊治提供帮助,现报道如下。
1 资料与方法
1.1 一般资料 2018年4月~2021年4月我院诊治的肝内占位性病变患者93例,男55例,女38例;年龄为45~65岁,平均年龄为(55.7±4.9岁)。排除标准:(1)存在超声造影检查禁忌证;(2)既往有胸腹部手术史;(3)超声检查前已行药物或手术治疗;(4)病灶靠近心脏或大血管;(5)伴有严重的心脑血管疾病;(6)存在精神异常,无法配合本研究。
1.2 CEUS检查 使用Siemens Acuson S2000超声诊断仪,配备有CEUS和VTQ成像技术,4 C1凸阵探头,频率为2.5~7.5 MHz。患者取仰卧位,首先以灰阶超声探查,观察病灶数目、大小及其与周围组织间的关系。选择可清晰显示病灶与周围组织最佳切面,切换为CEUS模式,机械指数≤0.1。取声诺维造影剂(SonoVue,意大利Bracco公司)2.4 mL,使用前于冻干粉剂中加入生理盐水5 mL,制成混悬液。于肘静脉快速团注,完成后立即以生理盐水5 ml冲管,并启动超声仪内置计时器,存储动态图像,连续实时观察病灶与周围组织动脉相(10~30 s)、门脉相(31~120 s)和延迟相(121~360 s)血流灌注情况。最后,在ACQ定量分析软件辅助下行数据分析,计算开始增强时间、增强峰值时间和峰值强度。
1.3 VTQ检查 于CEUS检查30 min后进行,避免因造影剂残留影响检查结果。选择最佳观察切面,切换VTQ模式。VTQ取样框由仪器预先设定为不可调节大小的固定值,即10×6 mm,最大取样深度8 cm。检查时,扫查切面尽量与取样框长轴垂直,避开心脏和大血管,将取样框置于病灶内部和同等深度距病灶边缘2~3 cm正常肝实质,嘱患者屏住呼吸,至图像稳定后,按下update键,记录病灶内部剪切波速度(shear wave velocity,SWV)和周边组织SWV,并计算病灶/周边组织SWV比值。

2 结果
2.1 不同肝内占位性病变患者CEUS检查参数比较 经CT或MRI或术后组织病理学检查,本组诊断肝血管瘤40例,HCC 53例;在CEUS检查,HCC患者开始增强时间和增强峰值时间显著短于肝血管瘤患者(P<0.05),而峰值强度与肝血管瘤患者比,无显著性差异(P>0.5,表1,图1)。
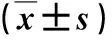
表1 两组CEUS检查参数比较

图1 肝血管瘤和肝细胞癌患者CEUS表现A:肝血管瘤患者男,54岁。常规超声探及肝内低回声结节,CEUS门脉期呈持续高增强;B:HCC患者男,66岁。常规超声探及肝内低回声结节,CEUS动脉期呈快速不均匀高增强
2.2 肝血管瘤与HCC患者SWV比较 HCC患者病灶内部SWV、周边组织SWV和SWV比值显著高于肝血管瘤患者(P<0.05,表2、图2)。

表2 两组病变比较
图2 肝血管瘤与肝细胞癌患者VTQ检查表现 A:肝血管瘤患者女,28岁。常规超声探及肝内高回声结节,SWV=1.47m/s;B:HCC患者男,72岁。常规超声探及肝内低回声结节,SWV=2.16m/s
2.3 CEUS检查参数和SWV诊断HCC效能分析 经ROC分析发现,开始增强时间、增强峰值时间、病灶内部SWV、周边组织SWV和SWV比值均能用于HCC的诊断,其曲线下面积(AUC)分别为0.754、0.818、0.758、0.802和0.809(P<0.05,表3、图3)。分别以开始增强时间≤12.080 s、增强峰值时间≤26.530 s、病灶内部SWV≥2.015 m/s、周边组织SWV≥1.920 m/s和SWV比值≥1.280为截断点,任一指标达标即诊断HCC,经一致性分析发现,CEUS检查参数联合SWV诊断HCC患者48例,其敏感度为0.906,特异度为0.950,准确率为0.925,阳性预测值为0.960,阴性预测值为0.884,Kappa=0.848。
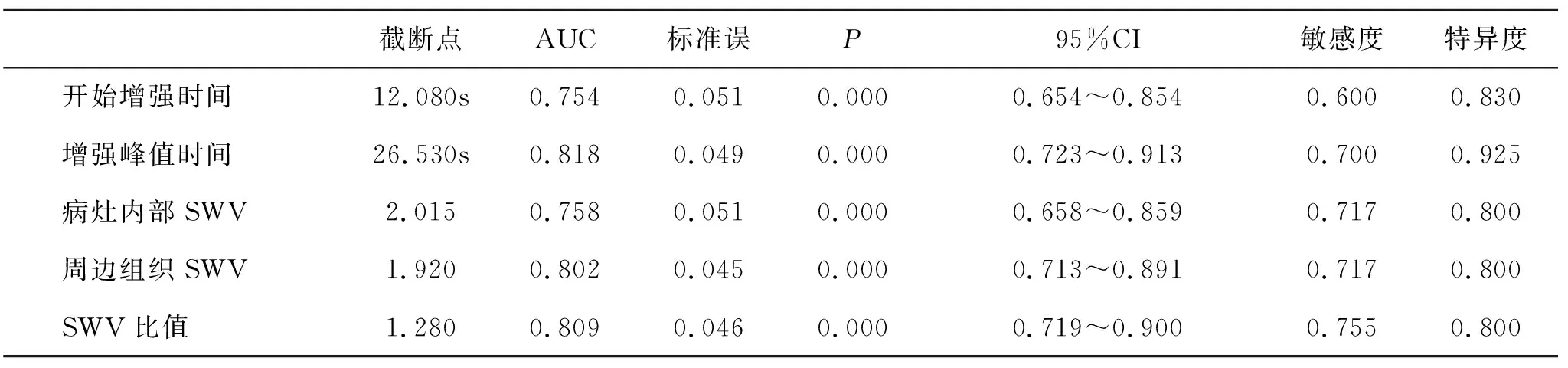
表3 CEUS检查参数和SWV诊断HCC效能分析
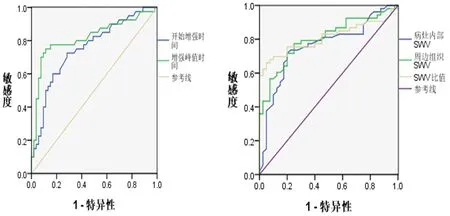
图3 CEUS检查参数和SWV诊断HCC的ROC曲线
3 讨论
肝血管瘤和肝细胞癌均为肝脏常见的病变,前者为良性病变,多因先天发育异常或激素刺激等因素导致,预后较好,无需行手术治疗,而后者则为我国常见的一种消化道恶性肿瘤,由于其恶性程度高、预后较差,宜尽早行手术治疗,控制疾病进展,改善预后[9-11]。故有效鉴别肝血管瘤与肝细胞癌对治疗至关重要。由于超声检查无创、操作简便、费用低廉等特点,已成为肝脏良恶性病变鉴别的首选方法。CEUS能够实时、动态观察病灶区域的血流灌注情况,在一定程度上提高了鉴别的准确性,但诊断结果也会受到体位、扫描切面等因素的影响。VTQ是基于CEUS革新形成的一项新技术,可定量评估病灶硬度,有望能为肝脏良恶性病灶的鉴别提供帮助。
本研究结果显示,肝细胞癌患者CEUS开始增强时间和增强峰值时间显著短于肝血管瘤患者,存在明显差异。肝脏由门静脉和肝动脉供血,在CEUS检查时可借助造影剂观察全身各组织的微细血管情况,通过观察造影剂到达组织和病灶的速度和时间可实时、动态、连续地观察相应组织病灶的血流灌注信息[12,13]。不同类型肝脏病灶间的血流分布和血流动力学也存在一定的差异,其中恶性病灶血供较为丰富,由新生动脉为其供血,此时肝脏血流灌注量增大,流速增快,从而缩短开始增强时间和增强峰值时间[14]。肝脏恶性病灶内部存在动静脉瘘,供血量丰富,在CEUS检查时造影剂注入后可快速廊清,同时病灶信号相对于周围组织增强较快,可表现出快进快出的特点,而肝脏良性病变则表现为延迟相的高增强或等增强[15,16]。
在VTQ检查方面,肝细胞癌病灶内部SWV、周边组织SWV和SWV比值显著高于肝血管瘤,存在明显差异。可依据SWV值判断组织硬度,从而鉴别病变的良恶性。肝脏恶性病灶呈现浸润性生长,并与周围组织粘连,可影响其活动度,降低组织弹性,此时病灶硬度明显增加,而肝脏良性病灶内普遍存在少量的纤维组织成分和较多的组织细胞、血管,组织硬度较小[17-19],导致肝细胞癌病灶内部SWV、周边组织SWV和SWV比值明显增高[20]。通过VTQ技术对肝脏良恶性局灶性病变进行鉴别,发现恶性病灶SWV显著升高。
为确定CEUS和VTQ检查鉴别诊断肝细胞癌与肝血管瘤的价值,我们应用ROC分析,发现CEUS开始增强时间、增强峰值时间、病灶内部SWV、周边组织SWV和SWV比值均具有一定的诊断价值。本研究发现该两项技术联合应用可获得较高的诊断价值。在临床实践中,对肝脏良恶性病灶的鉴别是一个非常常见的问题,采用VTQ和CEUS技术将有利于提高诊断肝细胞癌的准确率,而避免对肝血管瘤过度治疗。
