一类21种HPV亚型检测试剂盒的性能验证和评价*
2022-07-14冯倚帆刘志坚宋子威熊晓芸
冯倚帆,张 帅,刘志坚,宋子威,熊晓芸
1.徐州医科大学附属医院检验科,江苏徐州 221002;2.江苏省疾病预防控制中心,江苏南京 210009
人乳头瘤病毒(HPV)感染日益引起公众的关注,PATEL等[1]基于对全世界32项研究的系统回顾分析发现,每年肛门-生殖器疣的发病人数为每10万人就有160~289例。低危型HPV感染导致皮肤或黏膜疣状突起,比如HPV6、11型易导致尖锐湿疣。有研究发现,美国每年有1 400 万人确诊感染HPV,意味着HPV的流行范围接近8 000万人。HPV某些高危型长期和反复感染是导致恶变(包括宫颈癌、阴茎癌、肛门癌、阴道癌、外阴癌等)最主要的因素[2]。有研究发现,25%的头颈鳞状细胞癌与HPV感染有关[3],60%的口腔鳞状细胞癌主要原因是HPV16型长期感染[4]。而绝大多数宫颈癌病例均由HPV感染引起,中国约占全球宫颈癌的1/3,中国2015年新增宫颈癌病例约98 900例[5]。依据《医学实验室质量和能力认可准则在分子诊断领域的应用说明:CNAS-CL02-A009:2018》[6]和《医疗机构临床实验室管理办法》[7]在基因扩增检验领域的应用说明,新试剂在实验室应用于临床检验前要进行性能验证,才能保证实验室对该项目检测的质量控制。徐州医科大学附属医院检验科微生物室新购的人乳头瘤病毒核酸分型检测试剂盒[江苏硕世生物科技股份有限公司,实时荧光定量聚合酶链反应(PCR)]可检测21种HPV亚型。为确定本实验室新启用试剂能达到试剂说明书上声明的性能指标,满足临床检测要求,保证检测质量,本研究对21种HPV亚型检测试剂盒的准确度、最低检测限、精密度、特异度及抗干扰能力等性能进行验证。
1 材料与方法
1.1 材料
1.1.1 标本来源 江苏硕世生物科技股份有限公司提供的24例标本,经亚能生物膜杂交法实验验证其中19例阳性(涵盖该试剂盒可检测的21种亚型)和5例阴性;江苏硕世生物科技股份有限公司提供的阳性参考品,主要成分为HPV21种亚型及参考基因质粒;徐州医科大学附属医院检验科微生物室、妇产科实验室和皮肤科实验室提供的白色念珠菌、大肠埃希菌及解脲支原体阳性标本,这些标本与HPV感染部位相同,症状相似,且不在该试剂盒检测范围内。
1.1.2 仪器与耗材 SLAN-96P荧光定量PCR分析仪(购自上海宏石医疗科技有限公司);Eppendorf高速低温离心机、Eppendorf金属浴恒温器、Eppendorf漩涡振荡仪、八联管(A~H)均购自美国Axygen公司。
1.1.3 试剂 来自江苏硕世生物科技股份有限公司的核酸提取与纯化试剂盒、人乳头瘤病毒核酸分型检测试剂盒(荧光定量PCR),可检测21种HPV亚型,包括高危型HPV16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、82、73型及低危型HPV6、11、81型。
1.2 方法
1.2.1 提取HPV核酸 取出标本,振荡混匀,吸取500 μL标本于带螺口的离心管中,12 000 r/min离心5 min,弃上清液,保留沉淀物。加入100 μL宫颈细胞标本裂解液,振荡混匀,100 ℃水浴或干浴10 min。振荡混匀,12 000 r/min离心5 min,上清液即为核酸溶液,加入反应试剂就可直接用于检测。
1.2.2 PCR 扩增参数:50 ℃ 5 min 尿嘧啶-N-糖基化酶处理;95 ℃ 5 min预变性;95 ℃ 10 s变性,58 ℃ 40 s退火、延伸及检测荧光,其中58 ℃时荧光检测的检测通道为FAM、VIC、ROX 3种荧光反应,45个循环;仪器冷却。PCR扩增结果分析:反应结束仪器可自动保存结果。空白对照无典型S型扩增曲线显示;阳性对照HPV21种亚型及参考基因检测呈典型S型扩增曲线,且Ct值≤30.0;参考基因H孔FAM通道扩增曲线呈典型S型曲线,且Ct值≤36.7。
1.2.3 性能验证指标及验证方法 (1 )准确度验证。亚能生物膜杂交法试验已检测的24例标本(阳性19例和阴性5例),严格按照HPV核酸提取和扩增程序进行试验。将测定结果与已知结果进行比对,若检测结果不一致,需采用金标准测序法进行验证,符合率≥95%为合格。(2)最低检测限。最低检测限的验证选择该试剂公司的企业阳性参照物(浓度为107copy/mL),进行10倍梯度倍比稀释至试剂盒提供的最低检测限为104copy/mL,重复检测20次。检测结果阳性率≥95%为合格。(3)精密度试验。选择该试剂公司的企业阳性参照物。批内CV:在一个批次内连续检测做10个重复管,并计算Ct值的CV,参考《核酸扩增检测用试剂(盒):YY/T1182-2010》[8],计算其CV≤5.00%为合格。批间CV:连续检测5 d,每天重复4次,并计算Ct值的CV,参考文献[9]计算其CV<5.00%为合格。(4 )特异度。采用该试剂盒检测与HPV感染部位相同、症状相似的病原体及该试剂盒检测范围之外的物质,白色念珠菌、大肠埃希菌和解脲支原体分别加入标本中,以阴性标本作为对照,按照核酸提取和扩增程序进行检测。检测结果显示交叉反应阴性为合格。(5) 抗干扰能力。将标本(HPV16型/HPV31型)均等分为5份,编号1~5,1号加入与干扰物质等体积的TE缓冲液作为对照组,2~5号分别加入检测标本中常见的干扰物[宫颈黏液、血红蛋白、白细胞、阴道润滑油(5%)]作为试验组。按照核酸提取和扩增程序进行检测,检测结果为HPV16、31型检出为验证合格。
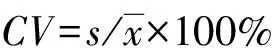
2 结 果
2.1 HPV亚型检测试剂盒准确度验证结果 24例标本中19例阳性标本试验结果与已知结果均一致,符合率为100.00%,见表1。
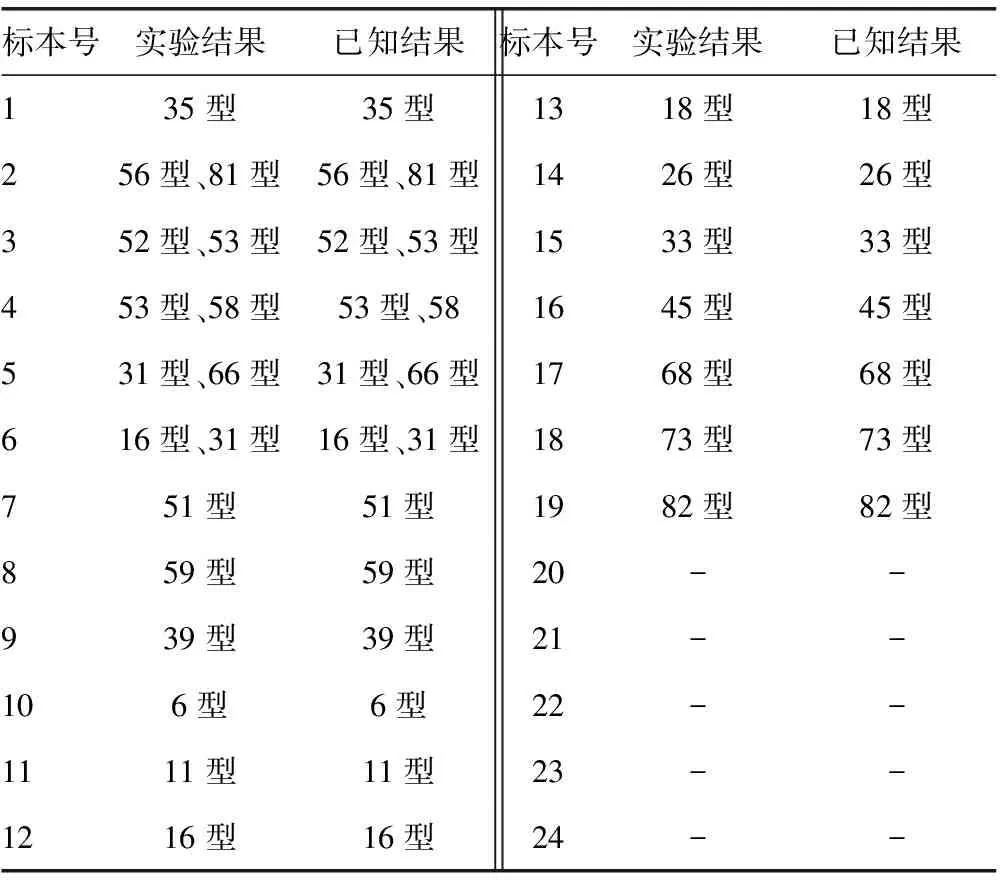
表1 HPV分型检测试剂盒准确度验证结果
2.2 最低检测限 该试剂盒的最低检测限为104copy/mL,阴性率为100.00%,符合试剂盒声明的最低检测限,最低检测限验证合格。
2.3 精密度 21种HPV亚型和阳性参照物批内CV为0.22%~3.40%,CV均小于5.00%,符合行业标准(CV≤5.00%);21种HPV亚型和阳性参照物批间CV为0.31%~0.91%,CV均小于5.00%,符合行业标准(CV<5.00%),精密度验证合格。
2.4 特异度 该试剂盒与白色念珠菌、大肠埃希菌和解脲支原体不存在交叉反应,与试剂盒说明书声明一致,特异度验证合格。
2.5 抗干扰能力 已知阳性标本分别加入干扰物(宫颈黏液、血红蛋白、白细胞、阴道润滑油)后,均检出HPV16、31型,检测结果及参考基因Ct值的CV为0.11%~0.32%,抗干扰能力验证合格。
3 讨 论
HPV DNA载量通常估计为每个细胞的HPV基因组拷贝数,与HPV感染疾病有很大程度的相关性,并且在区分正常细胞学和异常细胞学方面具有特异性[10]。目前,针对HPV的检测方法主要有核酸分型定性检测、HPV-原位杂交、杂交捕获HPV DNA检测、细胞学检测、病理组织学检测等,可用于检测高危和低危的HPV亚型[11]。而现阶段有些 HPV分型检测试剂采用生物膜杂交法,该方法不仅操作步骤烦琐,而且容易污染环境。杂交法试剂在检测 HPV时,其灵敏度低于其他PCR扩增检测试剂,存在一定比例的漏检[12]。而采用多重荧光定量PCR,整个检测过程自动化程度高、操作简便,而且能最大限度避免扩增产物引起的环境污染,具有检测原理简单,易取材且取材量少,报告时效较短,以及收费合理等优势。因此,多重荧光定量PCR用于诊断HPV感染,对细胞异常人群的风险分层、促进患者管理有很重要意义[13]。
江苏硕世生物科技股份有限公司的HPV试剂盒在仪器正常,以及空白对照、阳性对照、八联管H孔FAM通道均正常的情况下,核酸扩增根据HPV亚型探针荧光标记进行分析。根据参考值(参考范围)在8个样本孔(A~H孔)中的HPV亚型扩增曲线呈典型S型曲线,且Ct值小于或等于参考值,判断相应的 HPV亚型为阳性;无典型S型扩增曲线或Ct值大于参考值,则判断相应的HPV亚型为阴性。准确度、最低检测限、精密度和特异度验证扩增曲线均有效,验证结果为合格。在验证抗干扰能力时,出现一条异常曲线,原因是该八联管上机扩增前掌上离心机损坏,未离心的八联管内有气泡,扩增时出现异常曲线,但其他扩增曲线没有受到干扰,验证结果合格是有效的。
该试剂盒以HPV基因组L1区为靶区域,设计21对各亚型特异性引物和21条特异探针,分别以FAM、HEX、ROX标记相应亚型的探针。探针为包括5′端报告基团和3′端淬灭基团的寡核苷酸,在PCR扩增过程中,当探针完整时,由于淬灭基团靠近报告基团,报告基团发出的荧光被淬灭基团吸收,不发出荧光信号。引物延伸时,与模板结合的探针被Taq酶(5′→3′外切核酸酶)切断,报告基团与淬灭基团分离,产生荧光信号,荧光定量PCR仪根据检测到的荧光信号自动绘制出实时扩增曲线,从而实现对HPV在核酸水平上的定性检测。多重荧光PCR技术与八联管空间分隔技术相结合,在反应中每个PCR反应孔内仅包含3对不同亚型的特异性引物及其相应的3条分别以FAM、HEX、ROX荧光标记的特异探针,检测3个通道即可分析出具体亚型,故HPV不同亚型之间不可能存在交叉反应。 这种检测原理的试剂盒通过多个反应孔实现多种亚型的分型,特异性引物PCR 的优势在于能够保证高灵敏度和高特异度地鉴定单一亚型,有利于在多重感染中检出不同 HPV亚型。
此外,《人乳头瘤病毒(HPV)核酸检测及基因分型试剂技术审查指导原则》[14]中提到干扰物质的选取应至少包括血红蛋白、白细胞、宫颈黏液、阴道避孕药物、女性卫生用品、阴道用抗真菌药物、阴道润滑剂等。本次性能验证选择常规检测标本中常见的干扰物包括宫颈黏液、血红蛋白、白细胞、阴道润滑油。在月经期一般不建议做HPV核酸检测,故本次试验未选择女性卫生用品。阴道避孕药物和阴道用抗真菌药物一般需要在阴道环境中作用一段时间,使有效成分释放,考虑到很难做到较真实的临床模拟,故未选择。
该试剂盒可一次性检出21种HPV亚型,包括常见的18种高危型和3种低危型,涵盖了常见的引起不良转归的亚型。检测过程比较简单、高效,同时也不能忽视其可能存在的问题。由于该试剂盒采用八联管空间分隔技术,导致检测通量相对较低。对于大批量筛查需要多台实时荧光定量PCR仪。另外,PCR检测技术也可能由于受DNA提取、样品类型和检测方法局限的影响,甚至存在携带污染、扩增产物污染等造成的假阳性、假阴性。在检测过程中,若存在标本采样、运输、保存条件及实验操作不当等可导致参考基因扩增曲线异常,则该次试验定性结果为无效。严格按照试剂说明书及实验室标准操作程序进行操作,可最大限度避免无效结果出现。
综上所述,本研究整个性能验证过程均处于有效的质量控制下,做到最大限度保证数据的准确性及可重复性,性能验证符合行业标准需求,这份HPV亚型检测试剂盒(荧光定量PCR)可在本实验室进行临床检验相关诊断。
