60Co-γ辐射对兜兰组培苗的诱变效应
2022-07-14房义福姜楠南
孙 音,郝 军,房义福,张 谦,姜楠南
(1山东省林业科学研究院,济南 250014;2济南市历城区绿化服务中心,济南 250100)
0 引言
兜兰属(Paphiopedilum)是兰科植物中较原始的属之一,以其唇瓣而得名,故又叫拖鞋兰、仙履兰等,在全世界约有80余种,接近1/3的资源在中国有分部[1],主要产于广西、云南以及贵州等省区[2]。其花期长、花型奇特,备受世界花卉爱好者的青睐。目前对兜兰的研究主要集中于系统演化、生态地理、引种驯化、组培快繁、多样性评价等方面[3-4]。
60Co-γ射线穿透力强,变异谱大,诱导的变异性状可在当代进行筛选,且具有可遗传性,能极大的缩短育种周期,目前作为一种便捷的手段被广泛应用多种植物中[5]。辐射诱变育种和组织培养相结合的育种体系是近年来研究者较为关注的育种方法,它可以提高植物在基因水平上的突变率,有利于打破性状连锁以及亲本对后代变异类型的局限,进而扩大植物的变异谱,缩短育种年限,快速创造新材料、新种质[6]。王晶等[7]研究了60Co-γ射线对菊花组培苗的诱变效应,发现在增殖阶段和生根阶段,诱变处理的最佳剂量在10 Gy左右,叶片和花色都发生不同程度的变异。刘丽强等[8]对观赏海棠组培苗的辐射诱变中发现,60Co-γ射线辐射后,组培苗在形态上出现明显矮化特征,叶色、叶缘、叶形变异明显,30 Gy时诱变效果稳定,是较为合适的辐射剂量。姜长阳等[9]利用60Co-γ射线辐射玉兰由茎尖生长点诱导的愈伤组织,并从再生植株中选育出生长速度快、生长旺盛、抗逆性强等具有多种优良性状的玉兰新品系。张慧琴等[10]用60Co-γ射线对草莓组培苗进行了辐射诱变,发现辐射剂量对草莓组培苗的生长发育有显著影响,品种不同,对辐射效应的敏感性也不同。
兜兰本身变异系数较低,主要的繁殖方式为无菌播种,选种周期长[11],目前未见到利用组培苗进行辐射诱变的报道,对于辐射剂量、植物材料对组培苗生长和发育的影响以及辐射后植株的变异情况尚不清楚。本研究选用不同时期的兜兰组培苗作为材料进行60Co-γ辐射诱变,旨在明确60Co-γ射线在种子萌发、增殖、生根及小苗移栽后生长和生理特性的影响,探讨可能发生的形态变异,以确定适宜辐照剂量及对兜兰的诱变效应,为无菌播种、离体快繁与辐射诱变相结合的复合育种技术的应用提供理论依据。
1 材料和方法
1.1 材料
试验材料分别选用无菌播种30天的兜兰种子、待分化的兜兰不定芽(高0.8~1.5 cm)、待生根的兜兰幼苗(高2.0~2.5 cm)以及要移栽的兜兰小苗。种子处理时选用100粒颗粒饱满,无病虫害种子;幼苗分化、生根以及小苗处理时选用100株叶片鲜绿、硬挺、富有光泽的小苗,每个辐照剂量设3个重复。试验在山东省林业科学研究院遗传育种重点实验室、济南国际鲜花港智能温室,于2020年1月—2021年4月份进行。
1.2 试验方法
1.2.1 辐射诱变处理 辐射诱变处理剂量设0、5、10、20、30、40 Gy 6个梯度。于山东济南长清区泉港辐照中心对植物材料进行辐射处理,辐射剂量率为1.0Gy/min。
1.2.2 指标测定方法

式中:x为辐射剂量;y为幼苗成苗率;N为供试种子数。
用游标卡尺测量苗高、根长等;根系活力采用TTC检测方法,脯氨酸的测定主要采用酸性茚三酮比色法,可溶性蛋白含量的测定采用考马斯亮蓝法[12],丙二醛(MDA)和可溶性糖的测定采用硫代巴比妥酸法,超氧化物歧化酶(SOD)活性采用氮蓝四唑法,过氧化物酶(POD)活性采用愈创木酚法[13]。
1.2.3 数据分析 运用Excel 2010、SPSS 22.0进行数据分析。
2 结果与分析
2.1 辐射处理对兜兰种子萌发、幼苗增殖、生根的影响
2.1.1 辐射处理对兜兰种子萌发的影响 辐射后兜兰种子发芽情况见表1、图2。随着辐射剂量的增大,种子发芽指标呈下降趋势。辐射剂量为5 Gy时,发芽率与对照组相比差异不显著,但成苗率和发芽势显著降低,表明种子已经受到损伤,需要一定修复,萌发时间延长,后期成苗能力减弱,在10 Gy剂量时,各萌发指标较其他各组差异极显著(P<0.01),成苗率为对照的62.45%。在20 Gy剂量时,发芽率、成苗率和发芽势较10 Gy下降幅度最大,分别为74.84%、76.56%和74.99%,表明在此剂量辐射下,种子内部结构损伤严重,萌发难度大。在30 Gy、40 Gy剂量时,种子各项发芽指标差异不显著,且40 Gy剂量时,种子丧失成苗力。

图2 不同剂量辐射处理60天的兜兰种子萌发情况
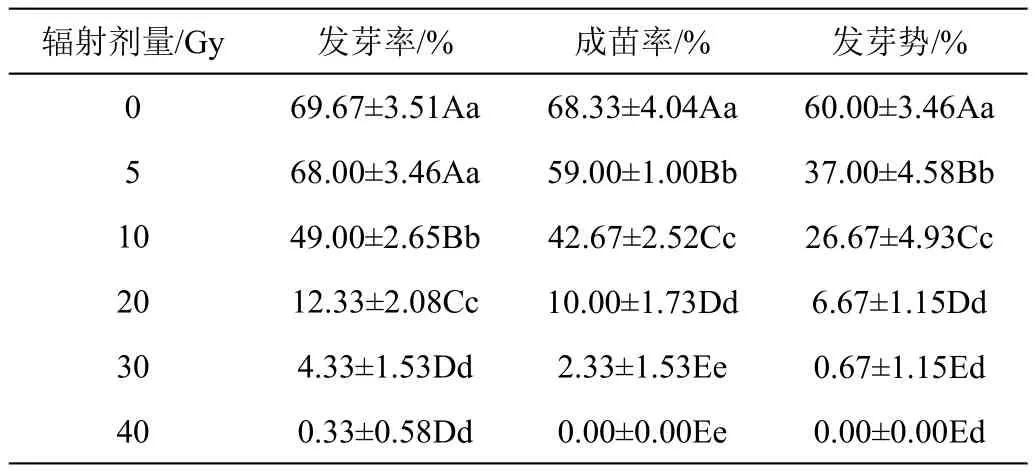
表1 不同剂量辐射处理对兜兰种子萌发的影响
辐射后的成苗率是衡量辐射损伤效应的重要指标,也是计算其半致死剂量的依据,成苗率与半致死剂量成线性关系,计算回归方程及相关系数并绘制标准曲线,见图1。得出线性方程为y=-1.85x+62.80,R²=0.90。从直线回归方程中可以求得:当y=50时,x=6.92,即兜兰种子辐射的半致死剂量LD50=6.92 Gy。

图1 辐射剂量与成苗率的相关性分析
结合兜兰种子辐射处理后的各项萌发指标和计算的半致死剂量,得出兜兰种子萌发阶段适宜的辐射剂量为5 Gy。
2.1.2 辐射处理对兜兰不定芽增殖的影响 辐射后兜兰不定芽增殖情况见表2、图3。随着辐射剂量的增大,不定芽增殖率、增殖时间、苗高均呈下降的趋势。处理90天、120天时,5 Gy剂量下的增殖率、苗高与对照相比差异极显著(P<0.01);150天时,增殖率与对照组相比差异不大,但少数分化苗叶片浓绿,变厚,植株低矮。10 Gy剂量下3个阶段增殖率较其他组差异极显著(P<0.01),处理90天时,苗高与5 Gy剂量差异极显著(P<0.01),随着时间延长,苗子长势加快,120天和150天时与5 Gy剂量下差异较小。到150天时,20 Gy、30 Gy剂量下的增殖率差异不显著,分别为对照组的43.90%、32.92%;分化苗出现花色、细长、卷曲等特征,株型矮化,说明辐射对植株细胞形态和结构产生影响,诱发表型变异。但30 Gy时,小苗长势较弱。40 Gy时,增殖率和苗高较其他组差异极显著,分化能力几乎丧失,小苗部分褐化死亡。结合增殖率和表型变异情况,得出兜兰不定芽增殖阶段适宜的辐射剂量为20 Gy。

表2 不同剂量辐射处理对兜兰分化的影响

图3 不同剂量辐射处理150天后的兜兰分化苗
2.1.3 辐射处理对兜兰不定根分化的影响 辐射后兜兰不定根分化情况见表3、图4。随着辐射剂量的增大,不定根分化时间变长,生根率显著下降。兜兰不定根分化阶段对辐射处理敏感性较强,辐射后120天、150天,随着辐射剂量的增大根系活力呈下降趋势,180天时,随着辐射剂量的增大根系活力先略升后下降。5 Gy剂量下,120天时生根率为对照的69.55%,根长为对照的64.71%,180天时生根率为对照的77.10%,根长与对照组差异不显著,说明随着时间的推移兜兰对低剂量辐射造成的伤害有一定的修复能力。同时处理180天时根系活力较对照组提高了4.05%,说明低剂量的辐射对根系活力有一定促进作用。10 Gy剂量下,处理180天后的各项指标较5Gy剂量下降幅度大,同时,10、20 Gy剂量下,部分小苗株型矮化、叶片卷曲、开裂,白化、且生长缓慢。30~40 Gy剂量下生根率为0,说明兜兰不定根分化阶段对辐射处理敏感性较强。以此得出,兜兰不定根分化阶段,适宜的辐射剂量为5Gy。

图4 不同辐射处理150天的下兜兰生根情况

表3 不同剂量辐射处理对兜兰不定根分化的影响
2.2 辐射处理对兜兰小苗的影响
2.2.1 辐射处理对兜兰小苗生长的影响 将辐射后的兜兰小苗移栽到温室中培养,纪录辐射后生长情况,见表4。与对照组相比,5 Gy剂量下的株高和根系生长量与对照组差异不显著,叶片鲜绿,长势好,未见明显的变异。10 Gy剂量下,少数出现叶形变异。20 Gy~30 Gy剂量下,株高和根系生长量较对照差异极显著(P<0.01),株型、叶形和叶色都出现明显变异。但30Gy剂量下,小苗长势较差。40 Gy剂量下,植株长势极弱,畸形严重,难以维持继续生长,结合生长和表型变异情况,得出兜兰小苗阶段适宜的辐射剂量为20 Gy。

表4 不同剂量辐射处理对兜兰小苗生长的影响
2.2.2 辐射处理对兜兰小苗电导率和丙二醛的影响 随着辐射剂量的增大,相对电导率表现出逐渐先升高后下降的趋势,见图5。0~20 Gy处理下,各组之间差异极显著(P<0.01)。剂量为20 Gy时,达到最大值,与对照相比增加163.33%,差异极显著(P<0.01),20、30、40 Gy剂量下,相对电导率略有下降,差异不显著。
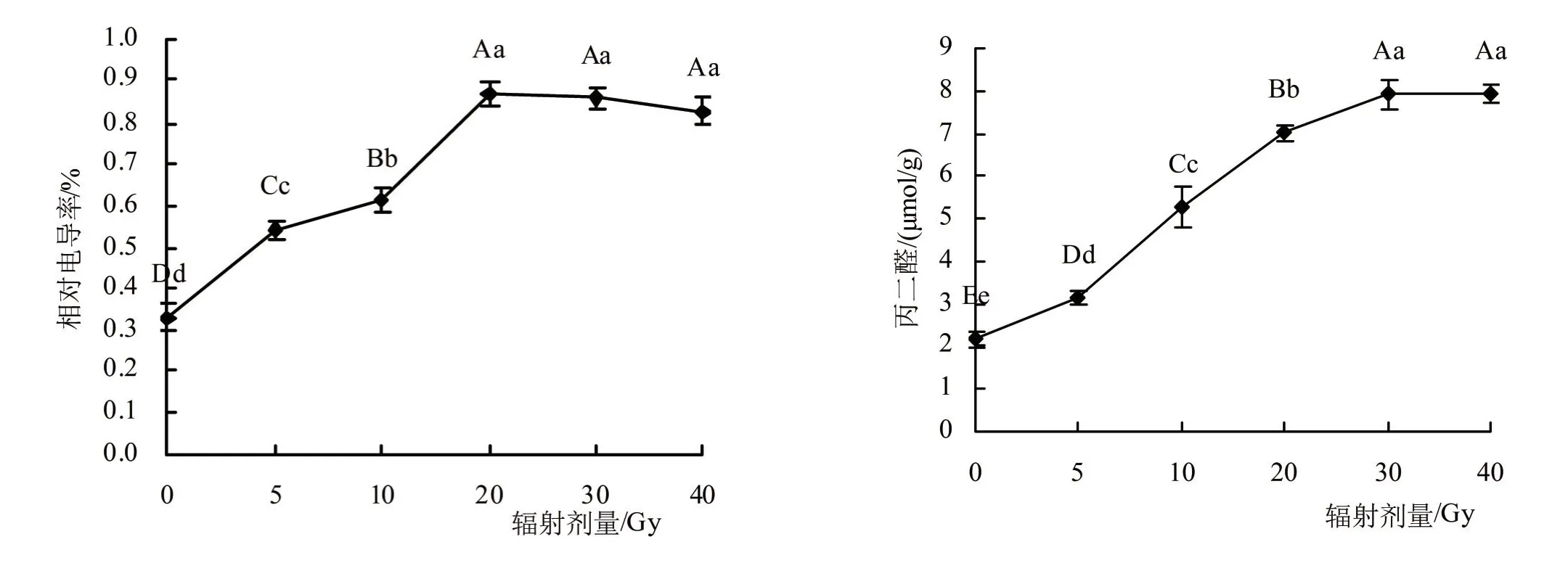
图5 不同剂量辐射处理对兜兰电导率和丙二醛的影响
随着辐射剂量的增大,MDA含量呈现逐步增加的趋势,见图5。辐射剂量为10 Gy时,MDA较前一剂量值增加67.73%,变化幅度较大。当辐射剂量为30 Gy时,MDA达到最大值,较对照组增加268.67%,差异极显著(P<0.01)。30、40 Gy剂量时,MDA变化差异不大,说明已接近峰值。
2.2.3 辐射处理对兜兰小苗渗透调节物质的影响 随着辐射剂量的增大,渗透调节物质呈现出先升高再降低的趋势,见表5。可溶性糖、可溶性蛋白在辐射剂量为20 Gy时,含量最高,分别较对照组增加188.54%和221.85%。与其他组差异极显著(P<0.01)。脯氨酸在辐射剂量为30 Gy时达到峰值,较对照组增加了157.39%。20 Gy和30 Gy剂量下差异不显著。辐射剂量为40 Gy时,可溶性蛋白的含量较对照组减少8.06%,说明辐射剂量达到一定阈值,可溶性蛋白质合成受到严重抑制,辐射对小苗的损伤严重。
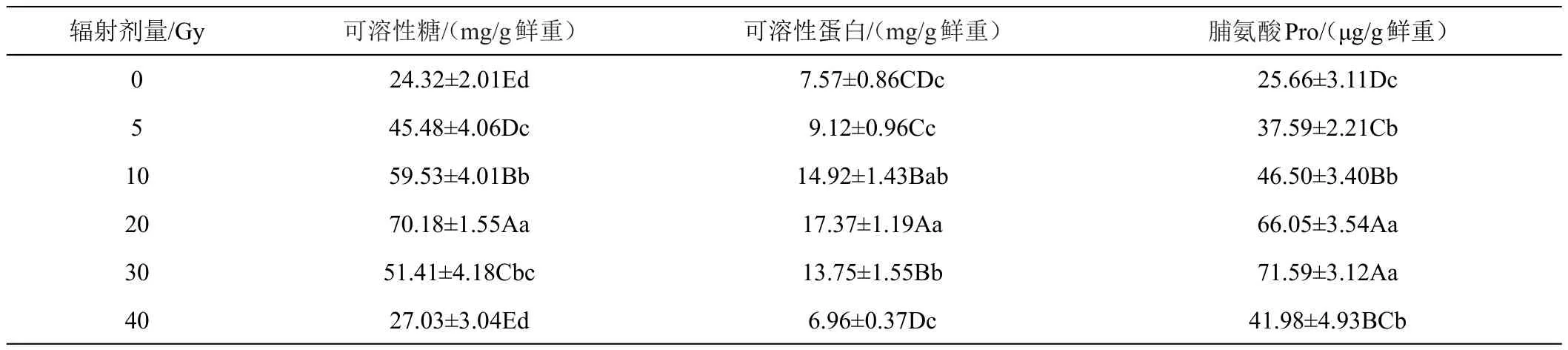
表5 不同剂量辐射处理下兜兰3种渗透调节物质的变化情况
2.2.4 辐射处理对兜兰小苗抗氧化酶活性的影响 随着辐射剂量的增大,超氧化物歧化酶(SOD)和过氧化物酶(POD)活性表现为先升高再降低的趋势,见表6。辐射剂量为10 Gy时,SOD和POD酶活性最高,与对照组相比分别增加190.03%、45.18%,差异极显著(P<0.01)。辐射剂量为5 Gy、30 Gy时,SOD和POD活性差异不大,较对照组分别增加109.67%、15.32%。在辐射剂量为40 Gy时,SOD和POD酶的活性均低于对照,说明辐射处理对兜兰叶片抗氧化酶活性具有一定的促进作用,但当辐射剂量过高时,会减少其活性增加量甚至降低活性值。

表6 不同剂量辐射处理下兜兰抗氧化酶活性的影响
综合小苗的生长和各项生理生化指标,得出兜兰小苗阶段适宜的辐射剂量为20 Gy。
3 讨论与结论
不同辐射剂量对植物不同发育时期、不同组织部位产生的影响各不相同,辐射剂量较低,难以获得预期的诱变效果,但随着辐射剂量的增加,植株变异率增加,植株死亡率也随之提高,因此合适的辐射剂量的选择对提高辐照育种效率具有指导意义[14]。目前对植物辐射育种的研究发现不同照射材料对射线的敏感性不一,对射线的敏感性大小依次为试管苗>田间苗>根芽>插条>种子[15]。但试管苗具体发育时期的适宜辐射剂量并没有详细报道。本研究首次采用60Co-γ射线对兜兰不同发育时期的植株进行辐射诱变,通过辐射后植株形态和生理生化指标的变化,筛选适宜的辐射剂量,期望获得多种变异类型的新材料。
研究发现兜兰不同发育时期对辐射的敏感性差别较大。种子阶段和不定根分化阶段对60Co-γ的敏感性较高,而不定芽分化和小苗阶段的敏感性相对较低。目前没有明确报道试管苗不同时期对辐射敏感性的差异,因此后续需要进一步验证。
随着辐射剂量的增加,兜兰种子萌发率、成苗率、发芽势均呈下降趋势。成苗率明显小于发芽率,这是因为辐射对种子内部结构造成损伤,种子虽能发芽,但生长的抑制作用逐渐表现出来,后期成苗能力降低,这与冯琪等[16]在研究60Co-γ对花葵种子萌发的影响中的结果一致。随着辐射剂量的增加,兜兰不定芽增殖率受到显著抑制,增殖时间延长,说明辐射后细胞修复需要一定时间,这与王晶等[7]在研究60Co-γ对菊花组培苗诱变效应中的结果一致。对植物进行辐射育种的研究发现,一定剂量的辐射对植物的生长有促进作用[17],彭梦婕等[18]在通过研究60Co-γ对紫薇幼苗的辐射效应时发现,0~60 Gy剂量下,幼苗的叶绿素含量升高,对生长有促进作用。本研究发现,5 Gy时,兜兰分化苗叶片浓绿,变厚,生长健壮,与紫薇的报道类似,但是否有助于提高光合速率,利于光合反应,还需要进一步验证。辐射剂量超过30 Gy时,增殖率和苗高较对照下降显著,幼苗出现黄叶、花叶等的变异,长势弱,推测叶绿体结构遭到破坏,叶绿素含量降低,不利于生长,这与在扁穗雀[19]、大花秋葵和锦葵[20]中的研究结果一致。李瑜等[21]对桂花幼苗的研究发现,低剂量的γ射线会使根长和根系活力有一个较小的上升趋势,本研究中5 Gy剂量下的根系活力较对照组高,与李瑜的报道一致,但根长短于对照组,可能物种差异,导致辐射效应不同。一定剂量的60Co-γ辐射会使植物细胞结构和功能发生变化,进而引起外部形态的改变[22-23]。本研究中,兜兰植株在辐射后出现低矮、花叶,卷曲或裂叶等变异,诱变效应显著。同样,60Co-γ辐射对植株外部形态的改变在菊花、观赏海棠、水仙、君子兰、、月季、等[7-8,24-26]都有报道。
植物受到冷害、盐渍、辐射等逆境时,首先表现在对生物膜系统的伤害,细胞膜透性和选择性发生改变或破坏,细胞间的物质转移发生紊乱[27-28]。另一方面,生成自由基与活性氧,产生对细胞有毒害作用的物质[29-30]。60Co-γ射线辐射育种研究中,辐射后植物材料的生理生化指标的变化可作为判断辐射育种效果的依据。本研究中5~20 Gy的剂量下,兜兰小苗的电导率、渗透调节物质等增加,MDA含量升高,说明低剂量辐射兜兰小苗积累渗透调节物质来增强对逆境的抵抗作用。当辐射剂量为20~30 Gy时,部分渗透调节物质如可溶性糖、可溶性蛋白含量较峰值略有下降,表明此时兜兰抵御逆境的机制仍在发挥作用,但合成效率降低,对辐射的抵御效果减弱。
当辐射剂量为30~40 Gy时,渗透调节物质含量下降显著,可能是高剂量的辐射处理对蛋白合成相关基因的表达产生抑制作用。而MDA含量持续升高,到40 Gy时含量接近平稳,说明造成了膜质过氧化损伤,致使机体活性氧与自由基积累增加,从而导致膜结构的完整性被破坏,这与水仙、百合、莴苣[24,31-32]中的结果一致,但在扁穗雀麦、桂花、苜蓿[19,21,33]等植物中MDA呈现先升高后降低的趋势。这与本研究有一定的印证作用,但也有不同之处,可能与材料差异有关。
SOD、POD等抗氧化物酶能够清除植物在逆境胁迫下产生的活性氧与自由基,但对植物毒害的调节保护作用存在一定的限度[34]。本研究中,兜兰的POD、SOD活性,均表现出先增加后降低的趋势,10 Gy时达到最大值,类似结果在紫薇[18]、蓝莓[34]、刺梨[35]中也有报道。但在露地菊的辐射研究中发现SOD活性呈现先上升后下降的趋势,而POD活性则持续上升[36]。40 Gy时,二者活性均低于对照组。推测低剂量的射线处理能够促进一系列修复酶的活性,缓解植物受损程度,而高剂量的射线对组织细胞损伤增加,当活性氧的产生积累超过植株个体的损伤阈值时,酶系统逐渐被破坏致使酶活性降低。
本研究首次探讨了60Co-γ对兜兰不同发育时期的诱变效应,筛选适宜辐射剂量。研究发现不同时期的兜兰组培苗对60Co-γ射线的耐受性不同,辐射处理对兜兰种子萌发、不定芽增殖、不定根分化以及小苗生长具有显著影响,诱导的变异性状明显。种子萌发阶段、不定根分化阶段对辐射的敏感度较高,适宜的辐射剂量分别为5 Gy。以诱变后成苗率与辐射剂量之间的相关性建立线性回归方程,得出兜兰种子半致死剂量为6.92 Gy。不定芽增殖率和小苗移栽阶段耐受性相对较高,适宜的辐射剂量为20 Gy。下一步拟对辐射诱变产生的变异苗进行培养,观察变异的稳定性,并进一步从中筛选兜兰新品种。本研究为兜兰辐射育种和种质创新提供了理论依据。
