多粘类芽胞杆菌分离鉴定及其对甘薯蔓割病的防治效果
2022-07-14徐颖华柴沙沙李成阳张文英王崇雷剑靳晓杰宋峥杨新笋王连军
徐颖华 柴沙沙 李成阳 张文英 王崇 雷剑 靳晓杰 宋峥 杨新笋 王连军




摘要:【目的】篩选对甘薯蔓割病病原菌具有拮抗作用的芽胞杆菌,为甘薯蔓割病的生物防治提供菌种资源。【方法】通过平板对峙法从玉米根际土壤中筛选对甘薯蔓割病病原菌具有拮抗作用的芽胞杆菌;通过生物学特征和16S rDNA序列分析对拮抗菌株进行分类鉴定;通过盆栽试验进行拮抗菌株对甘薯蔓割病的防效试验,并检测拮抗菌株对甘薯叶片脱落酸(ABA)和赤霉素(GA)含量,超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及可溶性蛋白含量的影响。【结果】从玉米根际土壤中分离获得1株乳白色且具有拮抗作用的芽胞杆菌,命名为HAAS05,通过16S rDNA鉴定及系统发育进化树比对分析,将HAAS05菌株鉴定为多粘类芽胞杆菌(Paenibacillus polymyxa)。盆栽试验结果显示,HAAS05菌株对甘薯蔓割病有明显的拮抗效果;OD600 nm=0.20和OD600 nm=0.40的HAAS05菌悬液处理第10 d后,甘薯叶片中ABA含量较仅接种病原菌处理(201.94 ng/g)显著降低(P<0.05,下同),分别为52.29和107.10 ng/g,而GA含量较仅接种病原菌处理(7.05 ng/g)显著升高,分别为8.10和10.31 ng/g,甘薯叶片SOD活性和可溶性蛋白含量均较仅接种病原菌处理显著升高,而POD活性变化无明显规律。【结论】多粘类芽胞杆菌HAAS05菌株对甘薯蔓割病有较好的拮抗作用,具有一定的开发应用潜力。
关键词: 甘薯;蔓割病;多粘类芽胞杆菌;生物防治
中图分类号: S435.313 文献标志码: A 文章编号:2095-1191(2022)04-1057-09
Isolation and identification of Paenibacillus polymyxa strain and its control effect on Fusarium bulbigenum of sweet potato
XU Ying-hua1,2, CHAI Sha-sha1, LI Cheng-yang1,2, ZHANG Wen-ying2,
WANG Chong1,2, LEI Jian1, JIN Xiao-jie1, SONG Zheng1,
YANG Xin-sun1, WANG Lian-jun1*
(1Food Crops Institute, Hubei Academy of Agricultural Sciences/Hubei Sweet Potato Engineering Technology Research Center/Hubei Provincial Key Laboratory of Food Crop Germplasm Innovation and Genetic Improvement, Wuhan,
Hubei 430064, China; 2College of Agriculture, Yangtze University, Jingzhou, Hubei 434025, China)
Abstract:【Objective】To screen Bacillus with antagonistic effect on Fusarium bulbigenum and provide strain resources for biological control of F. bulbigenum. 【Method】Bacillus antagonistic to F. bulbigenum was screened from maize rhizosphere soil by plate antagonism method; classification and identification by biological characteristics and 16S rDNA sequence analysis;the control effect of isolated strains against F. bulbigenum was tested by pot experiment, and the effects of isolated strains on the contents of abscisic acid (ABA) and gibberellin (GA), the activities of superoxide dismutase (SOD) and peroxidase (POD) and soluble protein of sweet potato leaves were detected. 【Result】A milky white strain with antagonistic effect was isolated from the rhizosphere soil of maize, named as HAAS05. Through 16S rDNA sequence analysis and phylogenetic tree analysis, HAAS05 strain was identified as Paenibacillus polymyxa. The biocontrol experiment of strain HAAS05 was carried out by pot experiment, and the hormone content, enzyme activity and soluble protein content of the tested plants were detected. The results of pot experiment showed that HAAS05 strain had obvious antagonistic effect on F. bulbigenum. After 10 d treatment with HAAS05 bacterial suspensions with OD600 nm=0.20 and OD600 nm=0.40, the ABA content in sweet potato leaves was significantly lower than that in the treatment only inoculated with pathogens (201.94 ng/g) (P<0.05, the same below), which were 52.29 and 107.10 ng/g, respectively. The GA content was significantly higher than that in the treatment that only inoculated with pathogens (7.05 ng/g), which were 8.10 and 10.31 ng/g, respectively. The SOD activity and soluble protein content in sweet potato leaves were significantly higher than those in the treatment only inoculated with pathogens. There was no significant change in the content of POD enzyme in the plant. 【Conclusion】P. polymyxa HAAS05 has good biocontrol effect on F. bulbigenum and has certain application and development potential.
Key words:sweet potato; Fusarium bulbigenum; Paenibacillus polymyxa; biological control
Foundation items:National Key Research and Development Program of China(2019YFD1001300,2019YFD100 1305); National Modern Agriculture Industry Technology System Construction Special Project(CARS-10); Hubei Key Research and Development Project (2020BHB024)
0 引言
【研究意义】甘薯[Ipomoea batatas(L.) Lam.]是旋花科(Convolvulaceae)甘薯属一年或多年生草本植物,具有高产、稳产、适应性广、抗逆性强、营养丰富、用途广泛等优良品质(王欣等,2021)。我国是世界上最大的甘薯种植国,甘薯富含淀粉、花青素、维生素、可溶性糖等营养物质,是重要的粮食和经济作物之一(Park et al.,2015;周志林等,2020)。甘薯蔓割病又称镰刀菌枯萎病,是由尖孢镰刀菌甘薯专化型(Fusarium oxysporum f. sp. batatas)引起的甘薯维管束真菌病害,主要分布于浙江、福建、广东、广西等省(区),近年来有向长江中下游区域漫延的趋势,一般造成10%~20%的产量损失(方树民和陈玉森,2004;刘中华等,2017)。甘薯发病后,其植株的根、主蔓、支蔓和叶柄等不同部位会出现纵裂,发病越早受害越重(刘中华等,2015)。目前,防治甘薯蔓割病主要通过生物防治和化学防治,但化学农药的使用容易造成病原菌产生抗药性、作物品质下降、土壤盐渍化等一系列问题,因此亟需开发高效、环境友好的生物防治产品。【前人研究进展】对芽胞杆菌能抑制植物病原菌的研究始于20世纪90年代,Fiddaman和Rossall(1993)首次发现枯草芽胞杆菌NCIMB 12376菌株能通过释放抗菌挥发物质抑制立枯丝核菌的生长。目前芽胞杆菌被证实在防控植物病害方面有明显效果,具有分布广、抗病性强、耐受性好等优点,在农业生产领域得到广泛应用(李法喜和段廷玉,2021)。李文鹏等(2020)从黄萎病抗性棉(海7124)根系土壤中分离得到1株对棉花黄萎病具有良好防治效果的芽胞杆菌HT-7菌株,对峙试验结果显示,HT-7菌株对棉花黄萎病病原大丽轮枝菌的抑菌率达56.00%;采用HT-7菌株进行土壤处理后对棉花黄萎病的防治效果达82.58%。陈云云等(2021)从荒漠沙土中分离、筛选得到萎缩芽胞杆菌MQ19ST15,其能显著抑制甘蓝枯萎病病原菌的菌丝生长,抑菌率达54.95%。冶福春等(2021)在燕麦生境中分离得到的枯草芽胞杆菌Qh-618对多种病原真菌具有较强的抑菌活性,对燕麦叶斑病的防治效果达58.57%,且能促进燕麦生长。目前研究较多的芽胞杆菌种类有枯草芽胞杆菌(Bacillus subtilis)、苏云金芽胞杆菌(B. thuringiensis)、侧孢芽胞杆菌(B. laterosporus)、解淀粉芽胞杆菌(B. amyloliquefaciens)及多粘类芽胞杆菌(Paenibacillus polymyxa)等(王刘庆等,2013;邢芳芳等,2014;李恩琛等,2020;耿丽丽等,2021;邱益彬等,2021)。研究发现,芽胞杆菌主要通过以下4个方面对植物促生防病:(1)产生植物生长调节物质,促进植物生长发育。郭立佳等(2020)从香蕉根际土壤中分离得到解淀粉芽胞杆菌JK05,其能以色氨酸为前体合成生长素吲哚乙酸,促进植物生长,并产生表面活性素、伊枯草菌素和丰原素等脂肽抗生素,对多种病原菌具有拮抗作用;(2)产生嗜铁素和解磷等物质促进植物对营养物质的吸收。余贤美等(2009)从海南岛橡胶树根际土壤中分离得到1株枯草芽胞杆菌CAS15,其能产生儿茶酚型嗜铁素,对常见的15种病原菌均具有拮抗作用;(3)調节植物代谢系统,诱导植物对病原菌产生抗性。郭芳芳等(2014)从柳杉中分离得到1株多粘类芽胞杆菌CF05,该菌株对9种植物病原真菌具有显著的拮抗效果;金莉萍(2016)进一步研究发现,CF05菌株接种在番茄根部后,可通过调节苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化物酶(POD)和苯酚等植物诱导抗性关键酶活性,从而增强植株抗病性;(4)诱导植株产生对生物与非生物胁迫的抗性。Archontia(2011)在番茄上接种促进植物生长的枯草芽胞杆菌来增强番茄植株的耐盐性。多粘类芽胞杆菌已被发现在苹果、番茄、水稻和黄瓜等作物生产上可通过产生杀菌物质、诱导植物产生系统抗性等途径发挥生物防治作用(Young et al.,2016;郭赛赛和张敬泽,2019;Mumpuni and Rohmah,2021;Zhai et al.,2021;Zhang et al.,2021)。【本研究切入点】甘薯蔓割病是我国南方薯区较严重的病害,制约了当地甘薯产业的发展。目前,通过生物防治甘薯蔓割病的研究报道较少。【拟解决的关键问题】通过平板对峙法从玉米根际土壤中筛选对甘薯蔓割病病原菌具有拮抗作用的芽胞杆菌,根据生物学特征、16S rDNA序列分析对拮抗菌株进行初步鉴定;通过盆栽试验进行拮抗菌株对甘薯蔓割病的防效试验,并检测拮抗菌株对甘薯植株相关激素含量、酶活性及可溶性蛋白含量等的影响,为甘薯蔓割病的生物防治提供菌种资源。
1 材料与方法
1. 1 试验材料
供试甘薯品种鄂薯16由湖北省农业科学院粮食作物研究所提供,该品种对甘薯蔓割病表现感病。供试甘薯蔓割病病原菌由江苏徐淮地区徐州农业科学研究所甘薯研究中心提供。供试培养基:PDA和LB培养基。
1. 2 甘薯蔓割病病原菌活化
将甘薯蔓割病病原菌接种到PDA培养基上,28 ℃培养4~5 d进行活化,备用。
1. 3 芽胞杆菌的分离及筛选
2021年6月从湖北省农业科学院粮食作物研究所玉米种植基地采集玉米根际土壤样品(苏宝玲等,2000),采用土壤稀释法(宋喜乐等,2016)分离细菌,根据菌落形状、大小和颜色等特征进行初步归类,每类随机挑取3~5个单菌落划线纯化,并制成菌悬液置于80 ℃水浴中处理10 min,仍能成活的菌株经芽胞染色验证后保存于4 ℃冰箱,备用。
采用平板对峙法测定分离菌株对甘薯蔓割病病原菌的抑菌活性。待病原菌长满平板后,挑取5 mm菌片适量菌丝接种到PDA培养基中,并在距离菌丝约3 cm处接种分离得到的芽胞杆菌,28 ℃培养3~4 d后观察芽胞杆菌对甘薯蔓割病病原菌的抑菌情况,对分离得到的芽胞杆菌进行筛选。
1. 4 分离菌株鉴定
以筛选到的芽胞杆菌菌液DNA为PCR反应的DNA模板,选用细菌16S rDNA通用引物27F(5'-AG AGTTTGATCCTGGCTCAG-3')和1492R:(5'-ACG GCTACCTTGTTACGACTT-3')(张鸽等,2018)进行PCR扩增。PCR产物用1%琼脂糖凝胶电泳检测。回收DNA后委托武汉奥科鼎盛生物科技有限公司进行测序。将得到的序列结果通过NCBI数据库进行BLAST同源性比对,并选取相似性较高的序列,通过MEGA 7.0(Bootstrap值为1000次)构建分离菌株的系统发育进化树。
1. 5 盆栽防治试验
1. 5. 1 芽胞杆菌孢子悬浮液制备 将分离获得的芽胞杆菌菌株接种于LB液体培养基中,28 ℃下200 r/min振荡培养48 h后,4000 r/min离心2 min取上清,配制成OD600 nm为0.20和0.40的孢子悬浮液,待用。
1. 5. 2 病原菌孢子悬浮液制备 取甘薯蔓割病病原菌接种到PDA液体培养基中,28 ℃下200 r/min培养48 h,离心收集菌体并用灭菌生理盐水配制成菌悬液(1×108 CFU/mL),待用。
1. 5. 3 土壤基质制备 将蛭石、田间土和细沙按质量比1∶1∶1混匀,置于鼓风干燥箱中120 ℃下60 min灭菌2次,制备成混合土壤,每500 g混合土壤加入20 mL甘薯蔓割病病原菌悬浮液并混匀,备用。
1. 5. 4 病原菌接种 将甘薯茎基部新鲜切口浸入不同浓度的分离菌株悬浮液(OD600 nm分别为0、0.20和0.40)中,15 min后取出晾干,然后浸入甘薯蔓割病病原菌悬浮液接种15 min,取出晾干后,再次分别浸入不同浓度的分离菌株悬浮液中15 min,根据分离菌株OD600 nm分别记为F.w、F.w+0.2H和F.w+0.4H处理,随后取出扦插于盆中,置于培养箱,浇水保湿,在25~27 ℃、光周期10 L∶14 D下培养,保持土壤水分10%左右;以只用无菌水处理为对照(CK)。当F.w处理植株多数枯死时,剖茎检查所有插条维管束变褐程度,结合观察地上部生长情况。
1. 5. 5 激素含量测定 处理后第10 dF.w处理出现明显症状,取植株顶端第4~5片展开叶,-80 ℃保存。称取0.1 g新鲜甘薯叶片组织,在液氮中充分研磨,加入样本体积9倍的pH 7.4的PBS缓冲液,于冷冻离心机中4 ℃下8000 r/min离心30 min,取上清保存于4 ℃,待用;使用酶联免疫吸附测定法(ELISA)试剂盒(泉州市睿信生物科技有限公司)定量测定甘薯叶片脱落酸(ABA)和赤霉素(GA)含量。
1. 5. 6 酶活性及可溶性蛋白含量测定 处理后第10 d F.w处理出现明显症状,取植株顶端第4~5片展开叶,-20 ℃保存。使用羟胺法试剂盒(南京建成生物工程研究所)测定甘薯叶片超氧化物歧化酶(SOD)活性;比色法试剂盒(南京建成生物工程研究所)测定POD活性;以牛血清白蛋白为标准蛋白质,考马斯亮蓝G-250法测定叶片可溶性蛋白含量。
1. 6 统计分析
利用Excel 2019和IBM SPSS 22.0进行图表制作和数据统计分析,采用Duncan’s新复极差法进行试验数据差异显著性检验。
2 结果与分析
2. 1 拮抗芽胞杆菌分离及鉴定结果
以甘薯蔓割病病原菌为指示菌,采用平板对峙法从玉米根际土壤中分离获得1株具有拮抗作用的芽胞杆菌,命名为HAAS05。HAAS05菌株在PDA培养基上呈乳白色,不透明,略微干燥(图1)。PCR扩增结果,获得1条1548 bp的目的条带。通过16S rDNA鉴定及系统发育进化树(图2)比对分析,发现HAAS05菌株与多粘类芽胞杆菌聚为一支,同源性较高,与其他菌亲缘关系较远。结合生物学特征观察及16S rDNA序列分析,将HAAS05菌株鉴定为多粘类芽胞杆菌。
2. 2 HAAS05菌株对甘薯蔓割病病原菌菌丝生长的影响
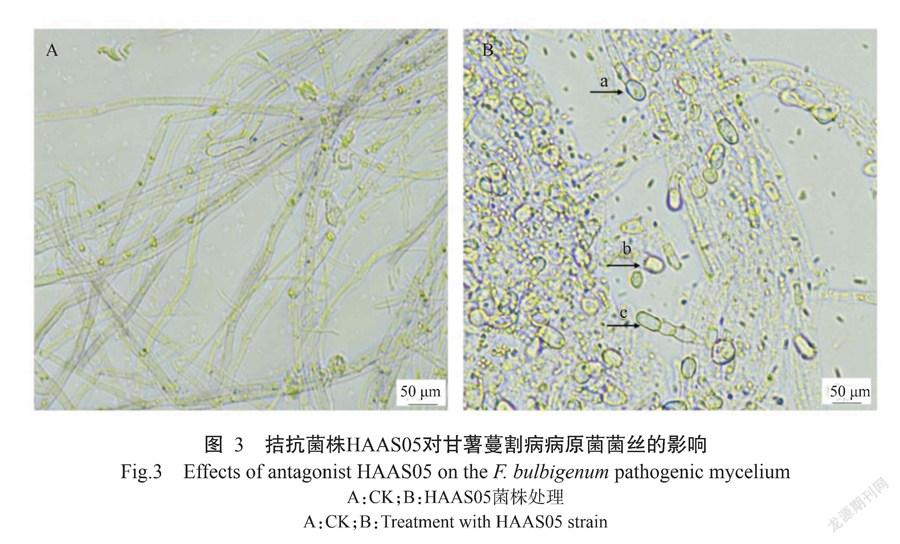
甘薯蔓割病病原菌受HAAS05菌株抑制后,菌落边缘停止生长,菌落颜色加深;显微观察HAAS05菌株对甘薯蔓割病病原菌菌丝的影响,结果发现,甘薯蔓割病病原菌受到抑制后菌丝出现末端膨大、菌丝断裂和节间缩短等现象(图3)。
2. 3 HAAS05菌株对盆栽甘薯蔓割病的防治效果
处理10 d后CK甘薯植株生长状况良好,其叶片翠绿,根系发育正常,茎蔓正常且形成较多吸收根;F.w处理组植株叶片发黄,萎蔫脱落,出现极少量短小吸收根,茎蔓开裂,出现明显的蔓割病病症;F.w+0.2H处理下的植株相对F.w处理植株葉片明显变绿,茎蔓完整且根系出现稀疏的吸收根,但与CK处理植株相比病征依旧明显;而F.w+0.4H处理的植株具有与F.w处理相似的表型病征,如叶片发黄、萎蔫脱落、茎蔓部分开裂,不同的是,F.w+0.4H处理相对F.w处理有更长、更多的吸收根形成(图4)。
2. 4 HAAS05菌株对甘薯植株内源激素含量的影响
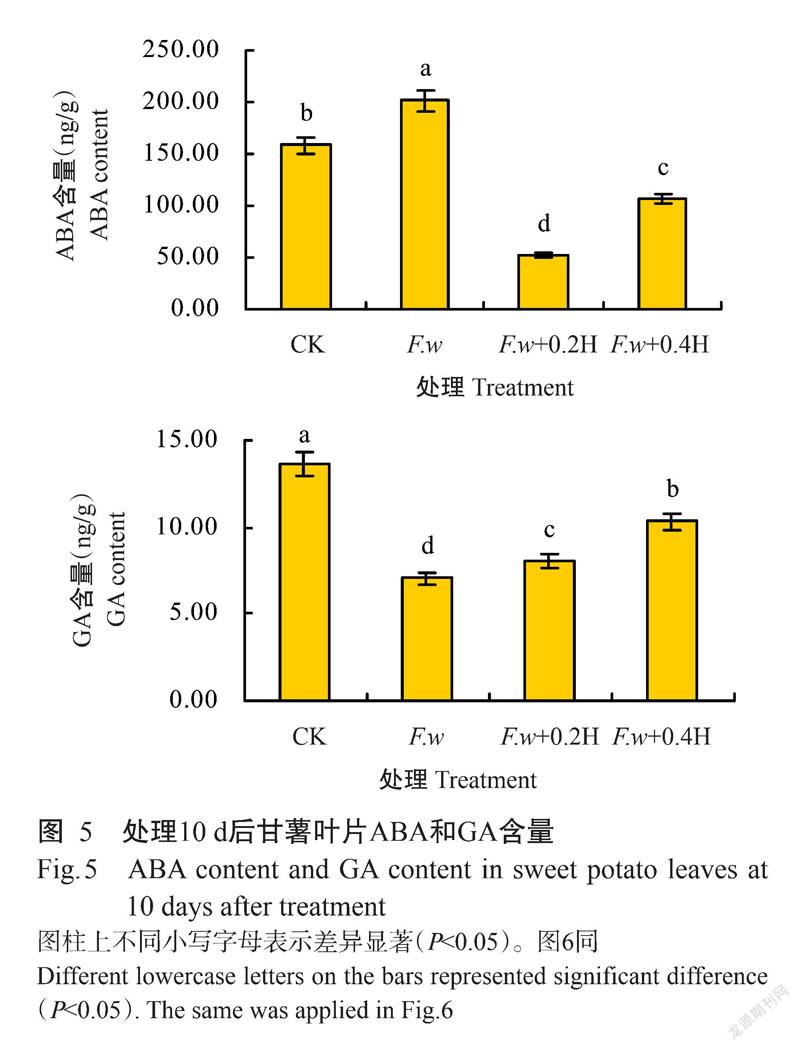
植物激素是根系生长发育的主要影响因素,甘薯植株在处理后第10 d发生明显病征时,甘薯叶片的内源ABA和GA含量均与CK差异显著(P<0.05,下同),其中F.w处理的ABA含量最高,为201.94 ng/g,CK(158.27 ng/g)和F.w+0.4H(107.10 ng/g)处理次之,F.w+0.2H处理(52.29 ng/g)最低且显著低于其他处理;GA含量以CK最高,为13.66 ng/g,F.w+0.4H(10.31 ng/g)和F.w+0.2H(8.10 ng/g)处理次之,F.w处理(7.05 ng/g)最低且显著低于其他处理(图5)。
2. 5 HAAS05菌株对甘薯植株抗氧化酶活性及可溶性蛋白含量的影响
甘薯植株在处理后第10 d发生明显病征时,甘薯叶片的SOD和POD活性及可溶性蛋白含量均与CK差异显著,其中,F.w+0.2H处理的SOD活性最高,为80.61 U/g,F.w+0.4H和F.w处理次之,CK处理最低,为17.54 U/g,各处理间差异显著;F.w+0.4H处理下甘薯叶片的POD活性最高,为457.28 ΔA470/(min·mg),F.w和F.w+0.2H处理次之,CK最低,为94.74 ΔA470/(min·mg),各处理间差异显著;对甘薯叶片可溶性蛋白含量测定发现,CK的叶片可溶性蛋白含量最高,为27.81 mg/g,F.w+0.2H和F.w+0.4H处理次之,F.w处理最低,为9.48 mg/g,各处理间差异显著(图6)。
3 讨论
植物受到病原菌侵染后会诱导组织结构发生变化,以遏制病原菌的侵入、输导和繁殖,从而使植株产生抗病性(Saur and Hückelhoven,2021)。有研究表明,甘薯蔓割病病原菌可能破坏甘薯根系的膜系统,造成代谢紊乱,从而抑制了根细胞营养和水分的吸收及运输,造成根系发育不完全(雷剑等,2011)。张鸿等(2016)通过T-DNA随机插入法获得3株甘薯蔓割病生防菌株。本研究结果显示,接种蔓割病病原菌的甘薯植株几乎无吸收根形成且茎蔓有明显开裂,吸收根发育不全对植株营养物质的吸收、合成和输导造成影响,导致整株大量叶片发黄并脱落,生长停滞呈现病态;而接种OD600=0.20的HAAS0菌株孢子悬浮液后植株病情明显好转,有更多的吸收根形成且茎部无开裂,虽有少部分叶子脱落,但整体上叶片呈绿色,相对于对CK依旧存在病征,而对比接种甘薯蔓割病病原菌的F.w处理,甘薯蔓割病病情得到极大改善;然而,接种更高浓度HAAS05菌株的F.w+0.4H处理出现与F.w处理相似的地上部病征,地下部的吸收根增多且茎部开裂减少,提高浓度其防治效果反而不如低浓度处理明显,说明HAAS05菌株对甘薯蔓割病有一定的防治效果,但本研究中高浓度的芽胞杆菌会产生抑制作用暂无相关报道。
众多研究发现,植物病原真菌侵染宿主植物能造成内源激素含量发生变化(柴一秋等,2007)。据报道,甘薯感染根腐病菌(F. solani f. sp. batatas)后内源ABA含量显著升高,GA含量显著下降(李鹏,2009);黑穗病菌侵染甘蔗后,甘蔗幼苗叶片内ABA含量显著升高(莫凤连等,2012);芒果感染细菌性角斑病后ABA和GA含量在感病品种贵妃芒中显著下降(姚全胜等,2020)。前人的研究中将ABA称为逆境激素(Larkindale and Knight,2002),GA则是促进细胞伸长生长的关键激素(Hedden and Thomas,2012);本研究发现,与CK相比,接种甘薯蔓割病病原菌的甘薯植株ABA含量显著升高,而接种HAAS05菌株的发病植株的内源ABA含量显著降低,且低浓度HAAS05菌株处理下的ABA含量显著低于高浓度处理;GA作为刺激植物细胞伸长、促进细胞分裂的关键内源激素,本研究中以CK处理下的含量最高,受甘薯蔓割病病原菌侵染的植株GA含量最低,接種了HAAS05菌株的病株GA含量较未接种HAAS05菌株的病株显著提高。接种HAAS05菌株的植株,相比于受到甘薯蔓割病病原菌侵染的植株,内源ABA含量降低且GA含量升高,说明接种HAAS05菌株的植株抗胁迫能力提升,病征得以缓解。
抗病反应不仅与生防菌产生的拮抗物质有关,也与防御系统产生的酶息息相关,参与植物体内生理代谢的SOD、POD活性和可溶性蛋白含量反映了植株受胁迫程度,其酶活性提高和蛋白含量的升高,对病原菌的传导形成阻碍屏障,进而维持活性氧系统的平衡,是检验植株抗性的重要指标(Gao et al.,2018;曹鹏飞和刘青娥,2021)。前人研究发现,接种致病菌后植株中防御酶活性和可溶性蛋白含量呈现不同程度的升高(韩冰等,2012;Palazzini et al.,2016)。本研究中,与CK相比,F.w处理的SOD活性更高但低于F.w+0.2H和F.w+0.4H处理,其POD活性低于F.w+0.4H处理但高于F.w+0.2H处理,其可溶性蛋白含量最低;而F.w+0.2H处理的甘薯叶片SOD活性和可溶性蛋白含量较其他2个处理组更高,说明HAAS05菌悬液处理强化了防御系统酶作用和增加渗透调节物质以增强细胞保水能力。初步分析认为,HAAS05菌株通过影响甘薯叶片抗氧化酶活性,介导SOD活性、POD活性和可溶性蛋白含量,正向调控发病植株生长发育。在盆栽致病性试验中,观察到低浓度的HAAS05菌株孢子悬浮液能有效诱导植物对甘薯蔓割病病原菌产生抗性,接种HAAS05菌株后促进植株内源激素的产生,在防御酶的参与作用下共同抵御植物病害的侵染从而起到防治作用,具有作为植物杀菌剂的潜力。
4 结论
多粘类芽胞杆菌HAAS05菌株在实验室和盆栽试验中对甘薯蔓割病病原菌均表现出较好的拮抗作用,具有较好的环境稳定性,表明HAAS05菌株具有作为植物杀菌剂的潜力,具有较好的应用前景。
参考文献:
曹鹏飞,刘青娥. 2021. 杨梅枯萎病拮抗内生菌的分离及其抑菌机制研究[J]. 河南农业科学,50(4):96-105. [Cao P F,Liu Q E. 2021. Isolation of antagonistic endophytes against Myrica rubra wilt and their antagonistic mechanism[J]. Journal of Henan Agricultural Sciences,50(4):96-105.] doi:10.15933/j.cnki.1004-3268.2021.04.013.
柴一秋,陈利锋,王金生. 2007. 甘薯根腐病菌侵染对甘薯内源激素水平的影响[J]. 植物生理与分子生物学学报,33(4):318-324. [Chai Y Q,Chen L F,Wang J S. 2007. The effect of infection by Fusarium solani f. sp. batatas on endogenous hormone levels in sweet potato seedling[J]. Journal of Plant Physiology and Molecular Biology,33(4):318-324.] doi:10.3321/j.issn:1671-3877.2007.04. 007.
陈云云,李惠霞,张海英,徐生军,刘永刚. 2021. 萎缩芽胞杆菌MQ19ST15鉴定及对甘蓝枯萎病的盆栽防效[J]. 植物保护,47(5):64-71. [Chen Y Y,Li H X,Zhang H Y,Xu S J,Liu Y G. 2021. Identification of Bacillus atrophaeus MQ19ST15 and its control efficacy against Fusarium wilt on potted cabbage plants[J]. Plant Protection,47(5):64-71.] doi:10.16688/j.zwbh.2020565.
方树民,陈玉森. 2004. 福建省甘薯蔓割病现状与研究进展[J]. 植物保护,30(5):19-22. [Fang S M,Chen Y S. 2004. Advances in the research of sweet potato Fusarium wilt in Fujian Province[J]. Plant Protection,30(5):19-22.] doi:10.3969/j.issn.0529-1542.2004.05.004.
耿丽丽,陶岭梅,张宏军,张杰. 2021. 苏云金芽胞杆菌安全性的研究进展[J]. 中国生物防治学报,37(1):2-10. [Geng L L,Tao L M,Zhang H J,Zhang J. 2021. Research progress on the safety of Bacillus thuringiensis[J]. Chinese Journal of Biological Control,37(1):2-10.] doi:10.16409/j.cnki.2095-039x.2021.01.022.
郭芳芳,謝镇,卢鹏,郭岩彬,张立钦,王勇军. 2014. 一株多粘类芽孢杆菌的鉴定及其生防促生效果初步测定[J]. 中国生物防治学报,30(4):489-496. [Guo F F,Xie Z,Lu P,Guo Y B,Zhang L Q,Wang Y J. 2014. Identification of a novel Paenibacillus polymyxa strain and its biocontrol and plant growth-promoting effects[J]. Chinese Journal of Biological Control,30(4):489-496.] doi:10.16409/ j.cnki.2095-039x.2014.04.011.
郭立佳,汪军,杨腊英,梁昌聪,周游,刘磊,黄俊生. 2020. 芽胞杆菌JK05的鉴定及其对香蕉、玉米的促生和生防潜能研究[J]. 热带作物学报,41(2):351-358. [Guo L J,Wang J,Yang L Y,Liang C C,Zhou Y,Liu L,Huang J S. 2020. Identification of Bacillus JK05,analysis of its biocontrol potential and roles in plant growth promotion of banana (Musa spp.) and maize (Zea mays L.)[J]. Chinese Journal of Tropical Crops,41(2):351-358.] doi:10.3969/j.issn.1000-2561.2020.02.020.
郭赛赛,张敬泽. 2019. 多粘类芽孢杆菌及其脂肽化合物研究进展[J]. 农药学学报,21(S):787-798. [Guo S S,Zhang J Z. 2019. Research progress of Paenibacillus polymyxa and its lipopeptide compounds[J]. Chinese Journal of Pesticide Science,21(S):787-798.] doi:10.16801/j.issn. 1008-7303.2019.0093.
韩冰,郭世荣,贺超兴,闫妍,于贤昌. 2012. 丛枝菌根真菌对盐胁迫下黄瓜植株生长、果实产量和品质的影响[J]. 应用生态学报,23(1):154-158. [Han B,Guo S R,He C X,Yan Y,Yu X C. 2012. Effects of arbuscular mycorrhiza fungi (AMF) on the plant growth,fruit yield,and fruit quality of cucumber under salt stress[J]. Chinese Journal of Applied Ecology,23(1):154-158.] doi:10.13287/j.1001- 9332.2012.0021.
金莉萍. 2016. 多粘类芽孢杆菌生防促生机制研究及发酵条件的优化[D]. 杭州:浙江农林大学. [Jin L P. 2016. Research on the mechanism in biological control of Paenibacillus polymyxa and optimization of fermentation condition[D]. Hangzhou:Zhejiang Agriculture and Forestry University.]
雷剑,杨新笋,郭伟伟,苏文瑾,王连军. 2011. 甘薯蔓割病研究进展[J]. 湖北农业科学,50(23):4775-4777. [Lei J,Yang X S,Guo W W,Su W J,Wang L J. 2011. Advance in research on sweet potato Fusarium wilt[J]. Hubei Agricultural Sciences,50(23):4775-4777.] doi:10.14088/j.cnki.issn0439-8114.2011.23.036.
李恩琛,张树武,徐秉良,刘佳,吉宝丽,唐仕娟. 2020. 3株生防细菌间亲和性测定及其对苹果树腐烂病菌的抑制作用[J]. 甘肃农业大学学报,55(5):94-100. [Li E C,Zhang S W,Xu B L,Liu J,Ji B L,Tang S J. 2020. Determination of affinity among three biocontrol bacteria and their inhibitory effect on Valsa mali[J]. Journal of Gansu Agricultural University,55(5):94-100.] doi:10.13432/j.cnki.jgsau.2020.05.011.
李法喜,段廷玉. 2021. AM真菌和其他4类有益微生物联合防治植物病害研究进展[J]. 中国草地学报,43(8):93-105. [Li F X,Duan T Y. 2021. Research progress in the control of plant diseases by the combination of fungi and beneficial microorganisms[J]. Chinese Journal of Grassland,43(8):93-105.] doi:10.16742/j.zgcdxb.20200430.
李鹏,马代夫,李强,张安. 2009. 甘薯根腐病的研究现状和展望[J]. 江苏农业科学,(1):114-116. [Li P,Ma D F,Li Q,Zhang A. 2009. Research progress and prospects of Ipo-moea batatas root rot[J]. Jangsu Agricultural Sciences,(1):114-116.] doi:10.3969/j.issn.1002-1302.2009.01.034.
李文鹏,陶冶,赵素雅,牛秋红. 2020. 芽孢杆菌HT-7对棉花黄萎病菌的拮抗作用及拮抗因子初探[J]. 河南农业科学,49(8):84-93. [Li W P,Tao Y,Zhao S Y,Niu Q H. 2020. Antagonism of Bacillus sp.HT-7 against Verticillium wilt of cotton and exploration of antagonistic factors[J]. Journal of Henan Agricultural Sciences,49(8):84-93.] doi:10.15933/j.cnki.1004-3268.2020.08.010.
刘中华,林志坚,李华伟,邱永祥,邱思鑫,张鸿,余华,蓝春准. 2017. 甘薯蔓割病抗性相关SRAP标记的获得[J]. 福建农业学报,32(6):639-644. [Liu Z H,Lin Z J,Li H W,Qiu Y X,Qiu S X,Zhang H,Yu H,Lan C Z. 2017. SRAP marker associated with Fusarium wilt resistance gene in sweet potato[J]. Fujian Journal of Agricultal Scien-ces,32(6):639-644.] doi:10.19303/j.issn.1008-0384. 2017.06.013.
劉中华,余华,邱思鑫,许泳清,邱永祥,李华伟. 2015. 蔓割病不同抗性甘薯品种的茎部细胞结构观察[J]. 植物遗传资源学报,16(3):541-548. [Liu Z H,Yu H,Qiu S X,Xu Y Q,Qiu Y X,Li H W. 2015. Study on the stem cell structure alteration of sweet potato varieties with different resistance to Fusarium wilt[J]. Journal of Plant Genetic Resources,16(3):541-548.] doi:10.13430/j.cnki.jpgr. 2015.03.016.
莫凤连,杨丽涛,潘如科,宋修鹏,李杨瑞. 2012. 甘蔗黑穗病菌胁迫对甘蔗内源激素含量的影响[J]. 南方农业学报,43(11):1676-1681. [Mo F L,Yang L T,Pan R K,Song X P,Li Y R. 2012. Changes of endogenous hormone content in sugarcane under smut pathogen stress[J]. Journal of Southern Agriculture,43(11):1676-1681.] doi:10. 3969/j:issn.2095-1191.2012.11.1676.
邱益彬,马艳琴,沙媛媛,朱逸凡,苏二正,雷鹏,李莎,徐虹. 2021. 解淀粉芽孢杆菌分子遗传操作及其应用研究进展[J/OL]. 生物技术通报. [Qiu Y B,Ma Y Q,Sha Y Y,Zhu Y F,Su E Z,Lei P,Li S,Xu H. 2021. Research progress on molecular genetic manipulation technology of Bacillus amyloliquefaciens and its application[J/OL]. Biotechnology Bulletin.] doi:10.13560/j.cnki.biotech.bull.1985. 2021-0447.
宋喜樂,赵世民,赵云波,江凯,康业斌. 2016. 洛阳地区烟草根际土壤中多粘类芽孢杆菌的分离与鉴定[J]. 烟草科技,49(12):13-20. [Song X L,Zhao S M,Zhao Y B,Jiang K,Kang Y B. 2016. Isolation and identification of Paenibacillus polymyxa from rhizosphere soil of tobacco plantation in Luoyang[J]. Tobacco Science and Techno-logy,49(12):13-20.] doi:10.16135/j.issn1002-0861.2016. 0118.
苏宝玲,韩士杰,王建国. 2000. 根际微域研究中土样采集方法的研究进展[J]. 应用生态学报,11(3):477-480. [Su B L,Han S J,Wang J G. 2000. Advance in soil sampling methods in rhizosphere microzone study[J]. Chinese Journal of Applied Ecology,11(3):477-480.] doi:10.13287/j. 1001-9332.2000.0118.
王刘庆,王秋影,廖美德. 2013. 多粘类芽孢杆菌生物特性及其机理研究进展[J]. 中国农学通报,29(11):158-163. [Wang L Q,Wang Q Y,Liao M D. 2013. The progress of biological properties and mechanisms of Paenibacillus polymyxa[J]. Chinese Agricultural Science Bulletin,29(11):158-163.] doi:10.3969/j.issn.1000-6850.2013.11. 031.
王欣,李强,曹清河,马代夫. 2021. 中国甘薯产业和种业发展现状与未来展望[J]. 中国农业科学,54(3):483-492. [Wang X,Li Q,Cao Q H,Ma D F. 2021. Current status and future prospective of sweetpotato production and seed industry in China[J]. Scientia Agricultura Sinica,54(3):483-492.] doi:10.3864/j.issn.0578-1752.2021.03.003.
邢芳芳,宋涛,徐文凤,徐春英,禚优优,李新柱,胡兆平. 2014. 侧孢芽孢杆菌在生防中的应用及研究进展[J]. 山东农业科学,46(6):146-149. [Xing F F,Song T,Xu W F,Xu C Y,Zhuo Y Y,Li X Z,Hu Z P. 2014. Application of Bacillus laterosporus in biological prevention and research advances[J]. Shandong Agricultural Sciences,46(6):146-149.] doi:10.3969/j.issn.1001-4942.2014.06.043.
姚全胜,郑磊,柳凤,詹儒林. 2020. 芒果细菌性角斑病病菌侵染对芒果内源激素含量的影响[J]. 中国植保导刊,40(11):19-22. [Yao Q S,Zheng L,Liu F,Zhan R L. 2020. Effects of Xanthomonas citri pv. mangiferaeindicae on endogenous hormone contents in mango[J]. China Plant Protection,40(11):19-22.] doi:10.3969/j.issn.1672-6820. 2020.11.003.
冶福春,马文林,杨晓龙. 2021. 枯草芽胞杆菌Qh-618对燕麦叶斑病防治效果研究[J]. 中国生物防治学报,37(4):785-795. [Ye F C,Ma W L,Yang X L. 2021. Control effect of Bacillus subtilis Qh-618 on oat leaf spot[J]. Chinese Journal of Biological Control,37(4):785-795.] doi:10.16409/j.cnki.2095-039x.2021.04.006.
余贤美,郑服丛,林超,贺春萍,张修国. 2009. 土壤产嗜铁素拮抗细菌CAS15的分离鉴定[J]. 植物保护学报,36(2):129-135. [Yu X M,Zheng F C,Lin C,He C P,Zhang X G. 2009. Isolation and identification of siderophore producing bacteria CAS15 from the soil[J]. Journal of Plant Protection,36(2):129-135.] doi:10.3321/j.issn:0577-7518.2009.02.006.
張鸽,梁开朝,辛玉华,王娟,李书贵,李爱军,王帆,张海波,刘好宝. 2018. 基于高通量测序和传统分离研究雪茄外包皮表面细菌多样性及演替[J]. 应用与环境生物学报,24(4):783-788. [Zhang G,Liang K C,Xin Y H,Wang J,Li S G,Li A J,Wang F,Zhang H B,Liu H B. 2018. Diversity and succession of bacteria during the fermentation of a cigar wrapper using high throughput sequencing technology and traditional isolation[J]. Chinese Journal of Applied & Environmental Biology,24(4):783-788.] doi:10.19675/j.cnki.1006-687x.2017.11014.
张鸿,林志坚,林赵淼,李国良,许泳清,刘中华,邱永祥,李华伟,纪荣昌,罗文彬,汤浩,邱思鑫. 2016. T-DNA随机插入法获得甘薯蔓割病菌非致病生防菌株[J]. 中国生物防治学报,32(5):610-618. [Zhang H,Lin Z J,Lin Z M,Li G L,Xu Y Q,Liu Z H,Qiu Y X,Li H W,Ji R C,Luo W B,Tang H,Qiu S X. 2016. Obtaining nonpathogenic biological control strains against sweetpotato Fusarium wilt by Agrobacterium-mediated transformation[J]. Chinese Journal of Biological Control,32(5):610-618.] doi:10.16409/j.cnki.2095-039x.2016.05.010.
周志林,唐君,曹清河,赵冬兰,张安. 2020. 淀粉专用型甘薯品质形成规律及其与主要农艺性状的相关性[J]. 江苏农业学报,36(2):277-283.[Zhou Z L,Tang J,Cao Q H,Zhao D L,Zhang A. 2020. Formation laws of quality characters in starch sweetpotato cultivars and its correlation with main agronomic characters[J]. Jiangsu Journal of Agricultural Sciences,36(2):277-283.] doi:10.3969/j.issn.1000-4440.2020.02.004.
Archontia S. 2011. About the action of metabolites of plant growth-promoting rhizobacteria Bacillus subtilis on plant salt tolerance[J]. Archives of Phytopathology and Plant Protection,44(19):1867-1882. doi:10.1080/0323540090 3345042.
Fiddaman P J,Rossall S. 1993. The production of antifungal volatiles by Bacillus subtills[J]. Journal of Applied Bacteriology,74(2):119-126. doi:10.1111/j.1365-2672.1993.tb03004.x.
Gao Y H,Guo R J,Li S D. 2018. Draft genome sequence of Bacillus velezensis B6,a rhizobacterium that can control plant diseases[J]. Genome Announcements,6(12):e00182-18. doi:10.1128/genomeA.00182-18.
Hedden P,Thomas S G. 2012. Gibberellin biosynthesis and its regulation[J]. Biochemical Journal,444(1):11-25. doi:10.1042/BJ20120245.
Larkindale J,Knight M R. 2002. Protection against heat stress-induced oxidative damage in Arabidopsis involves calcium,abscisic acid,ethylene,and salicylic acid[J]. Plant Physiology,128(2):682-95. doi:10.1104/pp.010320.
Mumpuni R P,Rohmah A J. 2021. Application of biological control Paenibacillus polymyxa toward bacterial leaf blight disease in rice plant[J]. IOP Conference Series:Earth and Environmental Science,637:012040. doi:10. 1088/1755-1315/637/1/012040.
Palazzini J M,Dunlap C A,Bowman M J,Chulze S N. 2016. Bacillus velezensis RC 218 as a biocontrol agent to reduce Fusarium head blight and deoxynivalenol accumulation:Genome sequencing and secondary metabolite cluster profiles[J]. Microbiological Research,192:30-36. doi:10.1016/ j.micres.2016.06.002.
Park S C,Kim S H,Park S,Lee H U,Lee J S,Park W S,Ahn M J,Kim Y H,Jeong J C,Lee H S,Kwak S S. 2015. Enhanced accumulation of carotenoids in sweetpotato plants overexpressing IbOr-Ins gene in purple-fleshed sweet potato cultivar[J]. Plant Physiology and Biochemistry,86:82-90. doi:10.1016/j.plaphy.2014.11.017.
Saur I M L,Hückelhoven R. 2021. Recognition and defence of plant-infecting fungal pathogens[J]. Journal of Plant Physiology,256:153324. doi:10.1016/j.jplph.2020.153324.
Young S K,Kotnala B,Yong H J. 2016. Effects of rhizobacteria Paenibacillus polymyxa APEC136 and Bacillus subtilis APEC170 on biocontrol of postharvest pathogens of apple fruits[J]. Journal of Zhejiang University-Science B (Biomedicine & Biotechnology),17(12):931-940. doi:10.1631/ jzus.B1600117.
Zhai Y,Zhu J X,Tan T M,Xu J P,Shen A R,Yang X B,Li J L,Zeng L B,Wei L. 2021. Isolation and characterization of antagonistic Paenibacillus polymyxa HX-140 and its biocontrol potential against Fusarium wilt of cucumber seedlings[J]. BMC Microbiology,21(1):1-12. doi:10. 1186/S12866-021-02131-3.
Zhang Q X,Xing C L,Li S Y,He L L,Qu T L,Chen X J. 2021. In vitro antagonism and biocontrol effects of Paenibacillus polymyxa JY1-5 against Botrytis cinerea in tomato[J]. Biological Control,160:1-10. doi:10.1016/J.BIOCONTROL.2021.104689.
收稿日期:2021-10-22
基金項目:国家重点研发计划项目(2019YFD1001300,2019YFD1001305);国家现代农业产业技术体系建设专项(CARS-10);湖北省重点研发计划项目(2020BHB024)
通讯作者:王连军(1982-),https://orcid.org/0000-0002-4178-8784,博士,研究员,主要从事甘薯遗传育种研究工作,E-mail:wanglianjun10@163.com
第一作者:徐颖华(1998-),https://orcid.org/0000-0001-8535-9247,研究方向为甘薯遗传育种,E-mail:3338656762@qq.com
