Fe/Cu有机湿法氧化脱硫体系的H2S脱除性能
2022-07-13李维军刘志豪
董 雨,马 悦,李维军,刘志豪,李 敏,邱 奎
(1.重庆科技学院化学化工学院,重庆 401331;2.中石油川西北气矿苍溪天然气净化一厂;3.湖北黄冈应急管理职业技术学院)
硫化氢(H2S)是一种毒性、腐蚀性很强的工业气体,其自身及其氧化产物SO2均会对工业装置和周围环境造成极大危害,必须严格脱除[1]。H2S的脱除方法有很多种,其中小规模的气体脱硫常用湿法氧化脱硫法,该方法具有工艺简单、净化度高、投资低、操作方便的优点[2-3],但也存在硫容量较低、能耗偏高、硫磺品质较差、溶剂配方较复杂、溶液易降解、污水排放量较大等问题[4]。
LO-CAT工艺是湿法氧化脱硫应用最广泛的技术之一,具有较高的H2S脱除能力[5]。然而,该工艺仍存在一些缺点:①需要保持脱硫液为弱碱性,以促进其对H2S的快速吸收;②为防止Fe3+水解,需要加入螯合剂保持Fe3+稳定性;③溶液再生时,若过度曝气则生成硫酸盐、亚硫酸盐和硫代硫酸盐,导致产物硫磺纯度低[6]。
鉴于水相湿法氧化脱硫技术的这些固有缺点,离子液体(IL)脱硫剂受到研究者关注[7]。离子液体脱硫剂具有化学稳定性好、饱和蒸气压低、结构可设计性、环保高效等优点[8],是一种潜在的绿色脱硫溶剂。例如,Guo Zhihui等[9]提出了一种基于铁基离子液体(Fe-IL)的新型非水氧化脱硫系统。该系统利用咪唑有机阳离子吸收H2S,金属配合物阴离子充当氧化中心,其理论硫容可达66 g/L,为离子液体高效脱硫奠定基础。但是,由于Fe-IL黏度较高,影响Fe3+对H2S的氧化传质速率,导致其实际硫容仅为0.23 g/L,远低于其理论硫容[10]。此外,离子液体脱硫剂的原料成本较高、腐蚀性较强、制备繁琐,需要进一步改进才可能具备应用价值[11]。
Hua Guoxiong等[12]报道了一种FeCl3有机溶液的非水相脱硫体系。该脱硫剂可以将H2S催化氧化为硫单质,但FeCl3在有机溶剂中的溶解度较小,难以满足高浓度H2S的脱除需求。针对金属盐在有机溶剂中溶解度小,难以实现脱除高浓度H2S的问题,本课题选用FeCl3、CuCl2双金属盐,以N-甲基吡咯烷酮(NMP)为有机溶剂,在有机溶剂中加入少量盐酸以提高金属盐的溶解度,从而构建一种新型高效的有机脱硫体系,以实现提高体系的脱硫性能的目的;进而,考察脱硫体系的最佳脱硫剂配比及操作参数,实现H2S的高效脱除。
1 实 验
1.1 试 剂
N-甲基吡咯烷酮、无水三氯化铁、无水氯化铜,均为分析纯,上海阿拉丁生化科技股份有限公司产品;浓盐酸,质量分数37%,重庆川东化工有限公司产品;硫化氢标准气体(H2S体积分数为0.53%,平衡气为N2),重庆力拓气体有限公司产品。
1.2 仪 器
Tensor 27傅里叶变换红外光谱,德国布鲁克仪器有限公司产品;HCT-1/2热重分析仪,北京恒久科学仪器厂产品;Rigaku Ultima IV型X射线衍射仪,日本理学公司产品;MSA型便携式硫化氢检测仪(0~70 mg/m3,精度0.1 mg/m3),美国梅思安公司产品;鼓泡反应器,自制。
1.3 脱硫剂制备
分别在40 mL的NMP中加入1 mL浓盐酸,搅拌均匀,得到若干份添加盐酸的有机溶剂;然后,在该溶剂中加入不同比例的无水三氯化铁与无水氯化铜,得到不同的脱硫体系。制备时,先在添加盐酸的NMP中加入1.0 g无水三氯化铁,制成铁系基础脱硫剂;然后在基础脱硫剂中加入无水氯化铜,并调整氯化铜加量,制备得到系列双金属盐有机脱硫体系。
1.4 脱硫试验
静态脱硫试验装置由体积分数0.53%的H2S标准气体瓶、气体流量计、恒温水浴锅、鼓泡反应器、H2S检测仪和饱和NaOH溶液尾气吸收装置组成。鼓泡反应器直径为3 cm、高为15 cm,其中装填的脱硫剂体积为40 mL。试验时,用恒温水浴控制反应温度为20~60 ℃,用气体流量计控制H2S标准气体流速,将H2S通入鼓泡反应器与脱硫剂反应,反应尾气通过H2S检测仪后由尾气吸收装置吸收,当检测尾气中H2S质量浓度达到6.0 mg/m3时停止通入H2S,通入H2S气体时间即为脱硫时间。考察脱硫剂的硫容,其计算式见式(1)。
(1)
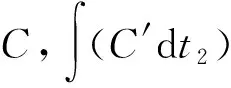
2 结果与讨论
2.1 脱硫剂性能
2.1.1红外光谱表征


图1 NMP与脱硫剂的红外光谱
图2为脱硫剂吸收H2S前后的化学结构变化。从图2可知:吸收H2S之后的脱硫剂在波数1 622 cm-1处的振动吸收峰基本消失,推测FeCl3-NMP、CuCl2-NMP与H2S结合,形成较为稳定的配位化合物[12];同时,脱硫剂的其他吸收峰均没有变化,说明脱硫剂分子中O—Fe、O—Cu配位键为吸收H2S的主要媒介,其他基团不与H2S进行反应;也说明NMP在吸收过程中保持其五元环结构,化学性质稳定。
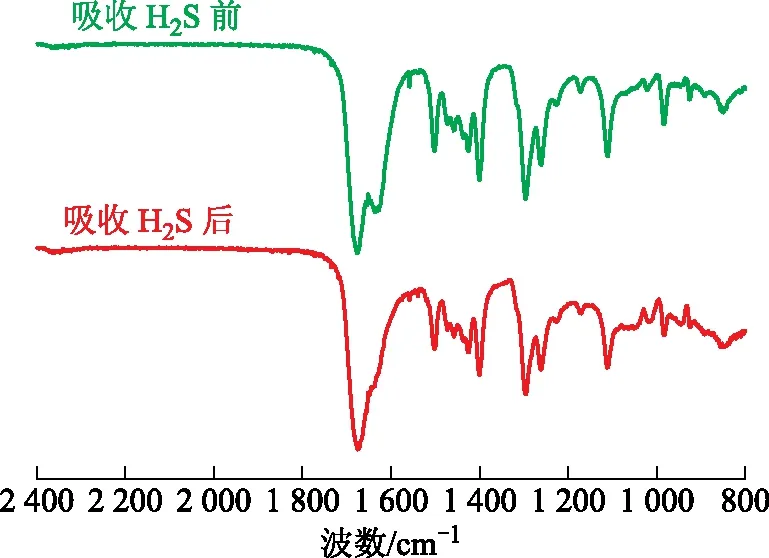
图2 吸收H2S前后脱硫剂的红外光谱
2.1.2热重分析
为了考察脱硫剂的热稳定性,在铁系基础脱硫液中加入1.0 g CuCl2,制成FeCl3与CuCl2质量比1∶1的Fe/Cu有机脱硫剂,其热重分析曲线如图3所示。

图3 脱硫液的热重分析结果
由图3可知:Fe-Me/NMP脱硫剂在50~200 ℃出现较大的质量损失,其中,在50~100 ℃区间的质量损失为加入浓盐酸中的水以及脱硫剂中吸附水[15]的蒸发损失,在100~200 ℃区间为NMP的挥发损失(NMP的沸点为202 ℃);在200 ℃以上,只有约质量分数17%的物质没有损失,分析其可能是NMP与Fe、Cu形成的FeCl3-NMP、CuCl2-NMP配位化合物,以固体形式存在。从热重分析结果可知,为了防止脱硫剂蒸发损失和高温分解,脱硫试验的温度宜控制在80 ℃以下。
2.1.3脱硫剂的黏度与密度
在NMP中加入金属盐会对脱硫剂的黏度与密度产生一定影响。研究发现:20 ℃下CuCl2在NMP中的溶解度为0.005 g/mL;而在NMP中加入体积分数2.5%的浓盐酸后,20 ℃下CuCl2的溶解度增至0.073 g/mL,即在40 mL的NMP中加入1 mL质量分数为37%的浓盐酸后,CuCl2的最大溶解量提高至3.0 g。因此,为考察金属盐对脱硫剂黏度与密度的影响,在铁系基础脱硫剂中加入2.0 g CuCl2,制成双金属盐有机脱硫剂,测定其不同温度下的黏度与密度,并与NMP和Fe-IL进行比较,结果如表1所示。
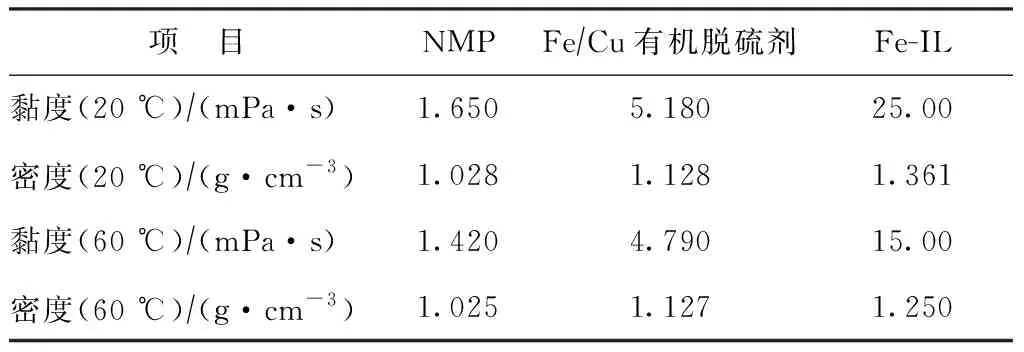
表1 不同温度下脱硫剂的黏度、密度与铁基离子液体对比
由表1可知:无论在20 ℃或60 ℃下,NMP的黏度和密度均最低,是较好的脱硫剂溶剂;当加入1.0 g FeCl3和2.0 g CuCl2后,脱硫体系的黏度升至5 mPa·s左右,而其密度增加10%左右,说明金属盐的加入大幅增加了体系黏度,而对体系密度影响较小。另一方面,Fe/Cu双金属有机脱硫剂的黏度显著低于铁基离子液体,20 ℃下前者黏度是后者的1/5,60 ℃下是1/3,这是由于在氢键作用下铁基离子液体的黏度随着温度升高而下降[16]。Fe/Cu双金属有机脱硫剂的黏度低、密度低的特性有利于提高气液传质效率,有助于H2S的吸收并降低设备运行能耗。
2.2 脱硫产物
使用脱硫剂对H2S标准气体进行脱硫,得到固体脱硫产物,其XRD谱图如图4所示。由图4可知,产物在2θ为11°,15°,23°,25°,31°,37°等处特征衍射峰均与α-硫磺标准谱图PDF#78-1889相符,说明该脱硫产物为斜方硫,即α-硫。此外,经与FeS、CuS等金属含硫化合物标准XRD谱图对比,发现该脱硫产物中不含铁硫化物和铜硫化物的特征衍射峰。因此,该固体脱硫产物为纯度较高的硫磺;而且脱硫剂的有效成分(Fe-NMP/Cu-NMP)并未流失到脱硫产物中。
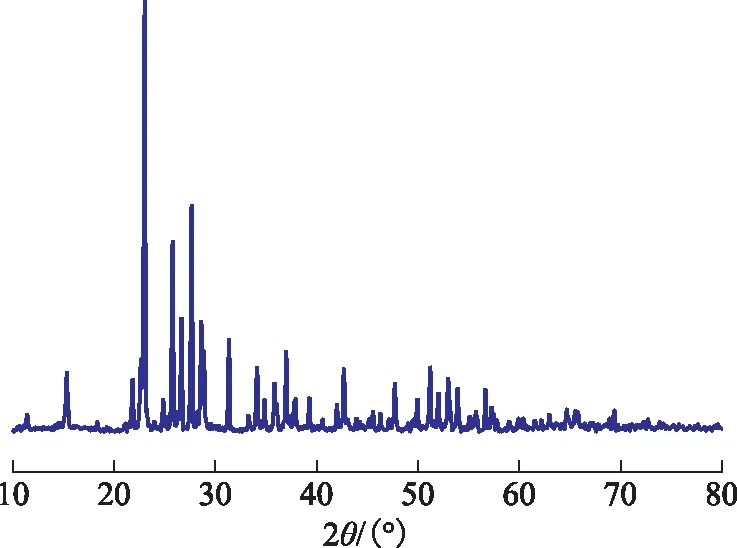
图4 固体脱硫产物的XRD图谱
2.3 脱硫剂的吸收与再生性能
2.3.1脱硫剂组成对脱硫效果的影响
在温度为313.15 K、原料气流量为30 mL/min的条件下,分别利用NMP+HCl混合物、铁系基础脱硫剂、NMP+HCl+1.0 g CuCl2的铜系脱硫剂进行H2S标准气体脱硫试验,考察脱硫剂组成对脱硫效果的影响,结果见图5。由图5可知:NMP+HCl混合物的脱硫效果较差,说明常压下NMP对H2S的吸收(主要是物理吸附)十分有限,溶液中通入H2S气体约3 min后净化气中H2S的浓度超标;铁系基础脱硫剂较NMP+HCl性能较好,试验7 min后净化气H2S浓度超标,说明FeCl3尽管对H2S具有氧化吸收效果,但吸收速率太低;而铜系脱硫剂的脱硫试验过程中,净化气的H2S质量浓度不高于6.0 mg/m3的时间长达120 min,说明铜系脱硫剂的性能显著优于前两种脱硫剂,脱硫净化气符合国家天然气一类气质量标准(GB 17820—2018)[17];但是,试验后的富H2S铜系脱硫体系在经氧气充分再生后脱硫性能显著降低,这可能是因为H2S与CuCl2在酸性NMP溶剂中生成了配合物,仅用氧气再生无法将配合物中结合的HS-氧化生成S,致使铜系脱硫剂不能恢复性能。

图5 脱硫剂组成对脱硫效果的影响■—NMP+HCl; ●—NMP+HCl+FeCl3; ▲—NMP+HCl+CuCl2(第一次脱硫); (第二次脱硫)
2.3.2Fe、Cu配比对脱硫效果的影响
由于单一铁系基础脱硫剂、铜系脱硫剂均存在脱硫性能差的问题,因此尝试采用Fe/Cu双金属协同脱硫体系催化氧化脱除H2S,并考察双金属脱硫体系的重复使用性能。在铁系基础脱硫剂中逐渐增加CuCl2的含量,制备得到系列Fe、Cu质量比不同的双金属脱硫剂,并分别在40 ℃、原料气流速30 mL/min条件下进行H2S标准气体的脱硫试验,结果见图6。

图6 不同浓度CuCl2对脱硫效果的影响CuCl2添加量,g:■—0.1; ●—0.2; ▲—0.5; ◆—2.0
图6可以看出:当Fe/Cu双金属有机脱硫剂中CuCl2添加量为0.1 g和0.2 g时,净化气的H2S浓度急剧上升,说明在铁系基础脱硫体系中加入少量CuCl2对脱硫剂的脱硫性能没有明显改善;随着CuCl2添加量逐渐增加,净化气体保持100%净化率的时间与CuCl2浓度呈正线性增长关系;当CuCl2添加量达到2 g时,净化气中H2S质量浓度不高于6 mg/m3的时间达280 min以上,对应双金属脱硫体系的硫容为1.65 g/L,而传统的络合铁脱硫剂的硫容为0.4~1.0 g/L,铁基离子液体的硫容为0.3~0.6 g/L[18-19],说明双金属脱硫体系的性能超过多数常规湿法氧化脱硫剂。
此外,在试验考察范围内,随着CuCl2添加量的增加,吸收H2S后脱硫剂的溶液始终保持透明。由此推断,与传统水相脱硫剂利用Fe3+、Cu2+与H2S反应生成FeS和CuS沉淀而脱硫的机理不同[20],Fe/Cu有机脱硫剂的脱硫过程是在NMP极性有机溶剂环境下,CuCl2与H2S进行快速配位反应,生成可溶解于NMP的配位化合物,因此脱硫体系中没有固体硫化物生成。
2.3.3温度对脱硫效果的影响
在原料气流速为30 mL/min时,考察不同温度下FeCl3与CuCl2质量比1∶1的Fe/Cu有机脱硫剂的脱硫效果,净化气H2S浓度随时间的变化见图7。由图7可知:在15 ℃下,净化气保持严格净化度的时间为135 min;而在60 ℃下,相应时间长达180 min。因此可见,在试验温度范围内,随着脱硫温度升高,脱硫剂的脱硫性能不断提高,这可能是因为温度升高使脱硫液黏度下降,从而提高了气液传质效率。

图7 不同吸收温度对脱硫效果的影响■—15 ℃; ●—40 ℃; ▲—60 ℃
2.3.4脱硫剂的再生性能
将氧气以200 mL/min通入鼓泡反应器,对脱硫后体系进行氧化再生,并以氧化还原电位(ORP)的变化表征脱硫体系的再生效果。测定脱硫体系再生前后的ORP和pH,并记录ORP随着再生通氧时间的变化规律,结果见表2。

表2 脱硫体系再生效果
由表2可知:随着脱硫体系再生时间的延长,脱硫液的ORP不断增大,但ORP的变化逐渐平缓;在通氧气初期0.5 h内,ORP变化显著。这是因为再生初期脱硫液中存在大量还原性的Cu-HS配合物,在通入氧气后,Fe2+快速氧化生成Fe3+,进而Fe3+快速将HS-氧化生成S;同时,在Cu2+存在下生成的Fe2+被氧气快速氧化为Fe3+,导致脱硫剂ORP快速增大。在大部分HS-被氧化成S后,脱硫液的ORP趋于稳定。
对比脱硫剂再生前后的pH可知:由于脱硫体系中加入了少量浓盐酸、FeCl3、CuCl2,使脱硫剂呈酸性,当体系中添加1.0 g FeCl3和1.0 g CuCl2时,脱硫体系的pH为3.1;当脱硫剂吸收大量H2S后,由于H2S的电离作用使体系酸性进一步增强,pH变小,达到1.9;体系呈酸性并未严重影响H2S的脱除,且酸性条件下脱硫克服了传统碱性环境脱硫生成硫代硫酸盐副产物的不足[21];再生完成后,HS-氧化生成S,H+与OH-生成水,体系酸性减弱,pH升至3.2。
2.3.5脱硫剂的重复使用性能
为考察脱硫剂重复使用的稳定性,在40 ℃、原料气流速为30 mL/min的条件下,使用FeCl3与CuCl2质量比1∶1的Fe/Cu有机脱硫剂进行5次脱硫/再生重复试验,脱硫后富H2S液再生时间均为1 h,试验结果列于表3。

表3 重复脱硫试验结果
由表3可知,在5次重复脱硫/再生试验中,脱硫净化气维持严格净化度时长的变化幅度很小,均在10%以内,且时长变化呈现波动现象,无明显下降趋势,表明双金属有机脱硫体系的脱硫/再生重复使用稳定性较好。
2.4 脱硫体系形成、脱硫、再生过程机理
基于上述试验结果,推测双金属脱硫体系形成与脱硫机理如下:
(1)首先,NMP分子中O原子上的孤对电子与Fe3+、Cu2+上的空轨道络合形成金属配位键,得到Fe/Cu有机脱硫体系,其配合物结构如式(2)和式(3)所示。

(2)
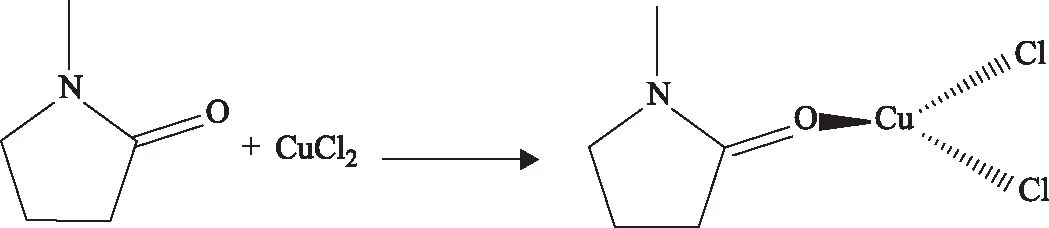
(3)
(2)Fe/Cu有机脱硫体系吸收H2S时,H2S先电离成HS-,由于HS-配位能力强于Cl-,进而HS-替换原来配位化合物中的Cl-,生成新的配位化合物Cu-HS,达到吸收H2S的目的,反应式见式(4)。而且,与NMP-FeCl3相比,NMP-CuCl2能够更快速地被HS-替换(图5),形成结合力更强的NMP-Cu-SH配合物,因而脱硫剂中CuCl2的浓度决定了体系的脱硫效果。
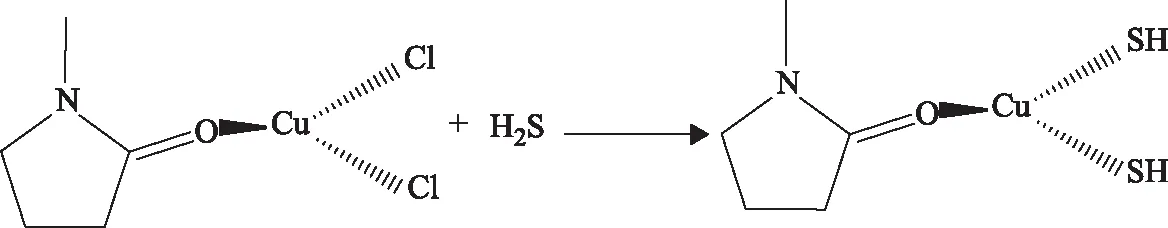
(4)
(3)再生过程的主要反应如式(5)~式(7)所示。再生时,Fe3+在酸性条件和氧气参与下拥有较强的氧化性,易将HS-氧化生成S,而其自身还原成Fe2+;Fe2+在体系中Cu2+的存在下被通入的O2迅速氧化为Fe3+,继续进行将HS-氧化生成S的再生反应。

(5)

(6)

(7)
3 结 论
(1)以NMP溶剂为基础,通过加入适量FeCl3和CuCl2构成一种非水相双金属氧化脱硫体系。该体系脱硫和再生效果好,黏度较低,化学稳定性和热稳定性良好,有利于长期使用。使用该体系对H2S标准气体进行脱硫,产物为纯度较高的α-硫,无其他副产物。
(2)在40 ℃、原料气流速为30 mL/min的条件下,使用FeCl3和CuCl2质量比为1∶2的双金属脱硫体系对H2S体积分数为0.53%的标准气体进行脱硫,脱硫净化气H2S质量浓度不高于6.0 mg/m3的时间长达260 min,对应脱硫体系的硫容为1.65 g/L,明显高于常规湿法氧化脱硫剂。
(3)脱硫时,体系吸收的H2S替换CuCl2-NMP配合物中的Cl-生成更稳定的配合物,从而实现高效脱硫;再生时,在酸性条件和氧气参与下,Fe3+将HS-氧化生成S,而还原的Fe2+在Cu2+的存在下被通入的O2迅速氧化为Fe3+,继续再生反应。同时,Fe/Cu有机脱硫体系的重复使用稳定性良好,是一种性能优良的新型脱硫剂。
