利用非靶向和靶向代谢组学鉴别荆条蜜、枣花蜜和洋槐蜜
2022-07-13刘进张永贵汪平凯赵彤赵柳微吴黎明
刘进 张永贵 汪平凯 赵彤 赵柳微 吴黎明
(1 北京市园林绿化产业促进中心;2 中国农业科学院蜜蜂研究所)
蜂蜜是蜜蜂采集植物花蜜、分泌物或蜜露,与自身分泌物结合后,在巢脾内转化、脱水贮存至成熟的天然甜物质[1,2],具有营养保健、伤口护理等功效[3-5]。蜂蜜的主要成分为糖类,占蜂蜜的65%~80%,糖类中以葡萄糖和果糖为主。另外,蜂蜜含有18%~22%的水,少量的蛋白质、酶、游离氨基酸、黄酮类物质、酚酸类物质、矿物元素以及微量元素[6]。常见的蜂蜜品种是按照蜜蜂采集的蜜源植物不同划分的。我国地域辽阔,蜜源植物种类较多,能得到的商品蜜种类多达几十种[7]。不同植物来源蜂蜜在品质特性、功能属性和价格等方面差异很大,确定不同品种蜂蜜有助于实现蜂蜜的准确识别和优质优价。因此,建立简单快速的蜂蜜鉴别手段至关重要。
蜂蜜品种的传统检测方法包括感官鉴别和花粉分析,其结果判断带有一定的主观性,需要实验员具有丰富的经验和专业的知识背景[7]。近年来,鉴别蜂蜜品种的现代技术包括荧光定量PCR 技术[8,9]、DNA 条形码技术[10]、紫外光谱技术[1,11]等,但上述方法存在一个共同点,即一个方法仅提供一种蜜源的鉴别,相比于同时鉴别几种不同蜜源的蜂蜜,单一鉴别的方法耗时长,成本高。色谱技术可定性分析样品中营养成分,结合质谱后可获得营养成分的定量结果,对于分析样本的特定物质含量具有优势性[12]。本研究利用代谢组学和统计分析技术,对3种大宗蜂蜜——荆条蜜、枣花蜜和洋槐蜜的代谢物进行异同比对,通过超高效液相色谱-三重四级杆质谱技术(UHPLC-QqQ-MS/MS)对三种蜂蜜的差异化合物进行准确定量,旨在建立一种同时鉴别3种蜂蜜的方法,为蜂蜜差异性成分的研究提供重要参考。
1 材料与方法
1.1 材料与试剂
蜂蜜样本均采自北京,包含3 种不同植物源单花种蜂蜜,分别为洋槐蜜(YH)、枣花蜜(ZH)和荆条蜜(JT)。其中,荆条蜜(n=23),枣花蜜(n=21),洋槐蜜(n=24)。所有样本均于2021年8月采自蜂场中自然酿造的蜂蜜,收集于500mL 玻璃瓶,待测前贮存于4℃。
甲醇、乙腈:色谱纯,美国MREDA 公司;甲酸:色谱纯,赛默飞世尔科技(中国)有限公司;咖啡酸(纯度≥98%)、4-羟基喹啉(纯度≥98%)、刺槐苷(纯度≥98%):上海源叶生物科技有限公司;Prime HLB 固相萃取小柱(200mg/6mL):美国沃特世公司。
1.2 仪器与设备
移液枪:德国Eppendorf 公司;Vortex-Genie 2涡旋仪:美国Scientific Industry 公司;分析天平:上海梅特勒-托利多仪器有限公司;超高效液相色谱—三重四极杆串联质谱(UHPLC-QqQ-MS/MS):6495,美国Agi1ent 公司;超高效液相色谱-飞行时间质谱(UHPLC/Q-Tof-MS):6545,美国Agi1ent公司;高速离心机:湖南湘仪有限公司。
1.3 样品前处理
准确称取5±0.05g 蜂蜜样品于50mL 离心管,加入10mL 水,涡旋1min,60kHz 功率超声10min后4℃离心5min,待净化。用5mL 甲醇,5mL 水活化固相萃取小柱,离心后样品取上清液过柱净化,流速约1d/3s,液体流完后,5mL 水淋洗,抽干,8mL 甲醇洗脱,氮气吹干,2mL 甲醇复溶,过0.22μm滤膜,待检测。
1.4 标准工作液的配制
准确称取咖啡酸、4-羟基喹啉和刺槐苷标准品适量,用甲醇配成1mg/mL 的标准储备液。将储备液配置成浓度分别为0.01、0.02、0.05、0.1、0.5、1、5、10 mg/L 的混合标准工作溶液。
1.5 非靶向代谢组学方法
色谱条件:
色谱柱:Agi1ent Ec1ipse P1us C18 (2.1×100mm,1.8μm);柱温:40℃;进样量:2μL;流动相:A为水(含0.1%甲酸,v/v),B 为乙腈(含0.1%甲酸,v/v));流速:0.3mL/min;梯度程序:0~2min,5% B;2~20min,5%~100% B;20~25min,100%B。
质谱参数:
电喷雾离子源(ESI):正离子模式;干燥气温度:325 ℃;干燥气流速:10 L/min;雾化器压力:35 psi;鞘气温度:370 ℃;鞘气流速:11 L/min;参比离子112.985587,1033.988109。
1.6 代谢物定性及数据分析
使用Agi1ent MassHunter Profinder B.10.0 软件对原始数据进行峰对齐、峰归属等处理。基于Met1in数据库及对照品对比,对质谱检测的一级精准相对分子质量及二级碎片离子信息进行色谱峰的定性分析。使用SIMCA 14.1 软件对数据进行标准化处理,随后进行正交偏最小二乘回归(OPLS-DA)有监督模型分析,并根据变量投影重要性(variab1e importance in projection,VIP)对组间分离贡献大的化合物进行筛选。
1.7 UHPLC-QqQ-MS/MS检测条件
色谱条件:
色谱柱:Agi1ent Ec1ipse P1us C18(2.1×100mm,1.8μm);柱温:40℃;进样量:2μL;流动相:A为水(含0.1%甲酸,v/v),B:乙腈;流速:0.3mL/min;洗脱梯度:0~1min,5%B;1~2min,5%~35%B;2~3min,35%~50%B;3~5min,50%~75%B;5~5.1min,75%~100%B;5.1~7min,100%B;7~7.1min,100%~5%B;7.1~10min,5%B。
质谱条件:
ESI 源:正、负离子模式;干燥气温度:325 ℃;干燥气流速:10 L/min;雾化器压力:35 psi;鞘气温度:370 ℃;鞘气流速:11 L/min。
2 结果与分析
2.1 非靶向代谢组学分析
OPLS-DA 可以最大化组间差异,被广泛用于代谢组学数据分析[13]。为明确不同单花蜂蜜中化合物的差异性,结合UHPLC/Q-Tof-MS 的相关数据,采用SIMCA 进行分析,绘制蜂蜜样品OPLS-DA 得分图(见图1)。将不同单花蜂蜜分为3 组:A 组—洋槐蜜;B 组—枣花蜜;C 组—荆条蜜。由图1可知,3 组样本完全分离,无重叠区域,分类效果较好,表明3 种单花蜂蜜具有明显的差异性。
进一步利用VIP 值分析寻找能有效区分3 种蜂蜜的标志性成分。通常认为VIP 值大于1 则表示该参数属于植物源鉴定中重要的标记指标,而VIP 值小于0.5 则表示该参数对于鉴定结果不重要[14]。本研究从大量差异化合物中筛选出4-羟基喹啉、刺槐苷和咖啡酸作为枣花蜜、洋槐蜜和荆条蜜的标志性成分。4-羟基喹啉、刺槐苷和咖啡酸的VIP 得分分别为13.25,1.65 和0.76。
2.2 蜂蜜中咖啡酸、4-羟基喹啉和刺槐苷的定量方法
2.2.1 UHPLC-QqQ-MS/MS 质谱条件优化
UHPLC-QqQ-MS/MS 是物质定量的有力工具,其灵敏度高,定量准确。文章优化了UHPLC-QqQMS/MS 的锥孔电压,使母离子信号强度达到最大。在最优的锥孔电压下开启碰撞能,信号最强的子离子为定量离子,信号强度次之的为定性离子。并优化离子对碰撞能,使定性、定量离子信号强度达到最大,最后进行MRM 监测2 对离子对[15]。3 种化合物的母离子、子离子、锥孔电压和碰撞能量如表1所列。
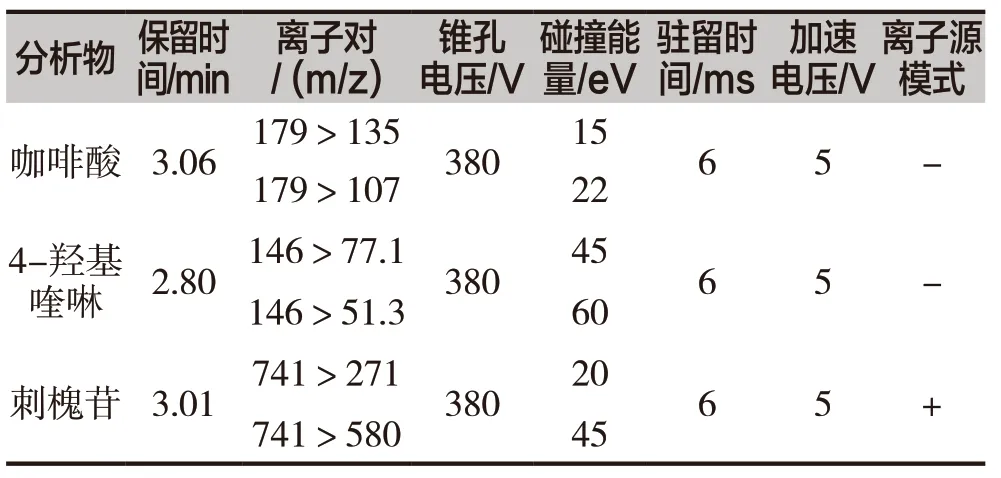
表1 分析物的保留时间及质谱分析条件
3 种标志性成分的色谱图见图2。3 种分析物均达到基线分离,各成分之间无干扰。表明本方法专属性良好,符合定量分析要求。
2.2.2 方法学验证
将制备的标准品混合工作液,以峰面积(Y)为纵坐标,对照品质量浓度(X)为横坐标,建立标准曲线,计算3 种标志成分的线性方程及相关系数R2。结果显示,3 种标志成分的相关系数(R2)均大于0.99,表明质量浓度在相应范围内与峰面积具有良好的线性关系,具体结果见表2。
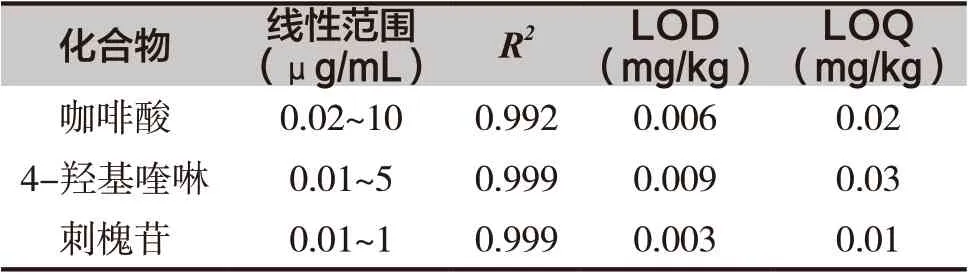
表2 3种蜂蜜中标志成分的检出限(LOD)、定量限(LOQ)和线性范围
以信噪比S/N=3 为检出限(LOD),S/N=10 为定量限(LOQ),计算得咖啡酸、4- 羟基喹啉和刺槐苷的LOD 分别为0.006mg/kg、0.009mg/kg 和0.003mg/kg。LOQ 分别为0.02mg/kg、0.03mg/kg 和0.01mg/kg。
为评估分析方法的回收率与相对标准偏差(RSD),将不同浓度的3 种标志性成分混合标准溶液添加到空白蜂蜜样品中进行加标回收实验,加标水平分别为0.5mg/kg、1mg/kg 和2mg/kg,实验重复5 次。结果表明,咖啡酸、4-羟基喹啉和刺槐苷的回收率分别为80.5%~90.1%、90.7%~93.7%和75.2%~87.7%,RSD 分别为1.2%~8.0%、2.8%~14.8和1.3%~4.4%。表明该方法的准确性和精密度满足蜂蜜样品的分析要求。具体结果见表3。
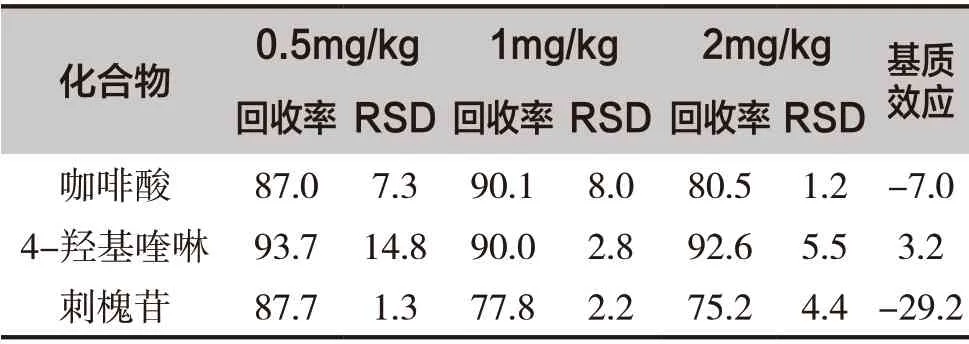
表3 3种蜂蜜中标志成分的基质效应和回收率(%/n=5)
基质效应是指共流出干扰物对目标物离子造成离子抑制或增强的效应,基质效应在质谱分析中普遍存在。本研究采用蜂蜜空白基质对基质效应进行考察,分别制备溶剂标准溶液和基质标准溶液,测得溶剂标准曲线和基质标准曲线的斜率。基质效应=(基质标准曲线斜率-溶剂标准曲线斜率)/溶剂标准曲线斜率×100%。基质效应的绝对值随着基质效应的增强而变大,基质效应为正值说明基质增强,负值则为基质抑制。当基质效应绝对值<20%时表示基质效应微弱,基质效应绝对值在20%~50%范围时表示具有中等强度基质效应,基质效应绝对值>50%时表示基质效应较强[16,17]。咖啡酸、4-羟基喹啉和刺槐苷在蜂蜜中的基质效应分别为-7.0%、3.2%和-29.2%,说明咖啡酸和4-羟基喹啉具有微弱基质效应,而刺槐苷具有中等强度基质效应,本实验采用基质工作溶液定量以减小基质效应的影响。
2.2.3 实际样品测定
取荆条蜜样23 个,枣花蜜样21 个,洋槐蜜样24 个,测定其中咖啡酸、4-羟基喹啉和刺槐苷的含量,结果见图3。蜂蜜样本中咖啡酸的含量由高到低为荆条蜜、枣花蜜和洋槐蜜,其含量分别为1.82~6.01mg/kg、0.03~1.57mg/kg 和0.09~0.35mg/kg;蜂蜜样本中4-羟基喹啉的含量由高到低为枣花蜜、荆条蜜和洋槐蜜,其含量分别为0.45~2.9mg/kg、0.06~0.35mg/kg 和0.02~0.25mg/kg;蜂蜜样本中刺槐苷的含量由高到低为洋槐蜜、枣花蜜和荆条蜜,其含量分别为0.12~0.97mg/kg、0.01~0.32mg/kg 和0~0.02mg/kg。同时分析了20 个油菜蜂蜜和椴树蜂蜜中咖啡酸、刺槐苷、4-羟基喹啉的含量,发现在油菜和椴树蜂蜜中能够检出少量咖啡酸(显著低于设定阈值),但是均未检出刺槐苷和4-羟基喹啉。
本实验研究结果显示,排除少量异常值后,荆条蜜中咖啡酸的含量显著高于洋槐蜜和枣花蜜,可作为荆条蜜的特征物,其阈值建议大于1.6 mg/kg;枣花蜜中4-羟基喹啉显著高于荆条蜜和洋槐蜜,可作为枣花蜜的特征物,其阈值建议大于1.0 mg/kg;洋槐蜜中刺槐苷明显高于荆条蜜和枣花蜜,可作为洋槐蜜的特征物,其阈值建议大于0.4 mg/kg。
3 结论
本文采用非靶向和靶向代谢组学技术对荆条蜜、枣花蜜和洋槐蜜进行研究,发现咖啡酸、4-羟基喹啉和刺槐苷对3 种蜂蜜的鉴别具有关键性作用。采用超高效液相色谱—三重四极杆质谱(UHPLCQqQ-MS/MS)技术建立了同时测定蜂蜜中咖啡酸、4-羟基喹啉和刺槐苷的方法。采用该方法分析北京及周边地区荆条蜜、枣花蜜和洋槐蜜样品中的咖啡酸、4-羟基喹啉和刺槐苷的含量,确定咖啡酸、4-羟基喹啉和刺槐苷可分别作为荆条蜜、枣花蜜和洋槐蜜的标志性成分,其阈值分别为1.6 mg/kg、1.0 mg/kg 和0.4 mg/kg。该方法可满足3 种蜂蜜样品的快速鉴别,也可为蜂蜜鉴别提供有利的手段和可靠的思路。
