胎盘嵌合对无创产前筛查假阳性影响
2022-07-13张丽春王杰郭志远马科黄艳白海栋刘爱菊贾跃旗
张丽春 王杰 郭志远 马科 黄艳 白海栋 刘爱菊 贾跃旗
无创产前筛查(non-invasive prenatal screening,NIPS) 是一种应用高通量测序等分子遗传学技术,检测孕期母体血浆中胎儿游离DNA片段,以评估胎儿常见染色体非整倍体风险的产前筛查技术,主要目标疾病为21-三体综合征、18-三体综合征和13-三体综合征[1]。同时NIPS也可检出其他染色体非整倍体(rare autosomal trisomies,RATs)、性染色体非整倍体(sex chromosome aneuploidies,SCAs)及致病性拷贝数变异(copy number variation,CNV)。相对于传统的血清学筛查有更高的准确性和更低的假阳性率。据统计NIPS对三种目标疾病的检测准确率分别达99.4%、97.4%和92.5%,假阳性率分别为0.2%、0.5%和0.8%[2]。引起NIPS假阳性的原因主要包括母体嵌合体、母体肿瘤及双胎之一消亡或限制性胎盘嵌合体(confined placental mosaicism,CPM)[3]。
随着NIPS的广泛应用,CPM导致的假阳性越来越受到研究者的关注。CPM指异常细胞系几乎只存在于胎盘,而未见于羊膜细胞或其他胎儿组织中,即染色体嵌合异常只发生在胎盘而胎儿染色体正常的现象[4-5]。产生CPM的主要原因是外周血中的游离DNA主要来源于胎盘绒毛滋养层细胞而不是胎儿本身,不能完全代表胎儿的真实情况,造成胎盘和胎儿核型的差异。研究表明CPM可能会改变胎盘功能,导致胎儿宫内发育受限、妊娠丢失或围产儿死亡等[6]。
本研究收集了因NIPS高风险在本院进行产前诊断,引产或产后的35例胎盘组织,借助于荧光原位杂交(fluorescence in situ hybridization,FISH)、染色体微阵列分析(chromosome microarray analysis,CMA)或基因组拷贝数变异测序(copy number variation sequencing,CNV-seq)技术对胎盘多个位置进行遗传学检测,并对假阳性病例进行跟踪随访,评估胎盘嵌合对NIPS假阳性及妊娠结局的影响。
对象与方法
1. 对象:2018年—2020年NIPS检测结果高风险、在本院行介入性产前诊断、引产或生产后追踪到胎盘组织的样本35例。取得受检者知情同意情况下,对胎盘多个位置行FISH、CMA或CNV-Seq检测。本研究经内蒙古自治区妇幼保健院伦理委员会审查批准(No.2019-007-2)。
2. 胎盘采集方法:选择自然流产或正常分娩的胎盘,以脐带为中心点,分别在胎盘母面、胎儿面的中心和边缘各取1份组织,在近胎盘端采集1份脐带组织,每份约黄豆大小(长:0.5~1.0 cm,宽:0.5~1.0 cm,深:0.2~0.3 cm),共采集5份组织标本,做好相应位点标记;对于未收集到完整胎盘的样本,多点采样混合后进行检测。NIPS提示13、16、18、21及22-三体高风险样本行FISH检测,其他异常选择CMA或CNV-Seq检测。
3.检测方法:
(1)染色体核型分析。在超声引导下无菌抽取15~20 mL羊水,离心后接种于常规培养基,收获细胞、制片、G显染。镜下计数25个分裂相,每个标本分析5个核型,如发现嵌合体,则计算50个分裂相,参照人类细胞基因组学国际命名体系(ISCN 2020)[7]描述核型。
(2)染色体微阵列分析(CMA)。使用核酸提取试剂盒(美国,Promega 公司)对羊水和组织样本进行全基因组DNA提取,将提取的DNA样本用CytoScanTM750K微阵列芯片系统(美国,Affymetrix公司)进行检测,操作步骤包括酶切、连接、PCR扩增、纯化、片段化、标记、杂交洗涤、扫描和分析等,使用ChAS 4.0软件对结果进行分析。参考美国医学遗传学与基因组学学会的建议[8]评判CNV的临床意义,参照人类细胞基因组学国际命名体系(ISCN 2020)[7]描述芯片结果。
(3)荧光原位杂交检测(FISH)。将预处理好的样品固定于载玻片,并经SSC溶液洗涤和胃酶处理将核酸暴露。将载玻片和探针分别在变性剂中变性,载玻片变性后经预冷的乙醇溶液固定、干燥、预热;变性后的探针滴于载玻片杂交区,加盖盖玻片,封胶,在封闭的湿盒中过夜杂交。杂交后的载玻片置于变性液中洗涤,再用70%乙醇溶液固定。将洗涤后的载玻片经DAPI复染剂染色,在荧光显微镜下镜检。镜下进行细胞计数并进行结果判读。每个杂交区至少计数50个信号强度且无重叠的杂交细胞。如大于90%的细胞显示非整倍体信号,则判定为非整倍体;如10%~60%的细胞显示非整倍体信号,则可能为嵌合体;如信号差无法确定则加大细胞计数至100个,参照人类细胞基因组学国际命名体系(ISCN 2020)[7]描述FISH结果。
(4)基因组拷贝数变异测序(CNV-seq)。样本送检至深圳华大临床检验中心进行实验分析。将50 ng基因组DNA进行片段化处理,获得平均大小为300 bp的DNA片段,构建测序文库,使用BGI-SEQ500基因测序仪(中国,华大基因)进行高通量全基因组测序,应用BWA软件将测序所得序列与GRCh37/hg19基因组进行比对分析,保留唯一定位的Reads;统计校正后1Mb区域的Reads个数,并与正常参考数据库进行比较。参考美国医学遗传学与基因组学学会的建议[8]进行变异解读,将拷贝数变异分为五类,即致病(总分≥0.99)、疑似致病(0.90≤总分≤0.98)、临床意义未明(-0.89≤总分≤0.89)、疑似良性(-0.98≤总分≤-0.90)和良性(总分≤-0.99)。
4.妊娠结局随访与统计:随访NIPS假阳性病例妊娠结局及胎儿发育情况,用于后续评估胎盘嵌合对NIPS假阳性及妊娠结局的影响,NIPS、产前诊断和胎盘检测结果的一致率为两种方法检测结果一致的例数分别在总例数中的占比。
结果
1. NIPS、产前诊断、胎盘检测结果比较分析:35例NIPS高风险的孕妇,NIPS结果与产前诊断结果及胎盘检测结果进行比较分析(见表1)。35例NIPS高风险病例中,NIPS与产前诊断结果一致25例,一致率为71.4%(25/35);10例不一致,为NIPS假阳性;NIPS与胎盘检测结果一致29例,一致率为82.9%(29/35);6例不一致,其中2例NIPS提示CNVs,其NIPS结果与胎盘检测结果异常位置不同。产前诊断结果与胎盘检测结果一致例数为30例,一致率为85.7%(30/35)。
35例NIPS高风险样本中,常见的T21、T18、T13高风险有26例,其产前诊断与NIPS结果的一致率为84.6%(22/26),胎盘检测结果与NIPS结果的一致率为92.3%(24/26)。
2. 10例NIPS假阳性病例胎盘检测及妊娠结局随访结果:经检测发现6例存在CPM(见表2),CPM占比60%(6/10)。随访妊娠结局及胎儿发育状况发现其中5例孕妇正常妊娠,且胎儿发育正常,NIPS结果分别为T21、T13、X单体高风险各1例及2例CNVs。其中,T21、T13、X单体高风险病例,产前诊断结果均正常,胎盘检测结果显示NIPS与胎盘异常类型一致。其余2例为CNVs,NIPS结果分别为dup(2q12.2-q13,5.25M)-M和del(20p12.3-q12.1,9.01M),产前诊断结果均正常,胎盘检测结果1例为dup(7p14.1p14.1)127.90 kb及dup(Xp22.2p22.2)399.37 kb,另一例为del(7q22.1q22.1)120.57 kb。1例CPM病例引产,NIPS结果为T6高风险,产前诊断结果为16号染色体存在部分缺失arr[GRCh37]16p13.11(14892975_16528123)×1,胎盘检测结果为6号三体嵌合与16p13.11部分缺失,同时产前超声显示胎儿宫内生长受限,引产。
假阳性中的4例NIPS结果分别为T21、T18、T4和X单体高风险,胎盘结果均正常,产前诊断结果3例正常,1例(T4高风险)由于孕期羊水少,未进行产前诊断,产后回访孕妇自述胎儿正常。NIPS提示T4高风险病例Z值为12.822,孕期胎儿发育正常,孕妇36周正常妊娠,胎儿发育正常,该病例在产后发现孕妇自身患有胰腺尾部肿瘤。NIPS提示X单体高风险病例Z值为12.869,产前诊断明确为假阳性,后对母亲外周血核型检测发现母亲为45,X[10%]/46,XN[90%]嵌合体。其余2例NIPS提示T21高风险和T18高风险病例Z值分别为-3.611和3.156,产前诊断及胎盘检测结果均正常。
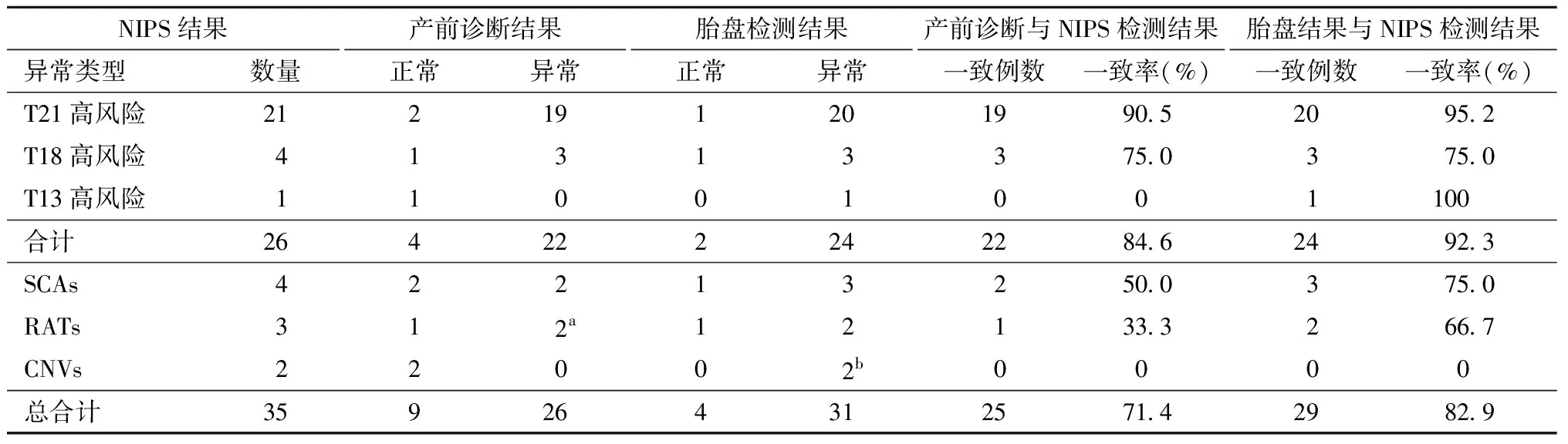
表1 35例NIPS高风险病例产前诊断及胎盘结果统计
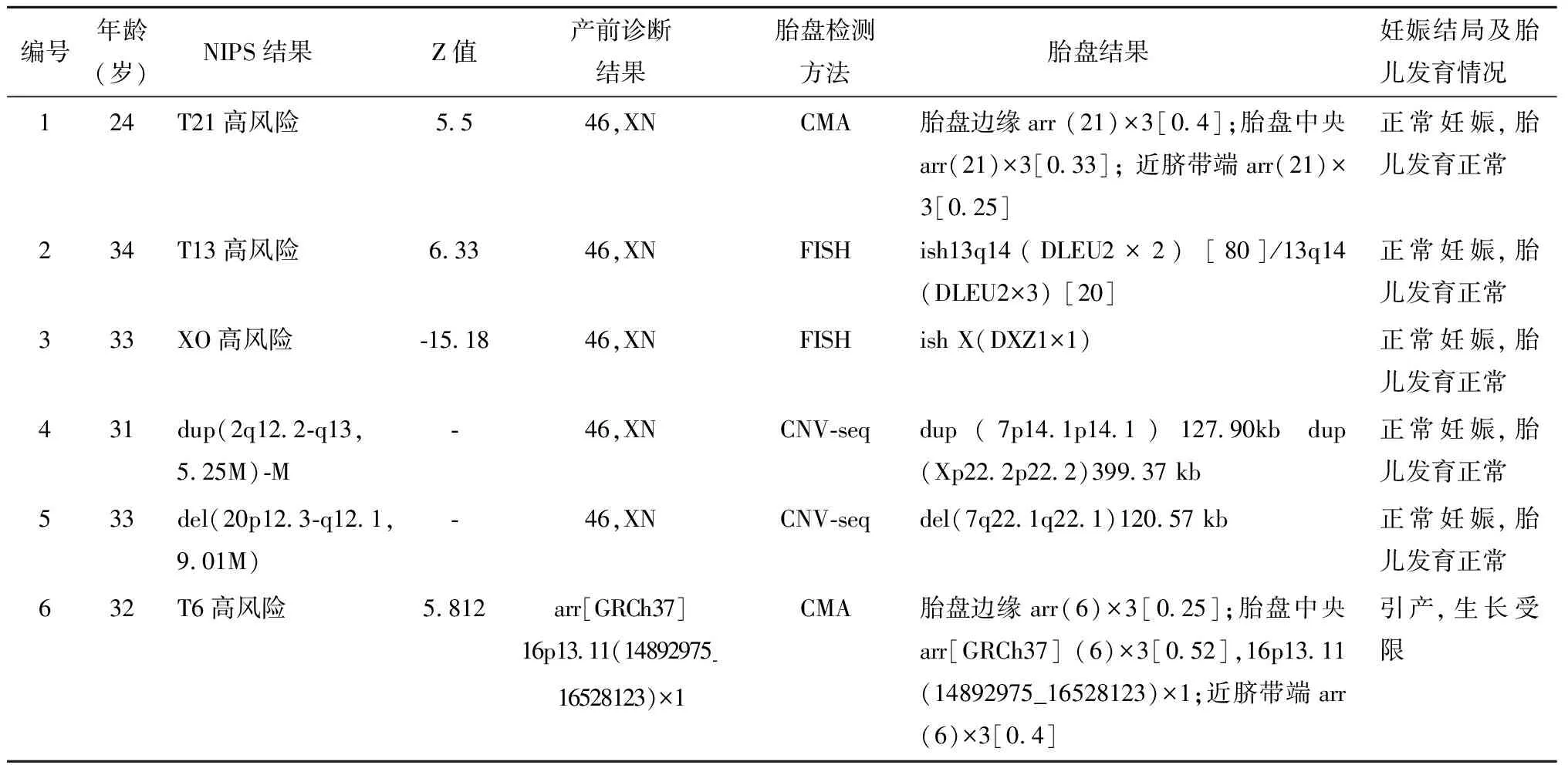
表2 6例胎盘嵌合病例临床资料及胎盘结果
讨论
NIPS自2011年应用于临床以来,在产前筛查领域得到了广泛应用和认可[9]。但是由于NIPS检测的胎儿游离DNA主要来源于细胞滋养层中胎盘细胞的凋亡,可能会导致NIPS结果与胎儿的真实情况不一致,造成检测结果的假阳性[10]或假阴性[11]。
在造成NIPS假阳性的原因中,胎盘嵌合是重要因素之一[12]。NIPS检测的胎儿游离DNA绝大部分来源于胎盘滋养层细胞,胎盘滋养层细胞与胎儿都是由同一个合子发育而来,合子形成后,一部分细胞发育成胎盘的细胞系,一部分细胞发育成胎儿的细胞系,通常情况下,两者的遗传物质相同。Wang等[13]分析了NIPS高风险孕妇进行产前诊断的结果,发现二者中13-三体的符合率为44%,18-三体的符合率为64%,21-三体的符合率为93%,提示胎儿与胎盘的遗传物质可能并非完全相同。本研究统计了NIPS高风险病例分别与产前诊断和胎盘结果的一致率,发现NIPS与胎盘的一致率为82.9%(29/35),与产前诊断的一致率为71.4%(25/35),虽然胎儿与胎盘染色体并非完全相同,但是一致率较高(85.7%),NIPS对常见染色体非整倍体的检测效果仍具有重要的参考意义。同时,NIPS结果与产前诊断结果存在的偏差提示NIPS出现高风险结果时,建议进行产前诊断的进一步验证,以排除假阳性和其他染色体异常的存在。
2017年Hartwig等[14]回顾性分析了206例NIPS结果与胎儿核型不一致病例,发现假阳性病例182例(88%),其中60例(33%)分析了假阳性的生物学或技术原因,发现19例(32%)是由CPM导致的,认为CPM是导致假阳性的主要因素之一。本研究的10例NIPS假阳性病例中6例为CPM,CPM占比60%(6/10),说明CPM是造成NIPS假阳性的主要原因。研究发现CPM与宫内发育迟缓、自然流产、宫内死亡、死产及胎盘功能异常有关,可能会导致产前和围产期不良妊娠结局[15]。Grati等[16]回顾性分析了124例CPM和468例的正常对照人群,认为只有16-三体会增加CPM的不良妊娠结局。吴小青等[17]最新研究的5例CPM中,3例(60%)胎儿因生长受限伴或不伴其他超声异常而被终止妊娠,胎儿生长受限的发生率明显高于之前报道,认为CPM与不良妊娠结局有相关性的观点。本研究6例CPM中,随访5例妊娠结局正常,胎儿发育正常,未出现胎儿生长受限;1例胎儿超声异常提示胎儿宫内发育迟缓,其NIPS为T6高风险,羊水核型及胎盘检测均存在16号染色体异常,引产,支持CPM与不良妊娠结局有相关性的观点。因此,对NIPS高风险的人群建议进行产前诊断同时密切监测胎儿发育情况。
本研究中对4例NIPS提示性染色体异常的样本经产前诊断后,2例评估为NIPS假阳性的样本,产后收集到胎盘检测,发现其中1例为胎盘嵌合,1例为母体性染色体嵌合。提示母亲性染色体异常也可能是导致NIPS假阳性的原因。因此,对于NIPS性染色体异常的孕妇建议检测母亲的染色体核型,以排除母亲染色体异常对胎儿正常核型的影响。除此之外,母体罹患肿瘤是导致NIPS假阳性的另一个原因。本研究发现1例孕期NIPS提示T4高风险病例,未进行产前诊断,胎盘检测结果正常,跟踪随访,孕妇自述胎儿发育正常,但在产后发现孕妇存在胰腺尾部肿瘤,进行了肿瘤切除,推测母亲孕期罹患肿瘤可能导致NIPS假阳性。
同时,本研究还发现2例NIPS假阳性,分别为T21高风险和T18高风险,通过胎盘检测未找到假阳性原因,但两例高风险Z值均偏低,分别为-3.611和3.156,推测可能是由于胎盘嵌合程度较低或取样位置受限。
综上所述,胎盘嵌合是影响NIPS假阳性的重要原因之一,除此之外,母体染色体异常和母体罹患肿瘤都会导致NIPS假阳性。尽管NIPS的准确性高于传统的血清学筛查,但由于受胎盘嵌合及母体等多种因素的影响,NIPS的准确率不能达到100%,无法取代介入性产前诊断。因此,建议选择NIPS的孕妇均应进行检测前和检测后遗传咨询,包括关于假阳性风险提示;在进行任何不可逆的手术之前,应进行产前诊断来确认或排除胎盘嵌合对胎儿的影响。由于病例数较少,本研究也存在一定的局限性,为了更全面的揭示NIPS假阳性的原因,还有待于收集更多的病例及临床数据,为CPM及非CPM病例的临床咨询提供更充分的依据。
