棕榈酸钠暴露不同时间对肾小管上皮细胞损伤及对NLRP3炎症小体激活的影响
2022-07-13张艳华朱云峰李维祖李卫平
张 洁,张艳华,朱云峰,李 艳,李维祖,李卫平
糖尿病肾病(diabetic nephropathy, DN)是糖尿病的主要并发症,是终末期肾脏疾病的最常见原因[1]。先前的研究[2]表明DN的病变主要是肾小球硬化,但近年来越来越多的研究表明肾小管上皮细胞(human renal tubular epithelial cells, HK-2)的损伤也是糖尿病肾病的重要特征。前期研究[3]显示,棕榈酸钠(sodium palmitate, PA)诱导能明显导致肾小球系膜细胞脂质沉积和氧化应激损伤。NADPH氧化酶(NADPH oxidases, NOX)是细胞中负责产生活性氧(reactive oxygen species,ROS)的重要酶系统,课题组前期研究[4]表明NOX4在肾小球系膜细胞表达较高,并且参与了系膜细胞的纤维化。炎症小体在炎症反应中具有核心作用,核苷酸结合寡聚化结构域蛋白样受体蛋白家族[nucleotide-binding oligomerization domain-containing protein (NOD)-like receptor protein, NLRP]是第1个被发现形成炎症小体的传感器蛋白家族。有报道[5]称,NLRP3炎症小体可能是慢性肾脏疾病的重要发病机制。然而,目前尚不清楚PA暴露是否可以通过激活NOX4增加ROS生成,进而激活NLRP3炎症小体导致HK-2炎症损伤。该实验主要研究PA诱导不同时间对HK-2损伤及对NLRP3炎症小体和NOX4表达的影响。
1 材料与方法
1.1 材料
1.1.1细胞株 HK-2细胞由安徽医科大学药学院药理学孟晓明教授馈赠。
1.1.2试剂 棕榈酸钠购自美国Sigma公司;牛血清白蛋白购自上海翊圣有限公司;油红染料购自合肥BoMEI生物技术有限公司;苏木精染色液购自沈阳万类生物有限公司;DMEM/F12购自美国HycloneTM公司;胎牛血清购自杭州四季青生物技术有限公司;BCA蛋白浓度测定试剂盒、青-链霉素溶液、胰蛋白酶和RIPA裂解液购自上海碧云天生物技术研究所;H2DCFDA和CCK-8购自美国Sigma公司;NLRP3抗体(ab214185)和ASC抗体(ab155970)购自英国Abcam有限公司;Caspase-1抗体(WL02996)和GAPDH抗体(F01302243)购自沈阳万类生物有限公司;NOX4抗体(DF6924)购自美国Affinity生物有限公司;PVDF膜(R7SA908213)购自美国Millipore 公司。
1.2 主要试剂的配制PA的配置:取PA粉末30 mg,向其中加入4 ml蒸馏水,在70 ℃水浴条件下使其完全溶解,得到浓度为27 mmol/L PA母液,过滤除菌后备用。取BSA粉末3 g,加入10 ml蒸馏水,55 ℃水浴加热溶解,过滤除菌后得到BSA溶液。将PA母液与BSA 溶液按照等体积混合,用DMEM/F12稀释至200 μmol/L后使用。
1.3 细胞培养与分组HK-2细胞用含10%胎牛血清、1%双抗的DMEM/F12培养基于37 ℃、5%CO2培养箱中培养,实验分为5组:BSA组,PA(200 μmol/L)6、9、12、24 h组。
1.4 CCK-8法检测细胞活力按照1.3分组方式,取对数生长期的HK-2细胞,将细胞以4×104个/ml浓度接种于96孔板中,每组设4个复孔,待细胞贴壁后,各组给予PA刺激6、9、12、24 h后,每孔加入10 μl CCK-8溶液,放置培养箱避光孵育4 h,用酶标仪测定450 nm波长处的吸光度。实验重复3次。
1.5 油红-苏木精染色检测细胞内脂质沉积情况按照1.3分组方式,将对数生长期的细胞均匀接种于24孔培养板中,油红苏木精染色后显微镜观察脂质沉积情况,阳性区域被染成红褐色,用Image-Pro Plus 6.0软件测量阳性区域的平均吸光度,评价脂质沉积情况。实验重复3次。
1.6 Annexinv-FITC/Pl双染检测细胞凋亡按照1.3分组方式,HK-2细胞均匀接种于6孔培养板中,收集各孔中培养基和消化的细胞于离心管中,离心后弃去上清液,得到细胞沉淀,加入200 μl的1×Binding Buffer悬浮细胞,随即加入5 μl的Annexin V/FITC混匀后室温避光反应15 min,再加入10 μl的PI混匀后室温避光反应15 min,用流式细胞仪检测各组细胞凋亡情况。实验重复3次。
1.7 采用H2DCFDA荧光探针检测细胞内ROS情况按照1.3分组方式,将对数生长期的细胞均匀接种于24孔培养板中,培养结束后,PBS洗3次,H2DCFDA储存液与DMEM/F12按1 ∶1 000配制,每孔加入H2DCFDA工作液500 μl,孵育30 min。弃去染料,用PBS洗3次,在显微镜下观察并拍照。用Image-Pro Plus 6.0软件测量绿色荧光的平均吸光度,评价ROS的生成情况。实验重复3次。
1.8 酶联免疫吸附实验(ELISA)检测细胞上清液中IL-1β、IL-18和细胞中GSH、SOD的表达按照1.3分组方式,将对数生长期的细胞均匀接种于6孔板中,细胞培养结束后,收集细胞上清液用ELISA法检测IL-1β、IL-18、GSH和SOD水平,按照ELISA试剂盒说明书操作。
1.9 Western blot检测细胞内蛋白表达情况按照1.3分组方式,将对数生长期的细胞均匀接种于6孔培养板中,向细胞中加入适量的RIPA裂解液,使其充分裂解后,收集上清液,用BCA蛋白定量试剂盒测定蛋白浓度。将蛋白变性后进行电泳转膜封闭等步骤,将目的蛋白与相应的一抗NLRP3、Caspase-1、ASC、NOX4、GAPDH在4 ℃条件下孵育过夜,TBST洗涤后,加二抗室温孵育1 h,显影后用Image J软件对图片进行灰度值分析。实验重复3次。

2 结果
2.1 PA暴露不同时间对HK-2细胞活力的影响CCK-8法检测结果显示,PA(200 μmol/L)分别干预(6、9、12、24 h)后,实验组与BSA组相比,PA可时间依赖性的降低HK-2细胞的细胞活力(F=59.61,P<0.01),见图1。实验结果表明,随着暴露时间的延长,PA对HK-2细胞的损伤作用增加。

图1 PA暴露不同时间对HK-2细胞活力的影响
2.2 PA暴露不同时间对HK-2细胞内脂质沉积的影响油红染色结果显示,BSA组细胞内未见脂质沉积,而随着PA暴露时间的增加,HK-2细胞内的脂质沉积程度增加(F=155.183,P<0.01),尤其在PA暴露12、24 h时最为明显,见图2。研究结果表明,PA暴露可通过脂毒性引起HK-2细胞损伤。
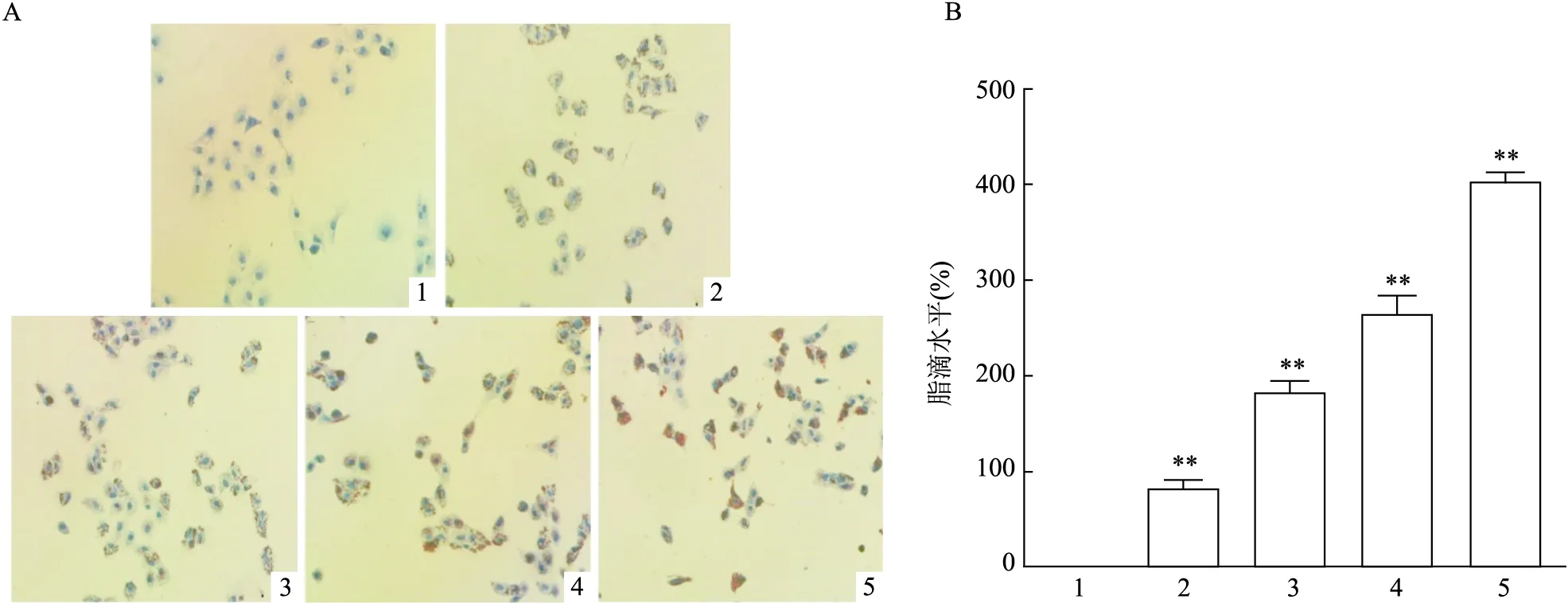
图2 PA暴露不同时间对HK-2细胞脂质进入细胞程度的影响 ×200
2.3 PA暴露不同时间对HK-2细胞凋亡的影响Annexin V-FITC/PI染色结果显示,与BSA组相比,随着PA暴露时间的延长,细胞凋亡率显著升高(F=17.675,P<0.05),特别是在24 h。见图3。实验结果表明,PA暴露能导致HK-2细胞的凋亡。

图3 PA暴露不同时间对HK-2细胞凋亡的影响
2.4 PA暴露不同时间对HK-2细胞中SOD和GSH活性及ROS生成的影响ELISA实验结果显示,PA分别刺激6、9、12、24 h后,随着暴露时间的增加,细胞内GSH和SOD的活性均降低(FGSH=67.183,P<0.05或P<0.01;FSOD=155.532,P<0.01)。见图4。实验表明PA暴露能降低HK-2细胞抗氧化能力。同时该实验观察了PA暴露不同时间对HK-2细胞中ROS生成的影响。结果显示,BSA组HK-2细胞中只有较低水平的ROS生成,而与BSA组比较,PA暴露时间越长,HK-2细胞中ROS积累越明显(F=103.124,P<0.05或P<0.01),见图5。结果表明,PA暴露可导致HK-2细胞ROS生成增多和抗氧化能力下降。
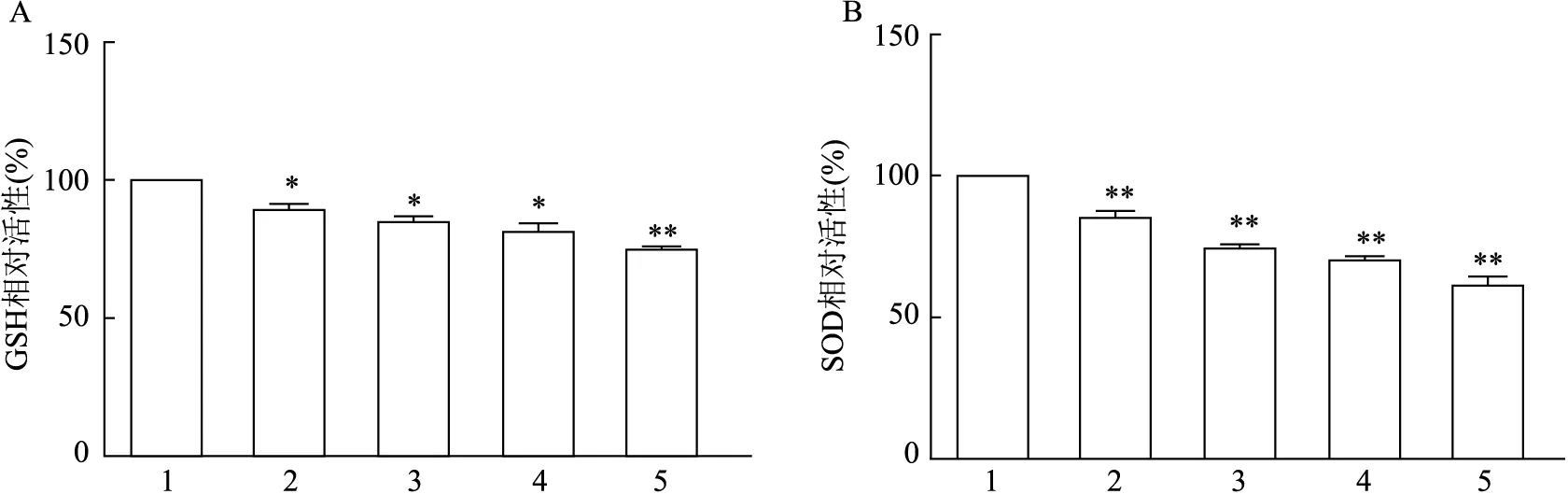
图4 PA暴露不同时间对HK-2细胞GSH、SOD水平的影响

图5 PA暴露不同时间对HK-2细胞内ROS水平的影响 ×200
2.5 PA暴露不同时间对上清液中IL-1β和IL-18水平的影响ELISA实验结果显示,与BSA组比较,PA暴露时间越长,分泌到细胞上清液的IL-1β和IL-18水平增加(FIL-1β=5.961,P<0.01;FIL-18=3.784,P<0.05或P<0.01),24 h浓度最高,表明PA暴露可导致HK-2细胞出现炎症反应水平增加。见图6。
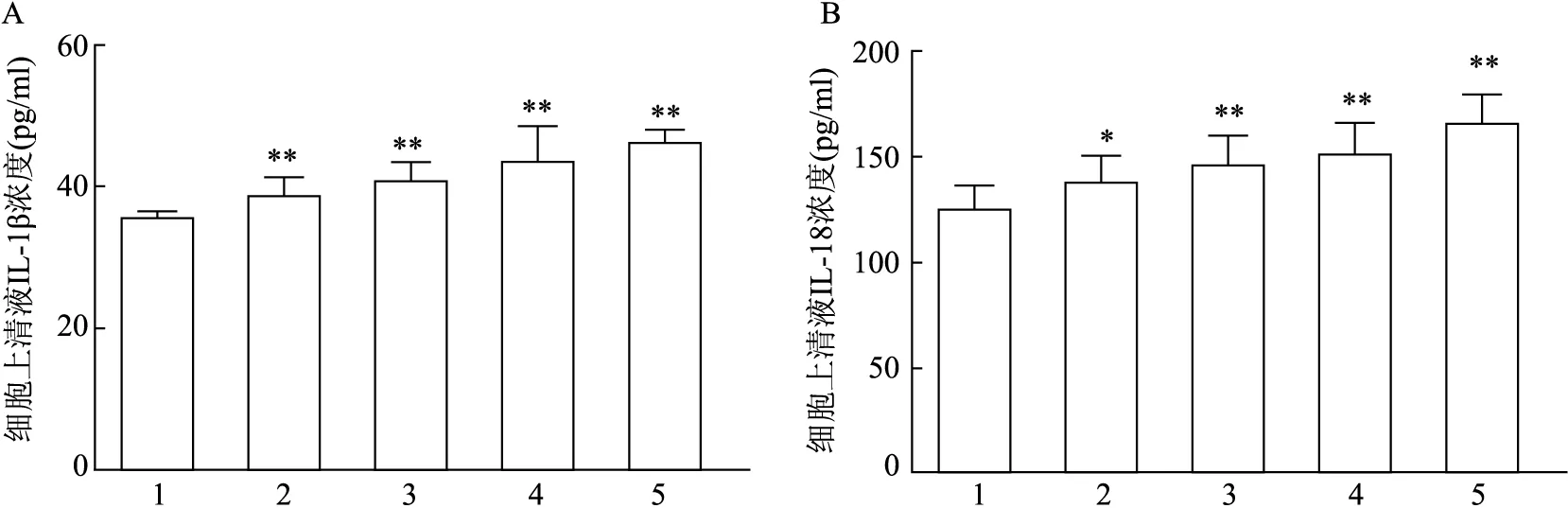
图6 PA暴露不同时间对HK-2细胞上清液中IL-1β和IL-18水平的影响
2.6 PA暴露不同时间对HK-2细胞NLRP3、Caspase-1、ASC和NOX4表达的影响Western blot实验结果显示,BSA组HK-2细胞中NLRP3、Caspase-1、ASC和NOX4的表达水平较低,与BSA组比较,PA暴露时间越长,HK-2细胞中NLRP3、Caspase-1、ASC和NOX4蛋白的表达显著增加(FNLRP3=68.241,P<0.05或P<0.01;FCaspase-1=108.423,P<0.05或P<0.01;FASC=161.253,P<0.05或P<0.01;FNOX4=84.253,P<0.05或P<0.01)。见图7。实验表明NOX4-NLRP3炎症小体参与了PA暴露导致的HK-2细胞的损伤。
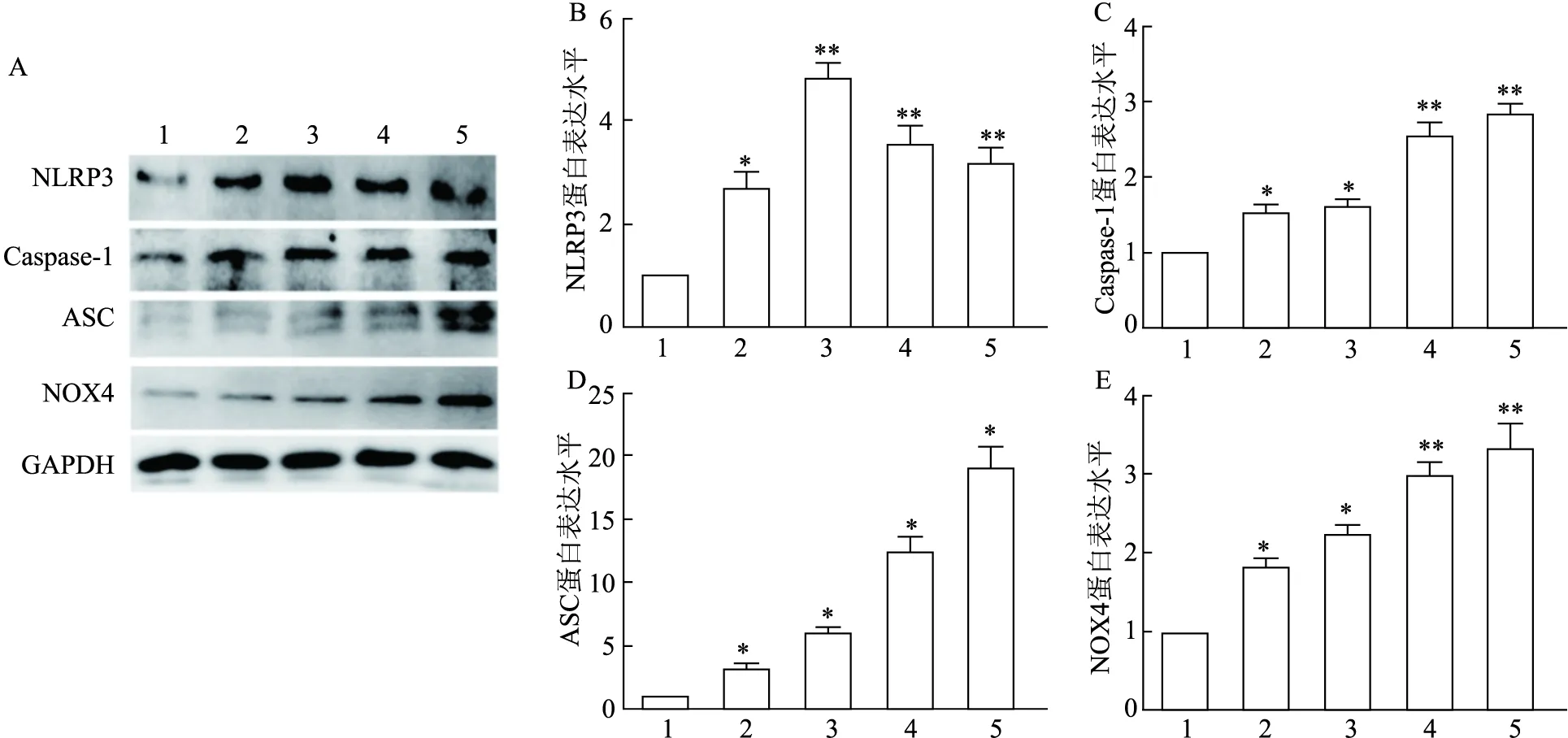
图7 PA暴露对HK-2细胞NLRP3、Caspase-1、ASC和NOX4表达的影响
3 讨论
DN是糖尿病最严重、最常见的并发症之一,最终会导致慢性肾功能衰竭,这也是糖尿病患者死亡的重要原因之一。越来越多的证据表明,除了肾小球的损伤外,HK-2细胞的损伤在DN中具有重要作用。越来越多的研究[6]表明,2型糖尿病(T2DM)患者血浆中含有游离脂肪酸(FFAs)的水平高于健康人群,而过高的FFAs可导致机体胰岛素抵抗,并引起胰岛素分泌异常,这可能是T2DM发病的主要诱因。PA是FFAs中含量最丰富的饱和脂肪酸,约占FFAs总量的25%。该课题组前期研究[7]表明,HK-2细胞在PA的刺激下,引起细胞凋亡并且加重了肾损伤。该研究结果显示,细胞活力随PA作用时间延长显著降低,细胞凋亡率和脂质沉积随PA作用时间延长显著增加,表明PA暴露可时间依赖性的导致HK-2细胞损伤,可能是DN发生发展的重要诱因。
目前,PA暴露导致的HK-2细胞损伤的机制尚不完全清楚。细胞内 ROS升高在DN的发病机制中起着重要作用。有研究[8]显示,多酚酸酯可通过调节DN中NOX4的活性来预防高糖诱导的足细胞损伤。前期研究[9]显示,PA暴露可明显增加肾小球系膜细胞NOX4介导的ROS生成增加,导致肾小球系膜细胞纤维化。在该研究中,随着PA暴露时间的延长,HK-2细胞中ROS水平和NOX4的表达明显同步增加,说明 NOX4 介导的 ROS 积累与PA导致的HK-2细胞损伤密切相关。SOD和GSH是细胞内重要的抗氧化分子,维持机体中氧化与抗氧化系统之间的平衡。在该实验中,随着PA暴露时间的延长,HK-2细胞中SOD和GSH出现下降,表明PA可以导致HK-2细胞抗氧化作用减弱。这些结果表明,PA暴露可导致HK-2细胞氧化还原状态失衡,可通过增强氧化应激引起HK-2的损伤和凋亡。
慢性炎症在DN的形成中起着重要作用,氧化应激可以进一步激活炎症小体,促进炎症反应的发生发展,加重DN的病理损伤。炎症小体激活是促进炎症反应的中心环节, 多种因素可以导致NLRP3激活,将pro-Caspase-1裂解为Caspase-1,从而促进IL-1β和IL-18前体的成熟和释放[10]。有研究[11]表明,在HG诱导的HK-2细胞中NLRP3的表达增加,IL-18、Caspase-1和IL-1β的表达也增加。研究[12]表明,机体中过多ROS可以激活NLRP3炎性小体,引起肾损伤,二氢槲皮素显著抑制细胞增殖和ROS的过量产生,并减轻NLRP3的激活和肾纤维化。该研究结果显示,在PA诱导的HK-2细胞中,NLRP3、ASC、Caspase-1以及IL-1β和IL-18促炎因子的表达均显著升高,随着PA暴露时间的延长,这些炎症相关蛋白的表达进一步升高。这些结果表明,PA诱导可以激活HK-2细胞中的NLRP3炎症小体,从而导致HK-2细胞的炎症损伤。
综上所述,PA可以诱导HK-2细胞的损伤,其机制可能与激活NOX4-NLRP3炎症小体,导致HK-2细胞氧化应激和炎症有关。该实验表明高血脂可能在糖尿病肾病的发病中具有重要作用,这对找到有效的预防或保护方法来延缓DN的进展具有重要意义。
