禽早期胚胎发育的分子机制研究进展
2022-07-13傅高惠陈慧芳蔡健锋刘俊杰白银山
李 超,傅高惠,陈慧芳,蔡健锋,刘俊杰,白银山
(佛山科学技术学院生命科学与工程学院,广东佛山 528231)
自然界中,卵子受精后形成合子,开始的合子基因组处于沉默状态,胚胎发育主要依赖卵母细胞质中储存的RNA 和蛋白质。随着合子基因组逐步被激活(Zygotic Genome Activation,ZGA)以及母源RNA 和蛋白质在发育过程中也逐渐被清除,胚胎发育调控开始由合子基因组主导,这一过程为母源-合子转换(Maternal-Zygotic Transition,MZT)。关于哺乳动物卵子受精过程、雌雄原核迁移机制、合子卵裂、MZT 过程和ZGA 发生的分子机制,在人和老鼠中已有大量研究被报道,但对于禽类相关分子机制的研究尚不明确和完善。
随着发育生物学领域的发展,家禽早期胚胎发育的分子机制也有了一些新的发现。研究显示,禽卵子受精后的早期胚胎将在母体内发育持续24~26 h,其中早期胚胎发生多次卵裂并伴随着MZT 过程。Han 等测序发现,最初合子转录不活跃,ZGA 启动主要依赖于和等重要母源转录因子的表达。与哺乳动物不同,禽类合子基因组中的母方基因先被激活,来调控早期胚胎前期卵裂过程,父方基因组在发育后期才被激活。另外,NOTCH、WNT、MAPK、TGF-信号通路在早期发育过程中也被启动,这揭示禽类胚胎发育分子机制独特的模式。本文主要围绕禽类卵子发育、卵子受精以及合子在母体内发育的主要分子机制进行综述,以推动禽早期胚胎发育在生命科学研究领域的研究和应用。
1 禽类卵子发育
禽类卵巢高度发达,具有独特的卵子发育过程。禽类卵泡由1 个卵母细胞、卵泡膜细胞(Theca Cell,TCs)和颗粒细胞(Granulosa Cells,GCs)组成。禽卵泡发育过程中的雄激素和雌激素主要由TCs 产生,而哺乳动物卵巢中的雌激素由GCs 分泌。GCs 在禽卵泡发育过程中受到促卵泡刺激素(Follicle Stimulating Hormone,FSH)调控。发育初期,位于卵巢皮质内的原始卵泡被激活为生长卵泡(1~4 mm),其中和在卵泡发育过程中起着重要的调控作用。6 个原始卵泡逐个被激活成生长卵泡后排列整齐,依次从卵巢血管系统中吸收大量脂质和叶黄素,每个卵泡在经历约9 d 的发育后,形成一个富含蛋白质的卵黄,最终成熟卵泡(最大40 mm)被排出卵巢,此时的卵子被卵黄膜包裹。
2 卵子受精
禽类雌性生殖道由漏斗部、膨大部、峡部、子宫和阴道组成,卵子受精过程在漏斗部完成。自然状态下,卵子和精子只有在合适的时间和位置才能结合形成受精卵,进而实现后续发育。禽类受精过程和方式不同于哺乳动物,为增加配子相遇的机会,禽类精子进入雌性生殖道后将被储存在漏斗部和子宫与阴道交界处的一种特殊的管状内陷结构中,这种结构被称为精子储存小管(Sperm Storage Tubules,SST)。SST 的存在使禽类精子得以在雌性体内存活2~15 周。研究发现,在禽SST 中储存的精子自身是不运动的,其能够利用外源脂肪酸氧化释放的能量来对抗SST 中液体的流动,防止精子流出SST。一些蛋白如碳酸酐酶、亲和素、水通道蛋白和碱性磷酸酶在精子储存过程中发挥重要作用。此外,SST 的结构和转化生长因子TGF-可以避免精子在雌性体内发生免疫反应。
排卵后,储存在漏斗部SST 的精子在孕酮的作用下解离并释放,随后完成受精。受精整个过程仅需15 min,包括精子顶体反应、精子穿透卵黄膜、雌雄原核融合以及合子形成。但值得注意的是,哺乳动物受精为单精入卵,而禽类表现为多精入卵。研究发现,精子进入卵子的过程可以引起卵子内Ca发生变化,形成Ca波激活信号。哺乳动物的单个精子进入卵子后,形成的Ca波可以从进入部位扩散到整个卵子中,促使受精完成;而禽类单个精子所形成的Ca波仅能传播至单个卵子的1/8~1/4,导致无法完成受精,这是致禽卵子需要多精入卵的原因之一。与哺乳动物相同,最后仅有1 个雄原核与雌原核融合,禽类卵子会选择与最靠近雌原核的雄原核发生融合。未发生融合的其他雄原核则会发生退化,其在进入卵子3~4 h 后开始向细胞质外围移动,最终被脱氧核糖核酸酶降解(图1)。目前,关于禽类多精入卵和雄原核的选择机制的研究还有很多未知,仍需要更进一步的探究。
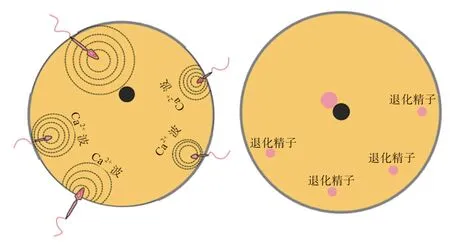
图1 禽胚受精的多精入卵过程
3 禽胚胎早期发育过程
卵子受精后产生的合子在雌性生殖道内移动24~26 h。膨大部的上皮组织在约3 h 内分泌蛋白来包裹卵黄。随后合子在峡部移动约1.5 h,获得由X 型胶原组成的壳膜。最终合子进入子宫停留约20 h,从母体血液中吸收Ca并将其附着于壳膜表面以形成碳酸钙晶体(即蛋壳),在移动过程中合子会缓慢旋转,使Ca分布更加均匀。
受精卵在子宫移动过程中不断发生卵裂,根据耶尔基勒迪及柯查夫(Eyal-Giladi and Kochav,EGK)禽早期胚胎时段分类标准,可将其分为EGK I 期、EGK II 期、EGK III 期、EGK IV 期、EGK V 期、EGK VI 期、EGK VII 期、EGK VIII 期、EGK IX 期和EGK X 期(明暗区形成期)。EGK I 早期发生2 次卵裂,形成4个细胞,随后以辐射状产生8 个细胞,此时胚胎中心的初始卵裂区细胞体积小于后期卵裂细胞;EGK II 期生成16 个完全细胞化的卵裂球;EGK III 期的中心分裂区细胞比外围细胞分裂速度更快,共形成128 个细胞,与此同时卵黄上部的细胞开始分层;EGK IV 期形成512 个细胞;EGK V 期细胞分裂速度较前期更为迅速,此时进入快速卵裂期;EGK VI 期的细胞数约为8 000个,且卵黄上一般有5~6 层细胞;EGK VII 期细胞层开始与卵黄分离形成明区,未分离区域与卵黄粘连导致透明度较差的区域则为暗区;EGK VIII 期细胞层数不断减少,到EGK IX 期明区显著并扩展,暗区也凸显出来;EGK X 期胚胎的细胞数可达55 000 个,此时明区细胞层数逐渐减少至1~2 层,上层以单个细胞连续排列,下层细胞则不连续排列;靠近暗区的细胞仍然是多层的,与卵黄保持紧密接触。明区细胞层与卵黄之间的空隙被称为囊胚腔,此时的明区和暗区十分清晰(图2)。
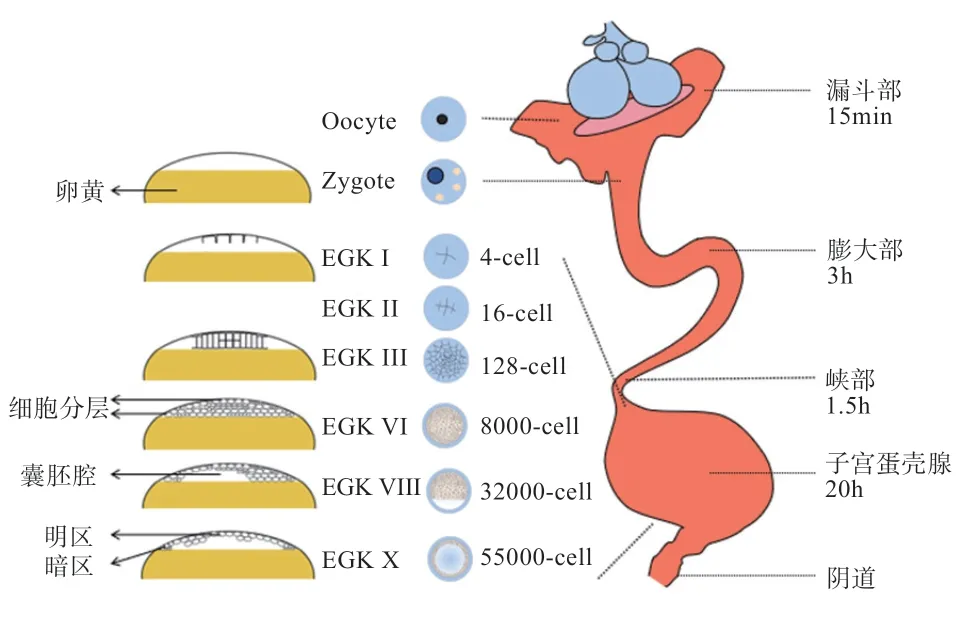
图2 早期胚胎发育过程
4 早期胚胎发育分子机制
4.1 母源物质清除 禽类中关于母源物质清除存在2 种理论。第1 种理论认为母源物质的清除主要由母源因子调控,该理论中RNA 的清除有多种机制,如RNA结合蛋白介导的RNA 降解、小RNA 诱导的mRNA 翻译沉默、空间控制RNA 的清除和依赖N甲基腺苷的RNA 衰变;此外,还包括自噬-溶酶体途径、泛素-蛋白酶降解途径和内吞作用3 种蛋白质清除途径。第2种理论则认为母源物质的清除主要由合子调控,即主要受合子的转录和翻译产物的控制。
4.2 ZGA 时期 在动物早期胚胎发育过程中,ZGA 一般会出现两波,第1 波发生在受精后被称为ZGA 小波,可以引起少量合子基因组的转录;第2 波一般在几次卵裂之后出现称为ZGA 大波,转录出大量合子基因组RNA。不同物种的ZGA 时间都有所不同,在人和小鼠早期胚胎发育过程中,ZGA 发生在8 细胞之前。早期研究利用RNA 聚合酶II C 末端结构域磷酸化检测,推测禽胚胎ZGA 的发生时期。最新研究中,通过对禽早期胚胎在母体内发育各个阶段测序,发现卵子-合子期、合子-EGK I 期及EGK I-EGK X 期这3大阶段中的部分时期呈现基因表达差异(Differentially Expressed Genes,DEGs)。其中DEGs 在卵子-合子和EGK III-EGK VI 期改变最大,推断禽ZGA 小波发生在卵子-合子期,而ZGA 大波发生在EGK IIIEGK VI 期(表1)。随后研究也证实了禽类ZGA小波发生时期处于卵子-合子期,并将ZGA 大波发生时间区间细化到EGK IV-EGK V 期,并在后续时期中保持。

表1 禽胚胎在管道中发育DEGs 的表达[5]
4.3 早期胚胎发育相关分子机制 ZGA 很大程度上依赖于母源转录因子的表达。在已知动物胚胎发育时期,对ZGA 发挥重要作用的转录因子包括和。在禽类中,以及SOX3 在各时期的表达水平已被研究鉴定。和能够维持胚胎干细胞的自我更新和多能性,并且起着调节细胞周期的作用,在卵母细胞和胚胎发育的整个时期均表现为弱表达,而的表达量随着胚胎发育时间的推移逐渐增高;具有DNA 结合转录因子活性、染色质结合活性和蛋白质异二聚体化活性等功能,在胚胎发育过程中,其表达量也逐渐增加,尤其是在ZGA 大波后(EGK V-EGK X 期)增加量变化显著;在神经组织中表达,促进神经细胞分化,可以作为神经系统发育的标志物和神经干细胞的重要标记基因,但在禽类卵母细胞和早期胚胎中均不表达;是调控胚胎发育和决定细胞命运的关键转录因子,在发育前期呈低水平表达,在EGK VIII-EGK X 期转变为高水平表达。目前,许多转录因子尚未在鸟类基因组中发现,后续研究对特异性转录因子在ZGA 的表达与鉴定,及其在细胞分裂和分化中作用的评估都具有重要意义。
哺乳动物雌雄原核融合过程中将发生ZGA 小波,其雄原核激活比雌原核时间更早。但在家禽中,母方基因组在禽的ZGA 小波期间首先转录,如D和基因表达上调,而父方基因组保持沉默。研究显示这些在禽类ZGA 小波中激活的母方基因与早期胚胎细胞分裂有关,父方基因组的转录抑制主要通过基因组蛋白的修饰实现。当ZGA 大波开始后父方基因组被激活,胚胎发育由双等位基因共同调控,这种雌原核先激活的调控机制,可防止禽类合子因多个雄原核的存在而可能产生的遗传偏差。在ZGA过程中还涉及GO和KEGG功能富集通路(表2)。
表2 ZGA 涉及的GO 和KEGG 功能富集通路[5]
禽类早期胚胎发育中ZGA 过程涉及多种信号通路,这些途径中的基因表达具有差异。NOTCH 信号通路中,和在合子中的表达高于EGK VI 期,而和在EGK VI 期的表达高于合子。WNT 信号通路中的和以及NOTCH 信号通路中的和在禽胚中差异表达,调控细胞分裂及分层。在WNT 信号通路中,和在EGK VI 期中的表达相较于合子更高,而和在合子与EGK VI 期中的表达水平相当,并且WNT 配体和受体相关基因和从合子开始上调,并在EGK VI 期后开始下调,而和则 在EGK VI-EGK VIII 期上调。MAPK 信号通路转导与早期胚胎的有丝分裂有关,其中和在合子中的表达高于EGK VI 期,而和在合子和EGK VI 期的表达相当。TGF-信号通路中,和在EGK VI 期的表达显著高于合子(表3)。与哺乳动物相比,NOTCH 信号通路中的和在禽的各个阶段均参与表达,但在人和小鼠中没有表达;激酶、和在哺乳动物的早期分裂中表达较低,主要在分裂期表达;在TGF-家族中,仅在禽胚胎明区形成期特异性表达,而在哺乳动物的胚胎发育后期才表达。

表3 禽类卵裂过程基因表达的动态变化[53]
表观遗传学修饰是胚胎发育的基础,其中能编码持续型甲基化转移酶,负责DNA 复制后的子链DNA 甲基化,参与细胞增殖调控。在禽早期胚胎中,在合子-EGK VI 期上调并在EGK VIII 期开始下调,表达的动态变化使得早期胚胎发育中基因组甲基化的水平不断改变,从而调控胚胎发育所需基因的表达。和是从头甲基化酶,对多能干细胞的干性维持具有重要作用,和在EGK VIII-EGK X 期上调。研究发现和在合子-EGK VI 期下调并在EGK VIII 开始上调,组蛋白H3 乙酰化相关的基因在合子-EGK VI 期上调,在EGK VIII 期开始下调。
5 禽胚胎体外发育及基因表达调控
禽胚在体外发育,中枢神经系统在最开始就被诱导发育、接下来启动血管发育。根据Hamburger and Hamilton 制定的禽蛋产出发育标准(HH),可以将产出后48 h 分为HH1-12 期。转录抑制因子(Positive Regulatory Domain 1,PRDM1)能够决定胚胎发育时期细胞命运并调控组织器官发育,尤其在神经发育中发挥重要调控作用。在HH4 期,出现在胎盘前区域和神经板边界的细胞中,HH5 期其表达上调,HH7 期其延伸到外胚层和中胚层。此外,和这7种与相关的基因在禽胚中表达。禽类的血管系统起源于中胚层,位于原条后侧的中胚层前体中的细胞受到包括BMP、FGF 和WNT 等途径调节分化为血液、血管内皮细胞和血管平滑肌细胞。在HH7 期,血岛中一些细胞已开始表达分化为红细胞;到HH10 期,早期血管母细胞标志物和造血标志物开始局限在血细胞中表达,而早期血管母细胞标志物和血管标志物将标记内皮血管细胞系。
6 小结和展望
随着高通量测序技术的不断发展和禽类胚胎发育生物学的不断完善,关于禽早期胚胎发育规律及分子机制逐渐被解析,但仍存在很多问题尚未得到阐述,禽类属于多精子入卵的动物,其中的调控机制并不清楚。卵子受精以后,基因表达模式的改变、信号通路的激活和启动早期胚胎发育等事件,促进了新生命的起始和发育,一直是生命科学研究的热点问题。禽类作为胚胎发育研究的理想的动物模型,其分子机制对推动养禽业发展和鸟类胚胎发育具有重要意义。本文主要对禽早期胚胎发育过程中的各阶段主要事件进行阐述和总结,探究其中的分子机制及其之间的联系,有利于更好地推进禽早期胚胎发育分子机制的研究,为完善禽类胚胎发育机制奠定基础。
