野菊药用及非药用部位中总黄酮和总酚酸的质量分数测定
2022-07-12杨勇,魏民,严露,杨菁
杨 勇,魏 民,严 露,杨 菁
(1.贵州中医药大学 药学院,贵州 贵阳 550025;2.贵州中医药大学 茶+大健康食品开发研究中心,贵州 贵阳 550025;3.华润三九医药股份有限公司,广东 深圳 518110;4.安徽中医药大学 药学院,安徽 合肥 230012)
野菊花(Flos Chrysanthemi Indici)为菊科(Asteraceae)植物野菊(Chrysanthemum indicumL.)的干燥头状花序,性凉、味苦、辛,归肝、心经,具有清热解毒、抗菌消炎的功效,是治疗疔疮痈肿、目赤肿痛、头痛眩晕的常用中草药[1]。野菊花的主要成分包括黄酮类、酚酸类、萜类、挥发油类、多糖类、甾体类及烃类等[2],但其抗菌消炎、清热解毒的药效成分主要是黄酮类和以绿原酸为代表的酚酸类化合物[2-3]。
市场上以野菊花为原料的中成药、日化用品和茶饮种类繁多,导致近年来野菊花的需求量巨大。目前,市场上均以花序作为野菊的药用部位,而非药用部位(根、茎和叶)往往得不到充分利用。前人已采用高效液相色谱或超高效液相色谱等方法对野菊花、叶、茎中的单一或多个黄酮和酚酸类成分进行定量分析[4-6]。由于野菊花抗菌消炎、清热解毒的药效贡献主要来自其所含的黄酮和酚酸类成分的协同作用,对其中单一或多个成分含量的测定并不能真正表征野菊花的药理活性。目前,测定野菊中总黄酮和总酚酸的方法尚未见报道,且总黄酮和总酚酸类药效成分在野菊药用及非药用部位中的含量也不清楚,建立相应的方法进行测定,有助于为野菊非药用部位的开发利用提供科学依据。
1 仪器与材料
紫外-可见分光光度计(UV-5900型,上海元析仪器有限公司),电子分析天平(AR2140型,奥豪斯国际贸易有限公司),超声波提取器(上海科导超声仪器有限公司),数显恒温水浴锅(常州市华普达教学仪器有限公司)。
芦丁对照品(上海笛柏生物科技有限公司,批号153-18-4,纯度不低于98.00%),绿原酸对照品(上海笛柏生物科技有限公司,批号327-97-9,纯度不低于98.00%)。无水乙醇、醋酸、醋酸钠、盐酸、三氯化铝、十二烷基硫酸钠、铁氰化钾、三氯化铁和其他试剂均为分析纯,试验用水为蒸馏水。
实验所需野菊药材由华润三九医药股份有限公司提供,采于湖北省阳新县,为栽培型品种,经贵州中医药大学麻秀萍教授鉴定为野菊Chrysanthemum indicumL.的全株。将野菊各部位分离后经60 ℃烘箱烘干,粉碎,过3号筛,分装于密封袋中备用。
2 方法与结果
2.1 总黄酮质量分数测定方法
2.1.1 对照品溶液的制备
精确称取11.240 mg芦丁对照品置于25.00 mL容量瓶中,用70.00%乙醇溶解并定容,配制成0.449 6 mg/mL的对照品溶液。
2.1.2 供试品溶液的制备
精确称取野菊根、茎、叶和花样品约0.25 g,置于50.00 mL具塞锥形瓶中,精确加入30.00 mL 70.00%乙醇,称重,超声提取40 min,冷却至室温,用70.00%乙醇补足失重,摇匀、过滤,得野菊各部位供试品溶液。
2.1.3 显色剂溶液的配制
称取AlCl31.34 g,加100.00 mL水溶解,得0.1 mol/L AlCl3溶液;取一定量0.2 mol/L CH3COONa溶液(2.72 g CH3COONa·3H2O加水溶解成100.00 mL溶液),加入0.2 mol/L HAc溶液(1.15 mL冰醋酸加水稀释至100.00 mL)调节pH至5.2,得NaAc-HAc缓冲溶液。
2.1.4 显色方法
杨雅欣等[7]指出,采用NaNO2-Al(NO3)3-NaOH显色方法对黄酮类化合物显色后会产生红色絮状物,导致测量结果不准确,所以本实验采用显色后不会出现絮状物的AlCl3-NaAc-HAc显色法。精确吸取适量对照品或供试品溶液于10.00 mL容量瓶中,加0.1 mol/L AlCl3溶液0.50 mL和NaAc-HAc缓冲溶液(pH=5.2)2.00 mL,用70.00%乙醇稀释至刻度,摇匀,显色20 min后测定。
2.1.5 标准曲线的绘制
分别精确吸取0.449 6 mg/mL芦丁对照品溶液0.10、0.20、0.30、0.40、0.50、0.60、0.70 mL于10.00 mL容量瓶中,按“2.1.4”方法显色后,同样方法制备空白溶液。于411 nm处分别测定吸光度,以吸光度为纵坐标、质量浓度(mg/mL)为横坐标绘制标准曲线,计算回归方程。回归方程为:Y=24.71X+0.018,相关系数r=0.999 5,表明对照品溶液质量浓度在0.004 5~0.031 5 mg/mL与吸光度呈良好的线性关系。
2.1.6 方法学验证
2.1.6.1 精确度试验
精确称野菊花样品0.25 g,按“2.1.2”方法制备供试品溶液,并按“2.1.4”方法进行显色,于411 nm处测定吸光度,重复测定6次,总黄酮吸光度平均值为0.633,相对标准偏差(Relative Standard Deviation,RSD)为0.02%,表明仪器的精确度良好。
2.1.6.2 重复性试验
精确称取0.25 g野菊花样品6份,按“2.1.2”方法制备供试品溶液,并按“2.1.4”方法进行显色,于411 nm处测定吸光度,计算得总黄酮平均质量分数为2.74%,RSD为0.45%,结果表明方法重复性良好。
2.1.6.3 稳定性试验
精确称定野菊花样品0.25 g,按“2.1.2”方法制备供试品溶液,并于1、2、4、8、12、24 h按“2.1.4”方法进行显色,于411 nm处测定吸光度,平均吸光度为0.602,RSD为1.33%,表明供试品溶液在24 h内稳定性良好。
2.1.6.4 加样回收率试验
精确称取6份已知含量的野菊花样品0.10 g,分别加入0.449 6 mg/mL芦丁对照品溶液6.62 mL,70.00%乙醇补至30.00 mL,称重,超声提取40 min,冷却至室温,用70.00%乙醇补足失重,摇匀、过滤,得供试品溶液。按“2.1.4”项下方法进行显色,于411 nm处测定吸光度,计算回收率和RSD,结果见表1。
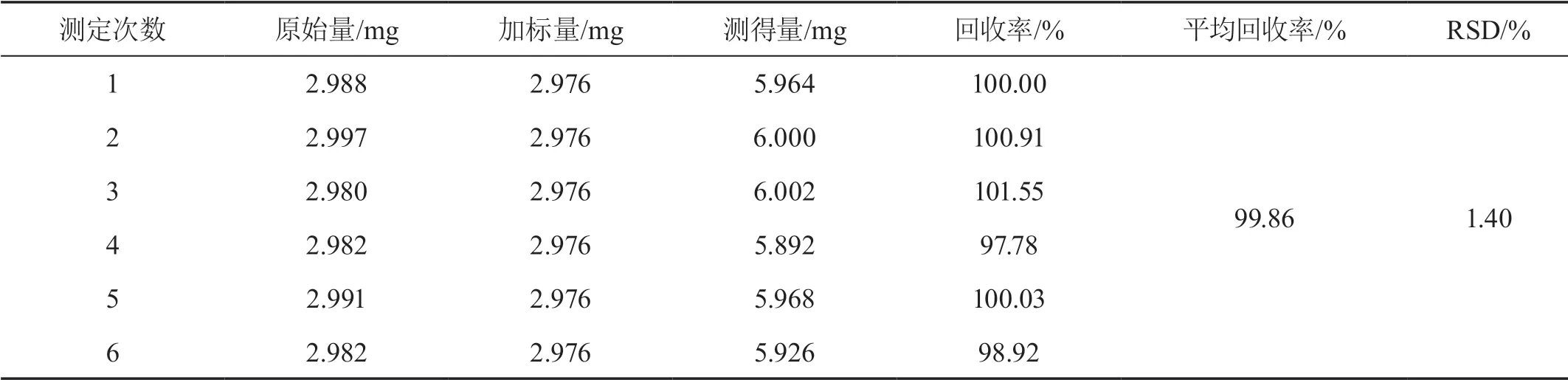
表1 总黄酮加样回收率试验结果(n=6)
2.1.7 野菊药用及非药用部位中总黄酮质量分数测定
精确称取野菊根、茎、叶和花样品0.25 g各3份,按“2.1.2”方法制备供试品溶液,并按“2.1.4”方法进行显色,于411 nm处测定吸光度,按干燥品计算野菊各部位中总黄酮的质量分数,结果见表2和图1。
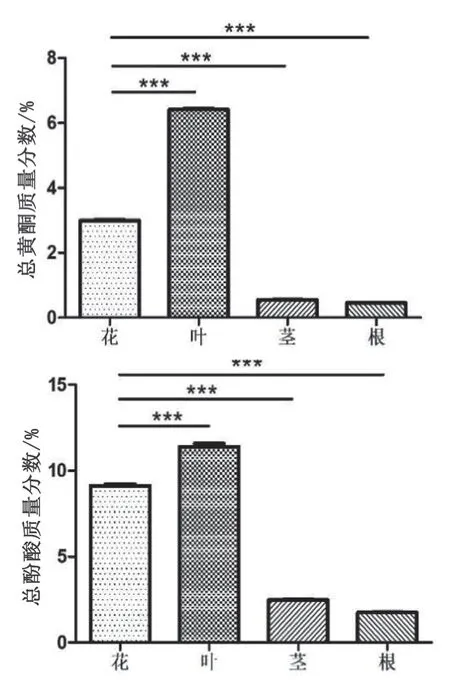
图1 野菊各部位中总黄酮和总酚酸的质量分数(与花比较,***p<0.001)
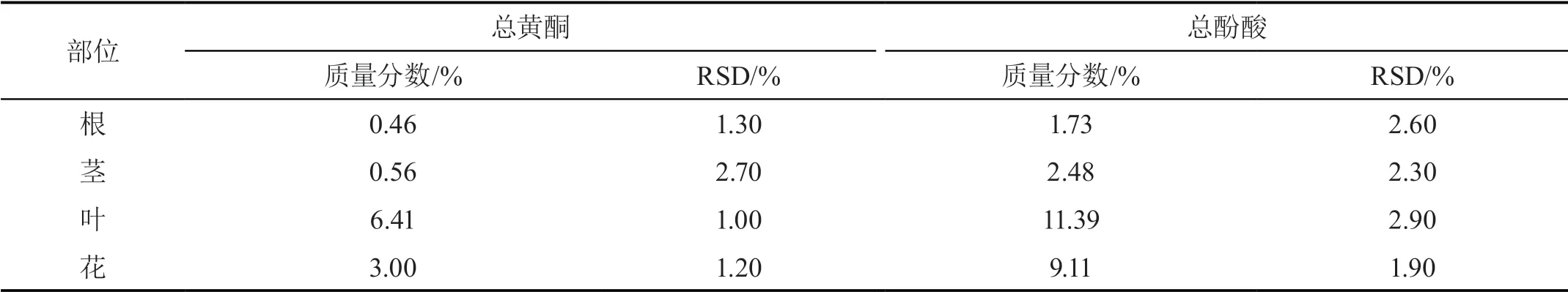
表2 野菊不同部位中总黄酮和总酚酸质量分数(n=3)
2.2 总酚酸质量分数测定方法
2.2.1 对照品溶液的制备
精确称定10.230 mg绿原酸对照品置于25.00 mL容量瓶中,用80.00%乙醇溶解并定容,配制成0.409 1 mg/mL的对照品溶液。
2.2.2 供试品溶液的制备
精确称取野菊根、茎、叶和花样品0.60 g,置于50.00 mL具塞锥形瓶中,精确加入30.00 mL 80.00%乙醇,称重,超声提取30 min,冷却至室温,用80.00%乙醇补足失重,摇匀、过滤,得野菊各部位供试品溶液。
2.2.3 显色剂溶液的配制
精确称取十二烷基硫酸钠0.30 g,加入100.00 mL超纯水溶解于细口试剂瓶中,得0.30% SDS溶液;精确称取铁氰化钾0.90 g,加入100.00 mL超纯水溶解于棕色细口试剂瓶中,得0.90%铁氰化钾溶液;精确称取三氯化铁0.60 g,加入100.00 mL超纯水溶解于棕色细口试剂瓶中,得0.60%三氯化铁溶液。使用时,0.90%铁氰化钾与0.60%三氯化铁按1∶1混匀,现配现用。
2.2.4 显色方法
参考付煜荣等[8]的研究,精确吸取适量待测液于10.00 mL容量瓶中,加无水乙醇至2.00 mL,精确加0.30%十二烷基硫酸钠0.80 mL、0.60%FeCl3-0.90%K3[Fe(CN)6](1.0∶0.9)混合溶液0.40 mL,摇匀,在暗处放置5 min后,用0.1 mol/L HCl定容,摇匀,暗处放置20 min。
2.2.5 标准曲线的绘制
分别精确吸取0.409 1 mg/mL绿原酸对照品溶液0.10、0.20、0.30、0.40、0.50 mL于10.00 mL容量瓶中,按“2.2.4”方法显色后,同法制备空白溶液。于724 nm处分别测定吸光度,以吸光度为纵坐标、质量浓度(mg/mL)为横坐标绘制标准曲线,计算回归方程。回归方程为:Y=63.36X-0.157 2,相关系数r=0.999 2,表明对照品溶液质量浓度在0.004 1~0.020 4 mg/mL与吸光度呈良好的线性关系。
2.2.6 方法学验证
2.2.6.1 精确度试验
精确称取野菊花样品0.60 g,按“2.2.2”方法制备供试品溶液,并按“2.2.4”方法进行显色,于724 nm处测定吸光度,重复测定6次,总酚酸吸光度平均值为0.997,RSD为0.11%,表明仪器精确度良好。
2.2.6.2 重复性试验
精确称取0.60 g野菊花样品6份,按“2.2.2”方法制备6份供试品溶液,于724 nm处测定吸光度,计算得总酚酸平均质量分数为9.06%,RSD为1.10%,结果表明方法重复性良好。
2.2.6.3 稳定性试验
精确称定野菊花样品0.60 g,按“2.2.2”方法制备供试品溶液,并于1、2、4、8、12、24 h在724 nm处测定吸光度,平均吸光度为0.989,RSD为0.35%,表明供试品溶液在24 h内稳定性良好。
2.2.6.4 加样回收率试验
精确称取6份已知含量的野菊花样品0.10 g,分别加入0.409 1 mg/mL绿原酸对照品溶液22.00 mL、80.00%乙醇补至30.00 mL,称重,超声提取30 min,冷却至室温,用80.00%乙醇补足失重,摇匀、过滤,得供试品溶液。按“2.2.4”方法进行显色,于724 nm处测定吸光度,计算回收率和RSD,结果见表3。
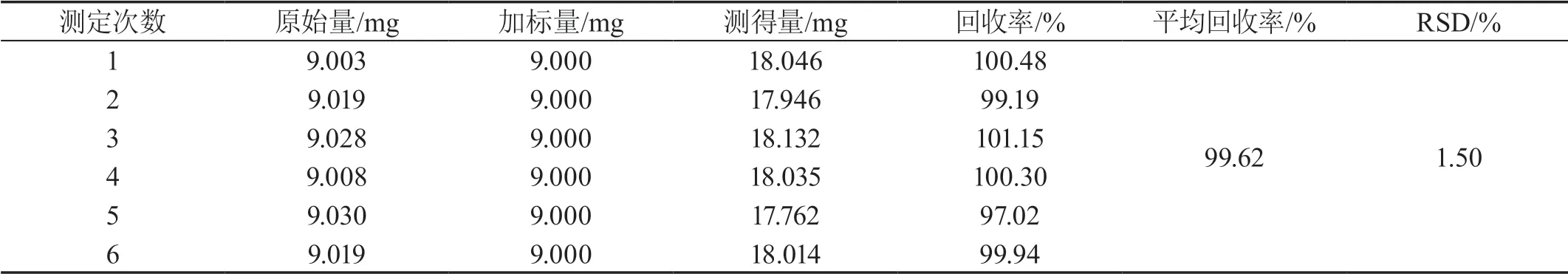
表3 总酚酸加样回收率试验结果(n=6)
2.2.6.5 野菊药用及非药用部位中总酚酸质量分数测定
精确称取0.60 g野菊根、茎、叶和花样品各3份,按“2.2.2”方法制备供试品溶液,并按“2.2.4”方法进行显色,于724 nm处测定吸光度,按干燥品计算野菊各部位中总酚酸的质量分数,结果见表2和图1。
3 讨论
野菊花清热解毒、抗菌消炎的功效主要来自黄酮类和酚酸类成分的协同作用[3],表明单一黄酮或酚酸类成分的含量不能真正表征野菊花的药效作用。因此,对野菊中总黄酮和总酚酸质量分数的测定能从整体上评价野菊的药用价值。对野菊药用及非药用部位中总黄酮和总酚酸的质量分数进行测定,结果显示,野菊叶中总黄酮和总酚酸的质量分数均显著高于花、茎和根,这与前人对野菊不同部位中单一黄酮和酚酸成分含量测定的结果趋于一致[5-6],表明野菊叶可能具有比野菊花更好的清热解毒、抗菌消炎功效,但还需进一步的药效验证,同时也表明野菊叶具有开发利用价值。
对野菊中总黄酮的提取条件,即提取方式(回流提取、超声提取)、提取溶剂(30.00%乙醇、50.00%乙醇、70.00%乙醇、90.00%乙醇)、提取时间(10、20、30、40、50、60 min)以及料液比(1∶50、1∶80、1∶100、1∶120)进行考察,结果发现,在料液比1∶120、70.00%乙醇超声处理40 min条件下,野菊中的总黄酮可以达到最佳提取效率。
对野菊中总酚酸的提取条件,即提取方式(回流提取、超声提取)、提取溶剂(50.00%乙醇、60.00%乙醇、70.00%乙醇、80.00%乙醇、90.00%乙醇)、提取时间(10、20、30、40、50、60 min)以及料液比(1∶30、1∶40、1∶50、1∶60、1∶70)进行考察,结果发现,在料液比1∶50、80.00%乙醇超声处理30 min条件下,野菊中的总酚酸可以达到最佳提取效率。
