槲皮素包合物的制备与水溶性研究
2022-07-12盘振杰杨敏芬郭洋洋张贞发
盘振杰,杨敏芬,郭洋洋,张贞发,王 强
(广西民族师范学院 化学与生物工程学院,广西 崇左 532200)
槲皮素(Quercetin)作为一种在植物中分布比较广泛的天然膳食类黄酮化合物[1],是一种黄色针状结晶体,化学名为3,3’,4’5,7-五羟基黄酮,具有抑菌、防炎、抗癌、减缓氧化、止咳祛痰、平缓血压等生理功能和药理作用[2-5]。β-环糊精(β-Cyclodextrin,β-CD)及其衍生物具有特殊的结构和两亲性,据此弥补β-CD本身水溶性低、键合能力差和生物利用度低等缺陷,可提高β-CD在水溶液中的溶解度[6-9]。本研究通过β-CD合成其衍生物,并对槲皮素进行包合得到包合物,增强槲皮素的生物活性;用红外光谱(Infrared Radiation,IR)、扫描电子显微镜(Scanning Electron Microscope,SEM)对其进行表征,通过紫外线(Ultraviolet,UV)测定包合物结合常数和水溶性。
1 实验方案及方法
1.1 实验仪器和试剂
仪器:集热式恒温加热磁力搅拌器(DF-101S)、隔膜真空泵、电热鼓风干燥箱(DHG-9140A)、紫外-可见分光光度计(UV-6102S)、傅里叶变换红外光谱仪等;试剂:β-CD、丙酮、对甲苯磺酰氯、1,3-丙二胺、N,N’-双(3-氨丙基)乙二胺、槲皮素、甲苯磺酸盐(Tosylate,实验室制得)等。
1.2 N,N’-双(3-氨丙基)乙二胺修饰β-CD(H1)的合成
量取10 mL N,N’-双(3-氨丙基)乙二胺与2.00 g Tosylate混合并溶解,升温至75 ℃,反应8 h,冷却后将上述反应液缓慢滴加到丙酮中,出现大量白色絮状物,抽滤后得到固体,置于真空干燥箱中,50 ℃干燥得到粉末,即H1,产率约为18.15%。用相同的方法合成H2,产率约为17.55%。
1.3 H1/槲皮素包合物的制备
称取26.91 mg H1,用3 mL水溶解;将19.31 mg槲皮素溶于3 mL无水乙醇。将两种溶液置于反应器中,在45 ℃条件下缓慢搅拌4~6 h。反应液置于真空干燥箱中干燥,得到固体。用水溶解固体,溶液用0.45 μm纤维素膜过滤,得到滤液。滤液放在真空干燥箱中45 ℃烘干,得到的褐色固体即H1/槲皮素包合物。用相同的方法制得H2/槲皮素包合物,固体为褐色。
1.4 客体-槲皮素标准工作曲线的绘制
采用UV建立客体-槲皮素的标准工作曲线,配制一系列浓度梯度的槲皮素乙醇溶液,再测定其吸光度(Absorbance,Abs)。称取1.50 g槲皮素,用少量乙醇溶解于小烧杯中,转移定容(溶剂为无水乙醇)到10 mL容量瓶中,得到5.0×10-4mol/L标准溶液。取7个5 mL容量瓶,分别加入不同量上述标准溶液并用无水乙醇定容,得到浓度分别为0.8×10-5、1.6×10-5、2.4×10-5、3.2×10-5、4.0×10-5、4.8×10-5、5.6×10-5mol/L的槲皮素溶液,分别测其Abs。
1.5 结合常数的测定
采用紫外光谱法分别测定并计算H1、H2与槲皮素之间的稳定常数。配制10 mL 0.5 mmol/L的H1溶液;称取6.50 mg,用4 mL水溶解,再加6 mL无水乙醇定容于10 mL容量瓶中,得到0.5 mmol/L的H1溶液;同上所述步骤得H2溶液。取10支干燥的5 mL容量瓶,每个瓶中都加入200 μL上述槲皮素标准溶液,再依次加入不同体积的主体溶液,用无水乙醇与水的混合溶液(V无水乙醇∶V水=3∶2)定容,配制成一定浓度梯度的主-客体乙醇水溶液,浓度分别为0.6×10-5、1.2×10-5、1.8×10-5、2.4×10-5、3.0×10-5、3.6×10-5、4.2×10-5、4.8×10-5、5.4×10-5、6.0×10-5mol/L,再分别测其Abs。
1.6 包合物水溶性的测定
采用饱和水溶液法测定包合物的水溶性,取过量槲皮素放入装有100 μL蒸馏水的带盖小离心管中,盖好盖子充分振荡;再称取过量H1/槲皮素包合物和H2/槲皮素包合物分别溶于100 μL水中,振荡后恒温放置2 h,分别制得饱和溶液;放置一段时间,分别取一定量的上层清液,定容于5 mL容量瓶中(溶剂为水),稀释到一定浓度梯度的溶液即待测液,分别用紫外-可见分光光度计测待测液的Abs。
2 结果与讨论
2.1 红外光谱分析
将烘干的KBr研磨成粉末,压片后制作成基底,再在干燥的实验环境中将样品与KBr粉末碾磨均匀(比例约为1∶100),压成半透明的薄片,在500~4 500 cm-1内进行扫描,得到槲皮素、H1和H1/槲皮素包合物的红外吸收光谱图(见图1上)。a的主要特征吸收峰出现在3 357、1 667、1 616、1 534、1 272 cm-1处,b的主要特征吸收峰出现在3 365、2 949、1 686、1 463、1 202、1 125、1 075、628 cm-1处,H1与槲皮素包合物(c)的特征吸收峰中和了以上两种物质的特征吸收峰,两种物质的吸收峰大致相同,峰的强度有所差异,原因是所处环境不同,吸收强度不同。由此证明,H1和槲皮素已经形成了包合物。同理,H2和槲皮素也形成了包合物(见图1下)。
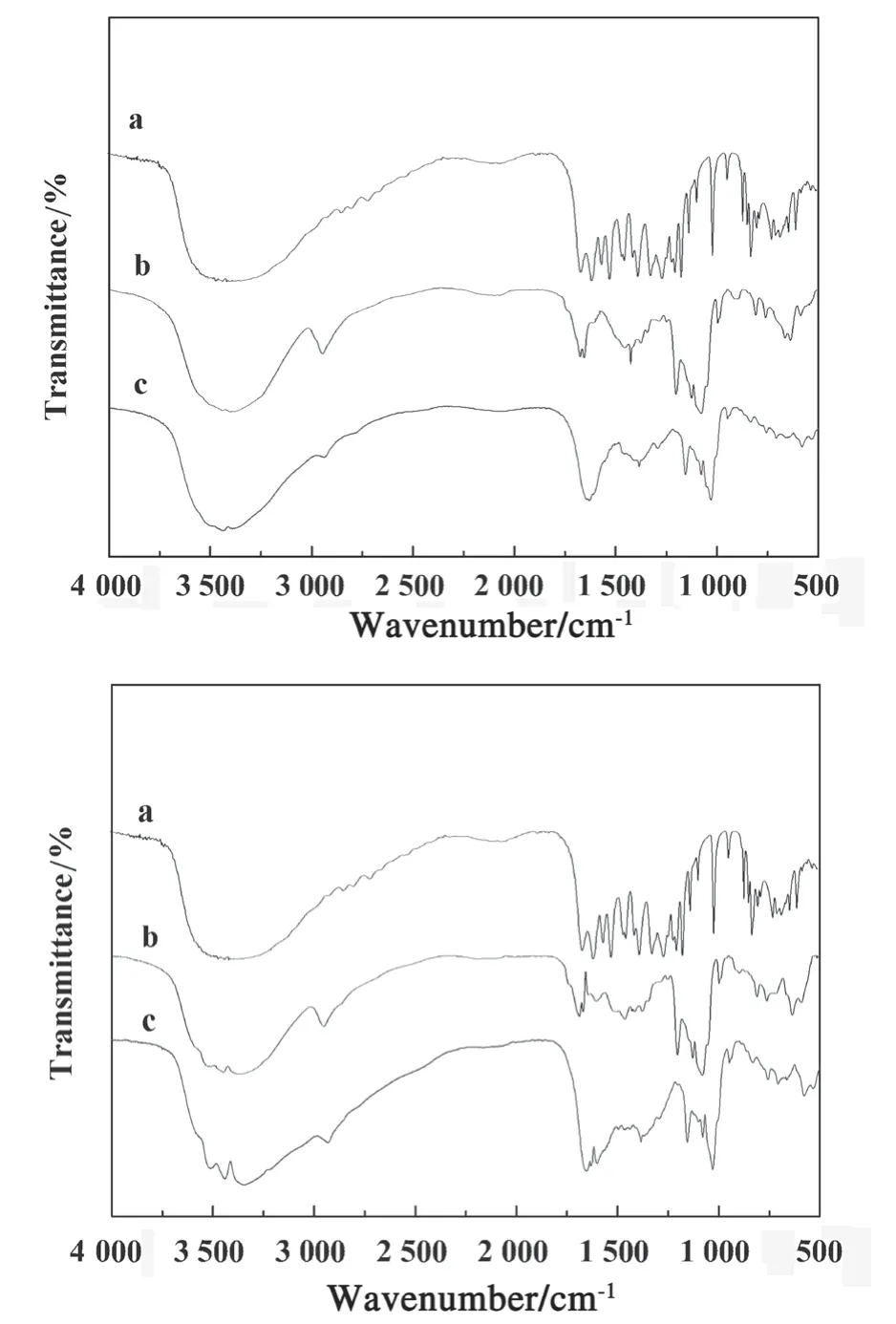
图1 红外光谱
2.2 扫描电镜分析
从图2所示的电镜扫描图中,可清晰地观察到各物质的表面形态。其中,A为槲皮素、B为H1、C为H1/槲皮素包合物、D为H2、E为H2/槲皮素包合物。A槲皮素呈表面光滑的细长条状;B呈表面粗糙的颗粒状;C呈表面光滑的碎片状;D呈表面凹凸不平的粗糙颗粒状;E呈表面光滑细腻的块状。由此可见,无论是H1还是H2,与槲皮素包合后,表面变得更加光滑平整,这可能是槲皮素与H1或H2相互作用引起的。
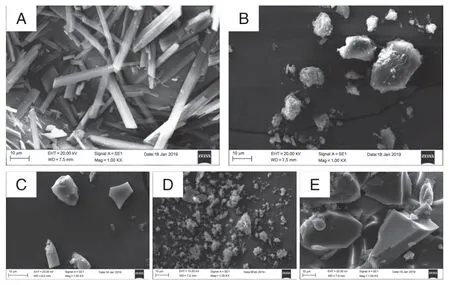
图2 扫描电镜
2.3 槲皮素标准曲线分析
配制好的槲皮素乙醇溶液浓度分别为0.8×10-5、1.6×10-5、2.4×10-5、3.2×10-5、4.0×10-5、4.8×10-5、5.6×10-5mol/L,在室温下扫描槲皮素的Abs(扫描波长λ在300~500 nm),结果见图3。由图3可知,在同一波长下测得的Abs先随着槲皮素乙醇溶液浓度的增大而增大,并在376 nm附近出现最高峰,因此,取λ=376 nm处的Abs绘制标准工作曲线,曲线方程为:y=0.232 6x+0.022 3(R2=0.998 5)。
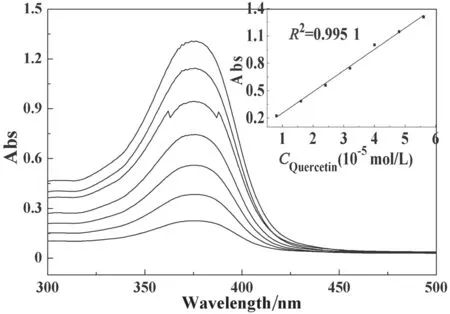
图3 槲皮素标准工作曲线
2.4 H/槲皮素的结合常数分析
客体在300~550 nm波长范围内有紫外吸收,而H1和H2在此区间几乎没有吸收,因此,选取固定的槲皮素浓度(2.0×10-5mol/L),只改变H1的浓度进行测定。在无水乙醇和水的混合溶液(V无水乙醇∶V水=3∶2)中加入H1,紫外吸收光谱和拟合线性曲线如图4所示。图4中的插图为[H]0[G]0/ΔA对[H]0绘制的拟合曲线,两者呈现良好的线性关系,表明H1与槲皮素的包合比为1∶1;随着H1的浓度不断增加,槲皮素的吸光度也不断增大,吸收峰由376 nm迁移到385 nm,发生轻微红移,可能是槲皮素与H1包合后产生p-π电子跃迁引起的[10],由此说明H1与槲皮素形成了包合物。

图4 紫外吸收光谱和结合常数拟合曲线
H1与槲皮素的包合比例为1∶1,因此,H1与槲皮素的反应过程满足下列公式[11]:

式中:[H]0表示H1的初始浓度,[G]0表示槲皮素的初始浓度,α为紫外光谱的敏感因子,ΔA为H1的相对紫外吸收强度。用[G]0[H]0/ΔA对[H]0作图,得到如图4所示的线性拟合曲线。由图4可看出,H1与槲皮素呈现良好的线性关系。H1与槲皮素之间的结合常数KS可以由拟合曲线的斜率与截距得出。经计算得到:KS/1=3.88×105。同理可得:H2与槲皮素的结合常数KS/2=3.11×105。
2.5 包合物水溶性分析
用紫外-可见分光光度计测待测液的Abs,根据室温下客体的标准工作曲线:y=0.105 1x-0.000 1(R2=0.999 4)计算得到,客体在水中的溶解度S=0.02 mg/mL,H1与槲皮素包合物在水中的溶解度S1=1.50 mg/mL,增容了75倍左右;H2与槲皮素的包合物在水中的溶解度S2=1.12 mg/mL,增容了56倍左右。
3 结语
首先,通过饱和水溶液合成2种修饰β-CD,通过IR、UV、SEM进行表征;其次,采用紫外光谱测定了H1、H2与槲皮素的结合常数,计算出H1/H2与槲皮素之间的结合常数KS,KS/1=3.88×105,KS/2=3.11×105;最后,采用饱和水溶液法比较两种包合物的水溶性。实验证明,H1与槲皮素的包合物增容了75倍左右,H2与槲皮素的包合物增容了56倍左右。原因可能是修饰β-CD中的氨基有效提高了CD对槲皮素的包合能力。H1比H2链上多两个“N”,增加了识别位点,提高了长链对槲皮素的包合能力,所以H1的溶解度和溶解性均大于H2。
