Hp相关性胃病脾胃湿热证、脾气虚证的胃黏膜菌群特征及炎症水平分析
2022-07-12廖桂彬唐舒婷廖晓意兰绍阳胡玲陈斌樊冬梅李培武陈昫
廖桂彬,唐舒婷,廖晓意,兰绍阳,胡玲,陈斌,樊冬梅,李培武,陈昫
(1.广州中医药大学第一临床医学院,广东 广州 510405;2.广州中医药大学第一附属医院,广东 广州 510405;3.广州中医药大学科技创新中心,广东 广州 510405)
幽门螺杆菌(Helicobacterpylori,Hp)相关性胃病是现代医学对于Hp感染所引起胃黏膜病变的简称,包括慢性非萎缩性胃炎(Chronic non-atrophic gastritis,CNAG)、慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)以及胃癌(Gastric cancer,GC)[1-2]。近年来,许多中医学者对Hp相关性胃病“病-证”关系进行了相关研究[3],李京尧、陈瑶等多项研究提示Hp相关性胃病实证常见脾胃湿热证及肝胃不和证,以脾胃湿热证为主,热、湿是其主要病理因素,而脾气虚证是Hp相关性胃病中出现频率较高的虚证证型,提示脾胃湿热、脾气虚与Hp相关性胃病的发病具有一定相关性[4-5]。
胃内微生态可直观地显示胃内菌群的组成及结构特征,越来越多的研究发现,胃内微生态失衡可能是Hp相关性胃病的重要致病因素之一[6-8]。课题组前期研究显示,慢性胃炎脾胃湿热证组Hp感染率与脾气虚证组相当,但感染程度高于脾气虚证组[9],此外,前期研究发现脾胃湿热证组白介素-1β(Interleukin-1β,IL-1β)、白介素-8(Interleukin-8,IL-8)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)等mRNA及蛋白均处于高表达状态[10-11],而IL-1β的强效抑酸作用可升高胃内pH值,有利于胃内细菌繁殖,提示Hp相关性胃病脾胃湿热证的发生可能与胃内微生态失衡存在一定联系。但目前鲜有关于Hp相关性胃病中医证型胃内微生态的研究,因此,本研究拟通过探究Hp相关性胃病脾胃湿热证、脾气虚证患者与健康受试者之间胃黏膜菌群特征以及炎症因子的表达差异,为Hp相关性胃病中医证型形成的机制研究提供思路。
1 临床资料
1.1 一般资料
选取2019年11月至2020年10月在广州中医药大学第一附属医院脾胃病科内窥镜室和胃肠外科就诊,且病理确诊为Hp相关性胃病的患者107例(包含CNAG患者49例,CAG患者45例,GC患者13例),其中脾胃湿热证患者70例,脾气虚证患者37例,同时招募平和体质健康受试者10例作为正常对照组。3组年龄比较差异无统计学意义(P>0.05),3组性别比较差异有统计学意义(P<0.05)。详见表1。脾胃湿热证组和脾气虚证组的Hp相关性胃病不同病种比较差异无统计学意义(P>0.05),详见表2,具有可比性。本研究经广州中医药大学第一附属医院伦理委员会审批通过(伦理批号:ZYYECK〔2019〕095)。
表1 Hp相关性胃病不同证候患者性别、年龄比较Table 1 Comparison of sex and age of different evidence of
表2 Hp相关性胃病不同证候患者病种比较Table 2 Comparison of disease types between different evidence of Hp-related gastropathy
1.2 诊断标准
1.2.1 西医诊断标准 参照2017年中华医学会消化病分会发布的《中国慢性胃炎共识意见》[12]中CNAG和CAG的诊断标准:取4块标本(胃窦距幽门2~3 cm大弯、小弯、前壁和后壁各1块),CNAG内镜下可见黏膜红斑、黏膜出血点或斑块、黏膜粗糙伴或不伴水肿、充血渗出等基本表现。CAG内镜下可见黏膜红白相间,以白相为主,皱襞变平甚至消失,部分黏膜血管显露;可伴有黏膜颗粒或结节状等表现。慢性胃炎患者胃镜病理活检若提示固有腺体有萎缩即可诊断为CAG,若无则为CNAG。胃癌的诊断通过内镜下胃黏膜组织活检病理结果或手术室标本病理结果确定最终诊断。
1.2.2 中医辨证标准 脾胃湿热证和脾气虚证的诊断标准均参照2002年《中药新药临床研究指导原则(试行)》[13]。
脾胃湿热证:主症包括胃脘痛或胀痛,大便黏滞不爽,纳呆食少,舌苔黄腻;次症包括脘痞恶心,口苦而黏,肢体困重,渴而少饮。具备舌苔黄腻并同时具备其余主症2项,或主症1项及次症2项,或次症3项,即可诊断。
脾气虚证:主症包括食少纳呆,体倦乏力,食后腹胀,大便异常(溏、烂、先硬后溏、时溏时硬);次症包括神疲懒言,口淡不渴,腹痛绵绵,恶心呕吐,脘闷,肠鸣,面色萎黄,浮肿,排便无力,舌质淡,舌体胖或有齿印,苔薄白,脉细弱或沉弱。具备主症2项和次症1项,即可诊断。
1.2.3 健康受试者纳入标准 ①内镜下提示仅慢性浅表性胃炎,无活动性炎症;②Hp检测结果阴性;③无呼吸、循环、消化、泌尿、神经系统等疾病,无临床其他不适症状;④由2位主任医师对其体质辨识为平和体质者;⑤所有受试对象均签署试验知情文件。
1.3 Hp相关性胃病纳入标准
①符合CNAG、CAG或GC的病理诊断,且中医证候符合脾胃湿热证或脾气虚证辨证标准;②年龄在18~70岁之间;③Hp感染史,且近1个月未行Hp根除疗法,未使用抗生素、益生菌、铋剂、H2受体拮抗剂和质子泵抑制剂(Proton pump inhibitor,PPI)者;④所有受试对象均签署试验知情文件。
1.4 排除标准
①合并有严重心、脑、肺、肝、肾及神经系统疾病者;②近期有消化道出血病史者;③孕妇、哺乳期妇女。
2 方法
2.1 胃黏膜样本采集
所有Hp相关性胃病受试者及健康受试者均行电子胃镜检查,并于胃窦距幽门口2~3 cm处的大、小弯或前、后壁钳取4块直径约0.2~0.3 cm的胃黏膜组织进行检测,其中1块行病理学组织检测;1块行免疫组化蛋白检测;1块放入装有RNA保存液的冻存管中,随后立即投入液氮瓶并转移至-80 ℃低温冰箱保存以备16S rDNA测序;另留取1块样本备用。胃癌标本则剪取手术切除的肿物组织、距离肿物2~3 cm的组织、远癌组织各4块直径约0.2~0.3 cm胃黏膜组织,处理同前。将-80 ℃低温冰箱保存的样本送至广州华银健康科技有限公司行16S rDNA测序。
2.2 胃黏膜菌群检测
提取胃黏膜样本中的总DNA,利用16S rDNA技术对V3~V4区的DNA序列进行PCR扩增,然后通过Illumina Miseq测序平台进行测序,构建DNA文库,测序获得的原始数据(Raw reads)进行数据过滤和优化后进行下游分析,使用VSEARCH(v2.3.4)软件按照相似度>97%的原则将原始数据进行聚类,得到OTU代表序列。使用RDP classifer(v2.2)软件将OTU代表序列与Silva数据库比对进行物种注释分析[14]。主要采用R软件(v3.5.1)、QIIME(v1.80)软件和mothur(v1.39.5)软件进行菌群生物信息分析,包括α多样性分析和线性判别分析(LDA Effect size分析,LEfSe分析)等。
2.3 胃黏膜NLRP3和IL-1β蛋白表达水平检测
采用二步免疫组织化学标记法检测胃黏膜NLRP3和IL-1β蛋白表达水平,试剂盒购自Servicebio公司,货号分别为:GB11086、GB23303,具体操作步骤按试剂盒说明进行。显微镜(型号:XSP-C204)进行镜检、图像采集分析。根据细胞的染色程度进行评分:细胞不染色计为0分;染色程度为淡黄色、棕黄色、棕褐色分别计为1分、2分、3分。另根据染色细胞占据视野细胞总数的百分比来进行评分,随机选取5个高倍视野(200×)。阳性细胞百分比<1%计0分;1%≤,<25%记1分;25%≤,<50%记2分;50%≤,<75%记3分;75%≤,≤100%记4分。阳性细胞染色程度得分与阳性细胞所占百分比得分的乘积即为免疫组织化学法总分,其中0分为阴性,记(-);1~4分为轻度,记(+);5~8分为中度,记(++);9分及以上为重度,记(+++)。
2.4 统计学方法
3 结果
3.1 胃黏膜菌群α多样性分析
所有样本共计得到5 350 839条序列,平均每个样本45 733条。物种累积曲线图中可见曲线先迅速上升,后趋于平缓,说明样本量已足够满足检测需求,详见图1。

图1 物种累计曲线Fig.1 Species accumulation curves
非参数检验分析胃黏膜菌群α多样性指数,结果提示,与正常对照组比较,脾胃湿热证组菌群多样性指数(Shannon指数和Simpson指数)差异有统计学意义(P<0.01),Chao指数和Ace指数差异无统计学意义(P>0.05),详见表3。与正常对照组比较,脾气虚证组Simpson指数差异有统计学意义(P<0.05),Shannon指数、Chao指数和Ace指数差异无统计学意义(P>0.05),详见表4。

表3 Hp相关性胃病脾胃湿热证胃黏膜菌群的α多样性分析[M(P25,P75)]Table 3 α diversity analysis of gastric mucosa microflora in Hp-related gastropathy with spleen-stomach damp-heat syndrome [M(P25, P75)]

表4 Hp相关性胃病脾气虚证胃黏膜菌群的α多样性分析[M(P25,P75)]Table 4 α diversity analysis of gastric mucosa microflora in Hp-related gastropathy with spleen-qi deficiency syndrome [M(P25, P75)]
3.2 胃黏膜菌群β多样性分析
基于Unweighted UniFrac距离,不考虑序列丰度,只考虑序列数量,采用主坐标分析(Principal coordinates analysis,PCoA)的方法研究各组样品间差异。研究发现3组样本均呈现不同程度的重叠,组间差异不显著,详见图2。
图2 脾胃湿热证组、脾气虚证组和正常对照组胃黏膜菌群的多样性PCoA图Fig.2 PCoA diagram of diversity of gastric mucosa microflora in spleen and stomach damp-heat syndrome group, spleen-qi deficiency syndrome group and normal control group
3.3 胃黏膜菌群结构及组成分析
通过分析各组优势菌门(相对丰度>1%)结果发现:门水平,与正常对照组比较,脾胃湿热证患者胃黏膜的放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)相对丰度显著减少(P<0.05,P<0.01),脾气虚证组患者未见明显优势菌群。属水平,与正常对照组比较,脾胃湿热证组胃黏膜的幽门螺杆菌属(Helicobacter)相对丰度显著增加(P<0.01),奈瑟氏菌属(Neisseria)相对丰度减少(P<0.05),脾气虚证组幽门螺杆菌属相对丰度显著增加(P<0.01),详见图3,表5~6。

图3 脾胃湿热证组、脾气虚证组和正常对照组在门(A)、属(B)水平的物种丰度组成Fig.3 Species abundance at phylum (A) and genus (B) level in spleen and stomach damp-heat syndrome group, spleen-qi deficiency group and normal control group
表5 Hp相关性胃病脾胃湿热证门、属水平差异菌群Table 5 Differential flora in Hp-related gastropathy with spleen and stomach damp-heat syndrome at the phylum and genus level
表6 Hp相关性胃病脾气虚证属水平差异菌群Table 6 Differential flora in Hp-related gastropathy with spleen-qi deficiency syndrome at the genus level
3.4 Hp相关性胃病脾胃湿热证、脾气虚证患者胃黏膜的标志菌群
为进一步探索Hp相关性胃病脾胃湿热证、脾气虚证组的胃黏膜标志菌群,本研究采用LEfSe分析[15],标志菌群需满足阈值P<0.05且LDA score值≥3.0(或≤-3.0)。脾胃湿热证组和正常对照组比较,在属水平,脾胃湿热证组的胃黏膜优势菌群为幽门螺杆菌属(Helicobacter),正常对照组的胃黏膜优势菌群为奈瑟氏菌属(Neisseria),详见图4。脾气虚证组与正常对照组比较,在属水平,脾气虚证组胃黏膜优势菌群为幽门螺杆菌属(Helicobacter),正常对照组无优势菌群,详见图5。
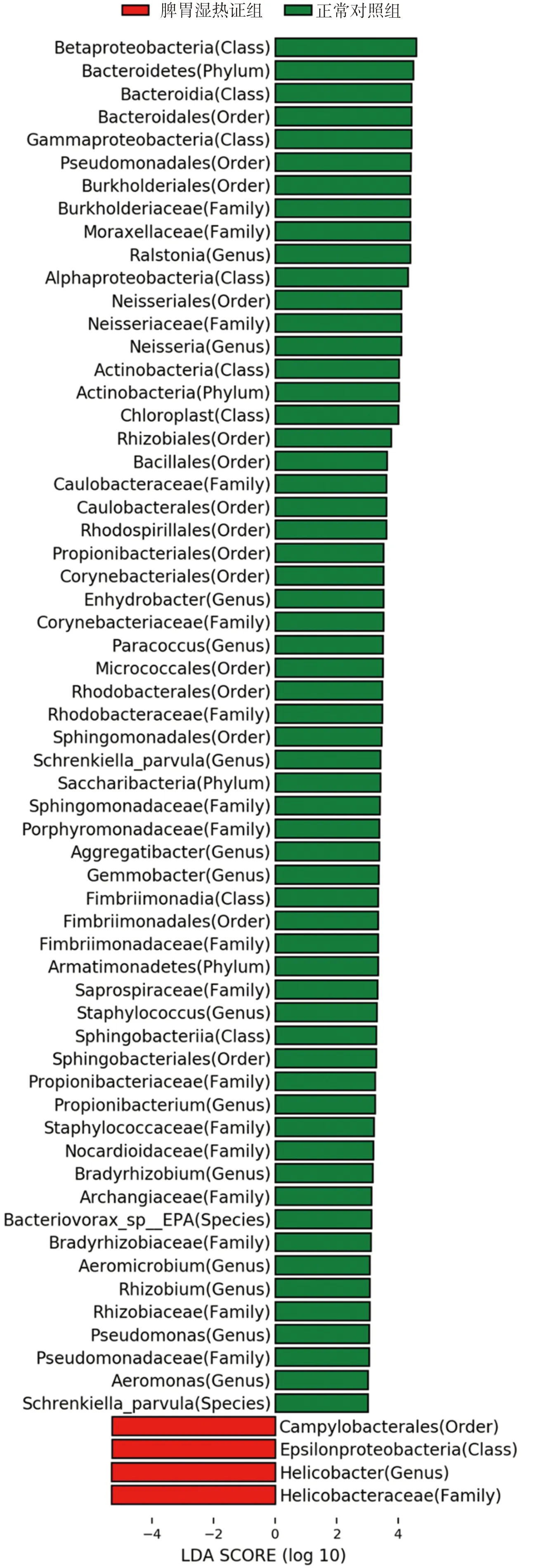
图4 Hp相关性胃病脾胃湿热证优势菌群Fig.4 The dominant flora of Hp-related gastropathy with spleen-stomach damp-heat syndrome
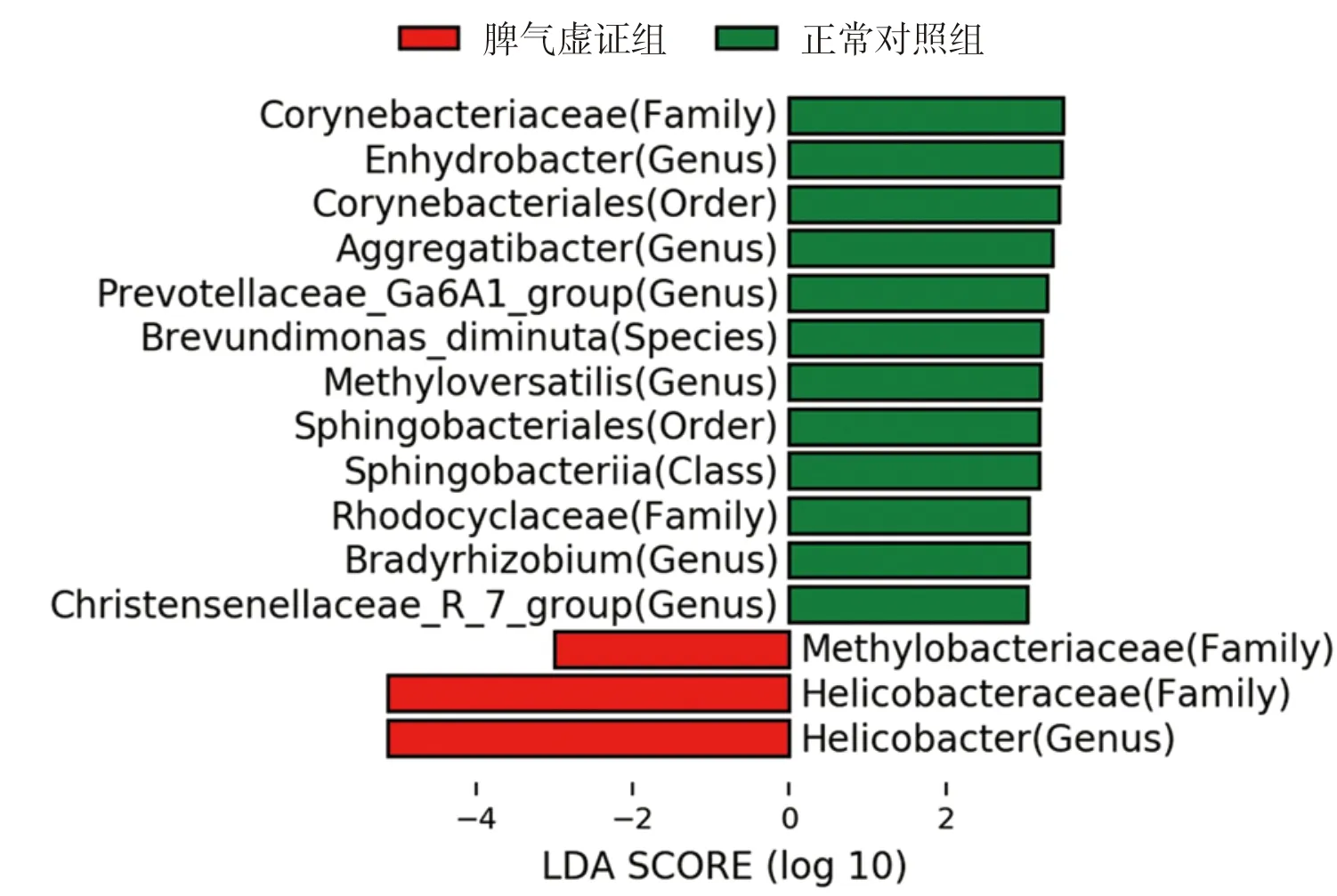
图5 Hp相关性胃病脾气虚证组优势菌群Fig.5 The dominant flora of Hp-related gastropathy with spleen-qi deficiency syndrome
3.5 胃黏膜组织NLRP3、IL-1β蛋白表达水平
与正常对照组比较,脾胃湿热证组、脾气虚证组NLRP3、IL-1β蛋白表达水平均显著增加(P<0.05),详见表7~8、图6~7。
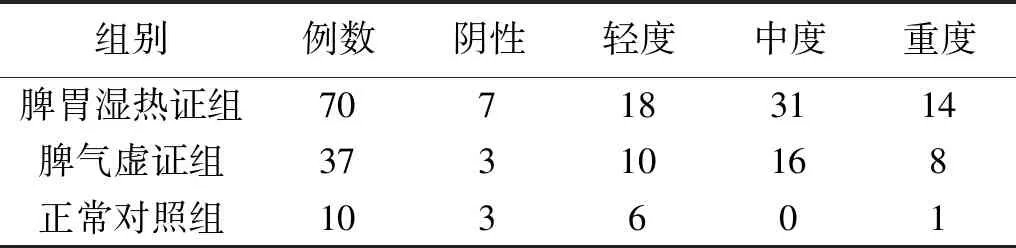
表7 Hp相关性胃病脾胃湿热证、脾气虚证的NLRP3蛋白表达Table 7 NLRP3 protein expression in Hp-related gastropathy with spleen-stomach damp-heat syndrome and spleen-qi deficiency syndrome

表8 Hp相关性胃病脾胃湿热证、脾气虚证的IL-1β蛋白表达Table 8 IL-1β protein expression in Hp-related gastropathy with spleen-stomach damp-heat syndrome and spleen-qi deficiency syndrome
4 讨论
Hp相关性胃病在我国发病率较高,其发病机制主要与Hp感染相关,若迁延不愈,Hp等菌群作为肿瘤微环境的重要因素之一,可通过影响机体免疫状态促进慢性胃炎向胃癌发生发展[16]。

注:A.脾胃湿热证组;B.脾气虚证组;C.正常对照组图6 胃黏膜组织中NLRP3蛋白表达水平(×200)Fig.6 Expression of NLRP3 in gastric mucosa tissue(×200)

注:A.脾胃湿热证组;B.脾气虚证组;C.正常对照组图7 胃黏膜组织中IL-1β蛋白表达水平(×200)Fig.7 Expression of IL-1β in gastric mucosa tissue(×200)
目前中医药对于Hp相关性胃病的临床症状改善甚至逆转取得了显著的疗效。脾胃湿热证、脾气虚证分别是Hp相关胃病实证及虚证的常见证型,然而目前关于Hp相关性胃病的研究多集中于肠道菌群或舌苔菌群特征的研究[10,17-21],不同中医证型的胃内微生态及炎症水平变化的研究较少。因此,本文系统分析了Hp相关性胃病脾胃湿热证、脾气虚证患者胃黏膜的菌群特征及胃黏膜炎症因子的表达,研究发现Hp相关性胃病脾胃湿热证患者幽门螺杆菌属相对丰度显著升高,奈瑟氏菌属相对丰度显著降低,幽门螺杆菌属是脾胃湿热证患者的胃黏膜优势菌属。同时,脾气虚证患者幽门螺杆菌属相对丰度亦显著升高,提示二者均为幽门螺杆菌属的易感证型。与课题组前期研究发现脾胃湿热证和脾气虚证均有较高的Hp感染率结果相一致。
菌群失衡可影响宿主免疫系统功能的正常发挥[9,22],IL-1β等炎症因子作为先天宿主防御介质直接受其影响[23],Fan等[24]发现乳酸杆菌的增加可抑制IL-1β的表达,从而缓解肠道炎症。而炎症作为机体免疫的重要环节,亦可影响胃内微生态的组成和结构,从而破坏胃黏膜菌群的动态平衡[16,25],Ling等发现胃癌肿瘤微环境中的调节性T细胞和浆细胞样树突细胞表达改变与胃微生物群失调相关[26]。本研究发现脾胃湿热证组的胃黏膜菌群多样性低于正常对照组,而NLRP3和IL-1β蛋白表达水平高于正常对照组,提示胃黏膜菌群多样性减少、物种丰度下降等菌群失调现象可能与炎症反应相互作用,影响机体免疫,从而促进了Hp相关性胃病脾胃湿热证的形成。奈瑟氏菌属等为正常对照组的优势菌,齐城成等[27]发现健康薄白苔和病理黄腻苔(湿热证的主要征象之一)中奈瑟氏菌属的丰度存在差异,认为奈瑟氏菌属可能是区别健康薄白苔和病理黄腻苔的菌群之一。
幽门螺杆菌属导致Hp相关性胃病的发病可能与其导致胃黏膜长期处于炎症状态有关。IL-1β作为经典的促炎细胞因子,多项研究表明IL-1β在Hp感染患者胃黏膜的表达高低与Hp感染的相关炎症反应密切相关[28-30]。细胞毒素相关基因A蛋白(Cytotoxin associated gene A protein,CagA)是Hp的主要毒力因子之一,可通过激活NF-κB信号通路,活化NLRP3炎症体,促进IL-1β、IL-18的释放,激活细胞焦亡,进而加重炎症反应[22]。课题组前期发现Hp感染可激活NF-κB信号,促进其下游的相关因子IL-1β的高表达[11],随后对IL-1β基因多态性的研究中发现IL-1β-511 TT基因型在脾胃湿热证中的表达量有所升高,进一步采用二代测序法筛查发现Hp感染患者体内NODs通路被激活,NLRP3炎症体处于高表达状态[11]。本研究结果显示Hp相关性胃病中脾胃湿热证组和脾气虚证组的NLRP3和IL-1β蛋白表达水平均显著高于正常对照组,说明脾胃湿热证、脾气虚证的形成和NLRP3及IL-1β蛋白表达密切相关,但脾胃湿热证的NLRP3和IL-1β感染以中、重度表达为多,而脾气虚证中NLRP3和IL-1β的表达以轻、中度为主。提示NLRP3及IL-1β表达水平的升高可能是“湿热”“脾气虚”的重要致病机制之一。
综上所述,胃黏膜菌群多样性减少、炎症程度升高可能是Hp相关性胃病脾胃湿热证、脾气虚证发病的内在致病机理。脾胃湿热证、脾气虚证和正常对照组的差异优势菌群可能是其菌群标志。本次研究尚未对不同证型之间菌群及相关机制进行比较研究,课题组后续将进一步扩大样本,并纳入Hp相关性胃病不同病种及不同证候,基于炎症与菌群改变进一步深入系统研究。
