甘草素对B16F10细胞中黑色素合成作用研究
2022-07-12吕金鹏姜松周李思淇张锡梅宋国强
吕金鹏, 姜松周, 李思淇, 张锡梅, 杨 莹, 宋国强
(常州大学 药学院, 江苏 常州 213164)
皮肤黑色素在人们正常社会交往和保护人们免受紫外线辐射等方面发挥着重要的作用[1-2]。黑色素产生于黑色素细胞中的黑色素小体,黑色素成熟之后,由黑色素细胞的树突端传递到周围的角质层形成细胞,完成皮肤着色[3-4]。与色素合成有关的3种关键酶分别为酪氨酸酶(TYR)、酪氨酸酶相关蛋白-1(TRP-1)和酪氨酸酶相关蛋白-2(TRP-2)[5-6]。其中TYR是黑色素生成的限速酶,能够催化生成3,4-二羟基苯丙氨酸(DOPA),TRP-1能与磷酸化的酪氨酸酶形成复合体,可对酪氨酸酶的激活起稳定作用,TRP-2作为多巴胺互变异构物,催化多巴胺重排形成5,6-二羟基吲哚-2-羧酸 (DHICA)[7]。在转录水平上小眼畸形转录因子(MITF)通过启动子区的M-box促进TYR的表达[8],促进黑色素细胞的增殖和存活[9]。在黑色素细胞中,丝裂原活化蛋白激酶(MAPK)家族,包括p38,ERK和JNK 3条并行的信号通路,都可以调控MITF的表达,进而影响细胞中黑色素合成[10-11]。
甘草是中国一项宝贵的中药资源,甘草素(Liquiritigenin)是甘草中重要的黄酮类化合物之一[12]。甘草素具有抗癌、抗炎、调节血管病变、改善纤维化等多种药理作用[13],另外其毒副作用较小,已成为当前的研究热点。有研究表明,甘草素可以促进B16F10中黑色素合成,但是作用机制不明确[14]。因此,本实验在B16F10细胞上,探讨甘草素调节黑色素生成的作用及分子机制,有助于阐明甘草素诱导黑色素合成的作用机制,为治疗色素沉着障碍提供新的途径。
1 实验部分
1.1 仪器与试剂
高糖DMEM(11054001)、胰酶(15090046)、胎牛血清(12483020)购自美国 Gibco 公司;WB/IP 裂解液(P0013)、BCA 蛋白定量试剂盒(P0011)、ECL 发光液(P0018FS)、辣根过氧化物酶标记的山羊抗兔 IgG(A0208)和山羊抗鼠 IgG (A0216)购自上海碧云天生物技术有限公司;兔抗 MITF 抗体(ab20663)、兔抗 TYR 抗体(ab180753)、鼠抗 β-actin 抗体(ab179467)购自英国 Abcam 公司;鼠抗 p-ERK抗体(sc-81492)、鼠抗 ERK 抗体(sc-514302)、鼠抗 p-p38抗体(sc-166182)、鼠抗 p38抗体(sc-398546)、鼠抗 p-JNK抗体(sc-6254)、鼠抗 JNK抗体(sc-7345)购自美国Santa Cruz公司;MTT试剂盒(BB-4201)购自上海贝博生物科技有限公司;Masson-Fontana黑色素胺银染色试剂盒(BP-DL371)购自南京森贝伽生物科技有限公司;二氧化碳细胞培养箱购自日本 Sanyo 公司;多功能酶标仪购自美国 BioTek公司;化学发光成像仪购自上海天能科技有限公司。
1.2 细胞培养
B16F10细胞在恒温培养箱中(37 ℃,5% CO2)进行培养,当细胞生长至80%左右时进行传代,传代至3代以后,细胞生长稳定,进行给药实验。将细胞分为对照组、不同剂量甘草素处理组(10,20,40,60,80 μmol/L),给药处理48 h后,进行后续检测。为了进一步探究甘草素影响黑色素合成的具体分子机制,选取40 μmol/L甘草素,处理时间分别为0,5,15,30,60,120 min。
1.3 MTT法测定细胞活力
在B16F10细胞处于对数生长期时,将细胞消化后种于96孔板中,每孔接种200 μL的细胞悬液(含10% 的FBS),接种的细胞浓度为1×105个/mL,然后放入恒温培养箱中(37 ℃,5% CO2),静置培养24 h。观察细胞贴壁后进行给药处理,吸出孔中上层液体,将含有不同浓度甘草素(0,10,20,40,60,80 μmol/L)的DMEM培养基(含2.5% 的FBS)换入96孔板中,每个浓度做4个复孔,每孔加入200 μL,然后继续静置培养48 h。 按照V(DMEM)∶V(MTT)= 10∶1的比例,提前配制DMEM培养基与MTT的混合溶液,避光,然后吸出孔中上层液体,每孔加入110 μL的混合溶液,放入37 ℃的培养箱中,孵育4 h。轻轻吸出上层液体,每孔加入150 μL的DMSO,然后放在摇床振摇10 min。将96孔板放入多功能酶标仪中,570 nm波长测定每孔的吸光度值,并计算细胞相对抑制率[15]。
1.4 NaOH裂解法测定黑色素含量
在B16F10细胞处于对数生长期时,将细胞消化后种于6孔板中,每孔接种2 mL的细胞悬液,接种的细胞浓度为1×105个/mL,然后放入恒温培养箱中(37 ℃,5% CO2),静置培养24 h。观察细胞贴壁后进行给药处理,吸出孔中上层液体,将含有不同浓度待测药物的DMEM培养基(含2.5% 的FBS)换入6孔板中,每孔加入2 mL,继续静置培养48 h。然后取出6孔板,用PBS洗2遍,冰上裂解20 min,刮下细胞,4 ℃离心15 min,吸净上清蛋白,将下层的黑色素沉淀留在离心管中,然后向每个离心管中加入100 μL含10% DMSO 的NaOH 溶液,吹打混匀,然后放入80 ℃的金属浴中,裂解2 h,取出涡旋混匀。将黑色素溶解液加入96孔板中,每孔加入100 μL,每个样品做3个复孔,然后将96孔板放入多功能酶标仪中,设置波长405 nm,测定每孔的吸光度值[16]。
1.5 Masson-Fontana黑色素胺银染色
选择10%甲醛水溶液作为固定液,将细胞提前接种到玻片上给药处理,将做好的细胞爬片放入蒸馏水中,取出爬片加入Fontana 氨银溶液,避光浸染12 h。蒸馏水冲洗5次,入海波溶液处理切片5 min,蒸馏水处理5 min,加入中性红染色液,轻轻复染5 min,蒸馏水冲洗,选取95%乙醇、无水乙醇脱水,最后用中性树胶封固,进行拍照观察[17]。
1.6 Western blot 检测黑色素相关蛋白表达
将给药处理的细胞使用细胞裂解液裂解,收集上层的细胞蛋白,使用BCA测定细胞蛋白浓度,绘制的浓度-吸光度标准曲线来计算样品蛋白的浓度。每组样品取40 μg蛋白进行SDS-PAGE 凝胶电泳,电泳结束后,将蛋白转移至NC膜上,按照双层滤纸-膜-胶-双层滤纸的顺序组装滤纸凝胶纤维素夹层,进行转膜,转膜结束后进行封闭,加入稀释的一抗进行过夜孵育,回收一抗,用TBST清洗5次,孵育二抗,用TBST清洗5次,进行显影。将显影所得的条带通过 Image J 软件进行灰度值分析,计算相对蛋白表达量[18]。本组实验重复3次。
1.7 统计学分析
本研究的数据均使用 GraphPad Prism 软件进行统计处理,并且采用 SPSS对实验结果进行检验,P<0.05 表明数据间的差异具有统计学意义(所有实验结果均来自3次重复实验的数据)。
2 结 果
2.1 甘草素对B16F10细胞活力的影响
通过MTT法检测不同浓度的甘草素(0,10,20,40,60,80 μmol/L)对B16F10细胞是否具有细胞毒性。由图1可见,与空白对照组相比,甘草素的浓度为10, 20,40,60 μmol/L时,细胞活力没有明显受到影响,当甘草素浓度为80 μmol/L时,细胞的活力显著下降,细胞的生长受到抑制。

图1 甘草素对B16F10细胞活力的影响Fig.1 Effects of liquiritigenin on the viability of B16F10 cells
2.2 甘草素对B16F10细胞黑色素合成的影响
为研究甘草素对B16F10细胞黑色素合成的影响,选取对数生长期的B16F10细胞,加入同体积含不同浓度甘草素(0,10,20,40 μmol/L)的DMEM培养基(含2.5% FBS),静置于37 ℃,5% CO2培养箱中再培养48 h,NaOH裂解法测定不同浓度的甘草素(0,10,20,40 μmol/L)对B16F10细胞黑色素合成的影响。由图2可见,给药48 h后,与空白组对照,给药组的黑色素含量提高,说明甘草素对黑色素合成起促进作用,随着给药浓度的增大,影响黑色素合成越显著,呈现剂量依赖性。

图2 NaOH裂解法测定不同浓度甘草素对黑色素合成的影响Fig.2 Effect of different concentrations of liquiritigenin on melanin synthesis by NaOH pyrolysis method
通过Masson-Fontana黑色素胺银染色方法观察B16F10细胞的黑色素合成情况。由图3可见,随着甘草素浓度的增加,B16F10细胞中黑色素变多,与此同时,黑色素细胞树突中的黑色素含量也明显增多。
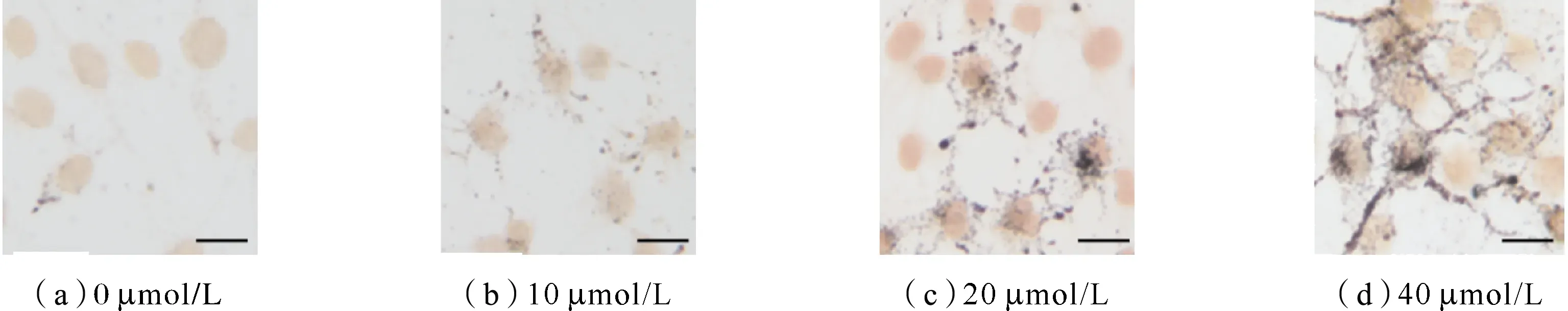
图3 Masson-Fontana胺银染色法测定不同浓度甘草素对黑色素合成的影响Fig.3 Effect of different concentrations of liquiritigenin on the synthesis of melanin by masson-fontana amine silver staining
2.3 甘草素对B16F10细胞中黑色素合成相关蛋白TYR,TRP-1,TRP-2表达的影响
为了研究甘草素促进黑色素合成的具体作用机制,采用免疫印迹法检测甘草素对黑色素合成相关蛋白的影响。由图4可见,不同浓度甘草素(0,10,20,40 μmol/L)处理B16F10细胞,酪氨酸酶(TYR)、酪氨酸酶相关蛋白(TRP-1)表达显著提高,酪氨酸酶相关蛋白(TRP-2)表达没有提高。另外,甘草素也能促进MITF的表达。这些结果表明甘草素是通过上调黑色素合成相关蛋白TYR,TRP-1和MITF的表达,进而促进黑色素合成。


图4 不同浓度甘草素对TYR,TRP-1,TRP-2, MITF蛋白水平的影响Fig.4 Effects of different concentrations of liquiritigenin on TYR, TRP-1, TRP-2 and MITF protein levels
2.4 甘草素对B16F10细胞中MAPK信号通路的影响
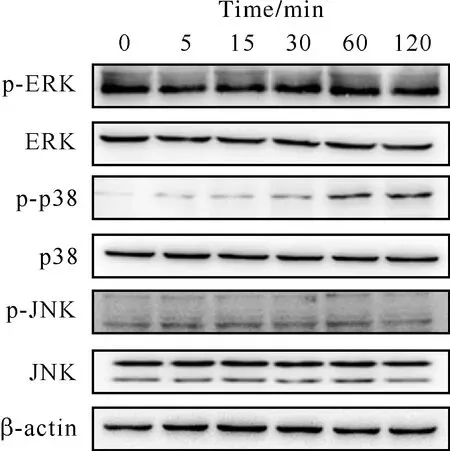
细胞中存在3条并行的MAPK通路,分别为p38,ERK和JNK。上述3条信号通路在调控黑色素合成方面都发挥重要作用。为了进一步阐明甘草素促进黑色素合成的具体分子机制。选取40 μmol/L 甘草素,用不同时间(0,5,15,30,60,120 min)来处理细胞,观察p38,ERK和JNK的激活情况。由图5可见,甘草素可以激活p38通路,但是对ERK和JNK信号通路没有影响。
2.5 p38通路抑制剂对甘草素促进黑色素合成作用的影响
为了进一步证实p38通路对甘草素促进黑色素合成作用的影响,在甘草素给药之前,细胞用10 μmol/L SB203580(p38信号通路抑制剂)预处理1 h,之后加入甘草素处理细胞48 h,检测黑色素含量。由图6(柱1表示空白对照,柱2表示给予SB203580,柱3表示给予甘草素,柱4表示给予SB203580+甘草素)可见,p38信号通路抑制剂SB203580显著抑制了甘草素的促黑色素合成作用。说明甘草素通过激活p38信号通路进而促进黑色素的合成。

图6 甘草素对MAPK通路蛋白活性的影响Fig.6 Effect of liquiritigenin on MAPK pathway protein activity
3 结 论
本实验选取甘草素作为药物,研究甘草素促进黑色素合成的作用及分子机制。研究结果表明:在细胞中加入不同浓度甘草素,细胞中黑色素含量明显增多,并且呈现剂量依赖性。Western-blot结果表明甘草素显著促进黑色素合成关键蛋白TYR的表达,MITF是促进TYR表达的关键转录因子,结果表明甘草素也可以显著促进MITF的表达。MITF的表达与其上游MAPK信号通路激活存在一定关联,细胞中主要存在3条并行的MAPK通路,分别为p38,ERK和JNK。研究表明p38的激活可以上调MITF的表达,ERK的激活则可以促进MITF的降解,JNK通路对MITF的影响依然存在争议[19-20]。对给予甘草素处理之后细胞中的MAPK通路的激活情况进行检测,发现甘草素只激活p38通路,对ERK和JNK通路没有影响。在甘草素给药之前,用SB203580(p38通路抑制剂)预处理细胞1 h,发现可以抑制甘草素的促黑色素合成作用。以上研究结果表明:甘草素通过激活p38信号通路,促进TYR,TRP-1和MITF的表达,进而促进黑色素合成。黑色素对于人体有着不可或缺的重要作用,它不仅可以预防紫外线并且还调节表皮内环境,因此,此发现可能为保护人类免受紫外线引起的皮肤损伤提供一个潜在的候选化合物。
