Piwil2蛋白在乳腺恶性叶状肿瘤组织中的表达及临床预后分析
2022-07-12李双霞孟元华李凤玉张奇芳高灵娟李宏伟田玉旺
李 伟,李双霞,孟元华,李凤玉,张奇芳,高灵娟,李宏伟,田玉旺
乳腺恶性叶状肿瘤被认为源自小叶内或导管周围间质的恶性改变,发生率明显低于乳腺癌,但其是乳腺恶性间叶性肿瘤中最常见的肿瘤。目前,乳腺恶性叶状肿瘤发病具体病因还不明确。有资料[1-2]显示,乳腺恶性叶状肿瘤的发病不仅与种族、年龄和地域等因素有关外,可能还与生育哺乳、内分泌变化及多基因变异等有关。Piwil2蛋白正常表达仅见于胚胎干细胞和生殖干细胞,其他组织均未见表达;但也见于各种肿瘤组织和肿瘤细胞系,其过表达已被认为是肿瘤干细胞的分子标志[3],且与肿瘤的发生、发展紧密相关。已有研究[4]发现,Piwil2蛋白的表达在乳腺癌组织中有高的灵敏度及特异性。目前有关Piwil2蛋白与乳腺恶性叶状肿瘤之间的研究鲜见报道,鉴于此,本实验研究主要探讨Piwil2蛋白在乳腺恶性叶状肿瘤组织中的表达及其与临床病理因素之间的关系,并分析其表达对病人10年生存预后的影响。
1 资料与方法
1.1 资料来源 收集2000年3月至2010年6月期间中国人民解放军陆军第81集团军医院病理科及中国人民解放军总医院第七医学中心病理科存档乳腺恶性叶状肿瘤女性病人资料50例,年龄45~61岁,平均(52±3.5)岁,中位年龄56岁,其中≥56岁者26例、<56岁者24例;肿瘤直径7~15 cm,平均(9±1.2)cm,中位直径10 cm,肿瘤直径≥10 cm者29例、<10 cm者21例;Ki-67≥25%者40例,<25%者10例;瘤细胞异型性显著者38例,不显著者12例;CyclinD1蛋白阳性36例,阴性14例;术后复发10例,未复发40例;核分裂≥15个/10HPF者29例,<15个/10HPF者21例;淋巴结均未发现转移。同时选取因乳腺炎切除的乳腺正常组织70例作为对照组。所有病人均为首次手术治疗,之前均无放化疗史。
1.2 方法 浓缩型鼠抗人单克隆抗体Piwil2购自武汉博士德生物技术有限公司,按1∶200稀释浓度滴加标本。采用罗氏全自动免疫组织化学机及配套试剂进行染色操作,实验操作步骤按说明书要求进行。具体操作步骤如下:石蜡防脱片切片4 μm,组织漂烘仪65 ℃烤片1 h,雀巢全脂牛奶浸泡15 min,放入罗氏全自动免疫组织化学机,99 ℃修复1 h,再将预先配置好的Piwil2 一抗(1∶200) 滴入标本,30 min,加生物素标记过的二抗,9 min,二氨基联苯胺显色 8 min,洗洁精洗片,梯度乙醇脱水,中性树胶封片。奥林巴斯显微镜下观察和分析免疫组织化学染色结果。
1.3 结果判断 Piwil2蛋白表达染色判断标准[5]:每张切片随机观察10个高倍镜视野并依据以下评分,(1)细胞膜和细胞质的染色呈棕黄色或棕褐色,按基本不着色、着色淡、着色适中、着色深分别为0、1、2、3分;(2)染色细胞百分率评分按着色细胞计数≤5%为0分、>5%~25%为1分、>25%~50%为2分、>50%为3分;(3)将上述两项得分相乘为其最后得分,0~1分为阴性(-)、2~3分为弱阳性(+)、≥4分为强阳性(2+)。染色结果判读由2名以上资深病理医生进行双盲评估,其中弱阳性和强阳性按阳性表达统计。
1.4 统计学方法 采用χ2检验和Kaplan-Meier检验。
2 结果
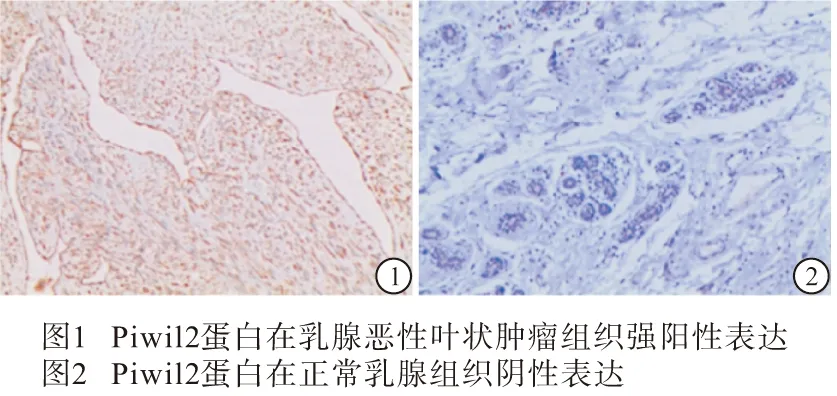
2.1 Piwil2蛋白在乳腺恶性叶状肿瘤组织及正常乳腺组织中的表达 免疫组织化学染色结果显示,Piwil2蛋白着色于细胞膜和细胞质。Piwil2蛋白在50例乳腺恶性叶状肿瘤组织中43例阳性表达,阳性率86.00%;Piwil2蛋白在70例乳腺正常组织中阳性表达0例,阳性率0.00%。2组之间表达差异有统计学意义(χ2=93.82,P<0.01)(见图1、2)。
2.2 Piwil2蛋白的表达与乳腺恶性叶状肿瘤临床病理因素的相关分析 结果显示,肿瘤直径≥10 cm、Ki-67≥25%、瘤细胞异型性、CyclinD1蛋白阳性表达及核分裂≥15个/10HPF病人Piwil2蛋白的表达升高,差异均有统计学意义(P<0.05~P<0.01),而病人不同年龄及术后是否复发Piwil2蛋白的表达差异无统计学意义(P>0.05)(见表1)。
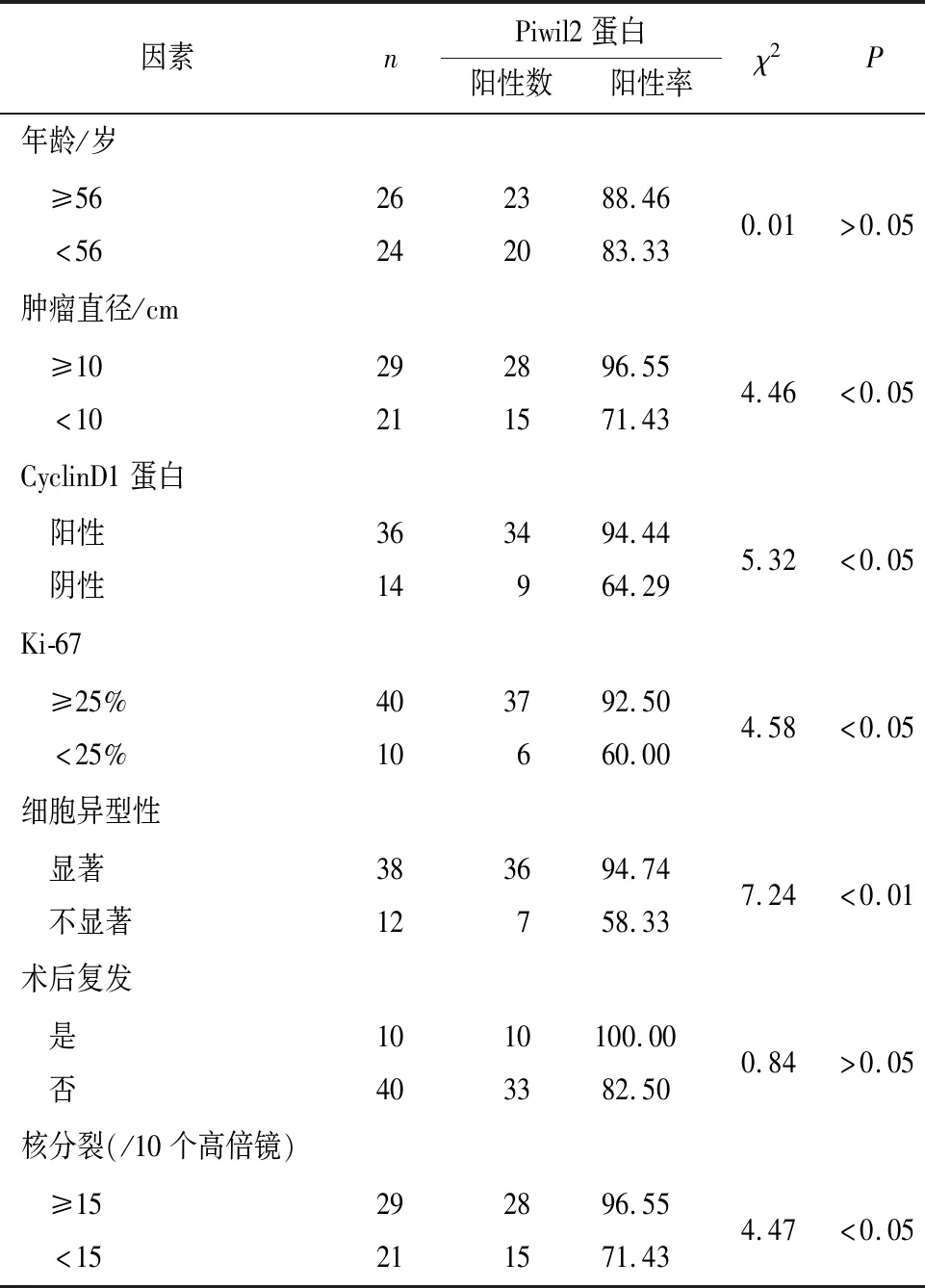
表1 Piwil2蛋白的表达与乳腺恶性叶状肿瘤临床病理因素的相关分析
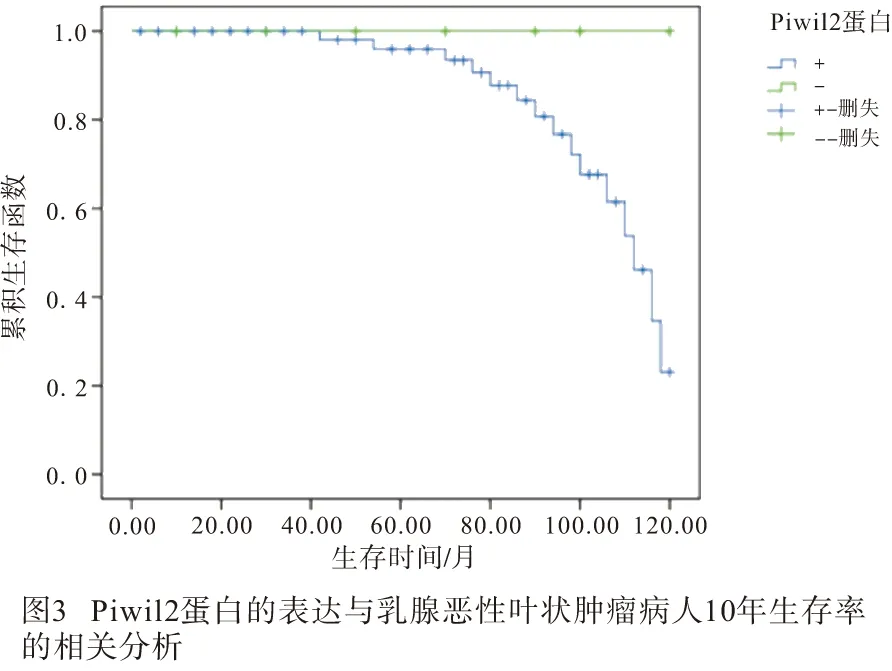
2.3 Piwil2蛋白的表达与乳腺恶性叶状肿瘤病人10年生存率的相关性 随访乳腺恶性叶状肿瘤病人10年,43例Piwil2蛋白阳性表达病人,存活28例,生存率为65.12%;7例Piwil2蛋白阴性表达病人,存活7例,生存率为100.0%;Piwil2蛋白阴性表达病人10年生存率高于Piwil2蛋白阳性表达病人,差异有统计学意义(χ2=3.95,P<0.05)(见图3)。
3 讨论
乳腺纤维上皮性肿瘤是由上皮成分和数量占优势的间质成分构成的一组异源性肿瘤,其主要分为纤维腺瘤和叶状肿瘤。纤维腺瘤最常发生在育龄期妇女,尤其是30岁以下的妇女,也有学者认为其是乳腺正常小叶成分增生而不是真正的肿瘤。叶状肿瘤相比纤维腺瘤少见,占全部乳腺原发性肿瘤的0.3%~1%[6],其好发于中年妇女,发病年龄比纤维腺瘤大15~20岁。叶状肿瘤根据间质细胞增生程度、细胞异性型及核分裂等分为良性、交界性及恶性,尽管恶性叶状肿瘤临床上更少见,但其是乳腺恶性间叶肉瘤中最常见的肿瘤。有人认为叶状肿瘤与乳腺纤维腺瘤明显相关,甚至可能由纤维腺瘤演变而来[7]。部分学者认为乳腺恶性叶状肿瘤来自原始间叶细胞,但也有学者认为是成纤维细胞和肌纤维母细胞。组织病理学通常表现为纤维肉瘤改变,但也可异源性分化,如脂肪肉瘤、骨肉瘤、软骨肉瘤、横纹肌肉瘤等,这提示瘤细胞具有肿瘤干细胞多向分化的潜能。
Piwil蛋白在多种细胞进程中起重要作用,如干细胞自我更新、RNA沉默、精子发生、翻译调节、染色质重塑等。到目前为止,人类Piwil家族中4个成员已被识别,分别为Piwil1、Piwil2、Piwil3、Piwil4[8],其中Piwil2仅表达于正常人体内睾丸和造血干细胞[9]。何朝辉等[5]研究发现,膀胱尿路上皮癌组织中Piwil2蛋白的表达明显高于正常组织,与临床分期相关,并影响膀胱尿路上皮癌的生物学行为,且有可能成为高风险膀胱癌病人的预后指标[10]。但也有研究[11-14]显示,Piwil2蛋白参与了乳腺癌、肝癌、前列腺癌等多种肿瘤的形成、发展,其机制是通过激活内源性RNAi,活化Stat3/Bcl-XL和Sta3/CyclinD1两个重要的细胞信号通路,进而调控细胞周期,抑制细胞凋亡及诱导扩增。
本实验研究结果显示,Piwil2蛋白在正常乳腺组织无表达,在恶性叶状肿瘤组织中表达明显高于纤维腺瘤,因而推测,纤维腺瘤中Piwil2蛋白的表达可能是发展演变成恶性叶状肿瘤的前驱事件。此与FENG等[15]的研究结果相似。本研究进一步发现,乳腺恶性叶状肿瘤Piwil2蛋白的阳性表达与Ki-67≥25%、核分裂≥15个/10HPF明显相关,提示Piwil2蛋白阳性表达的瘤细胞具有更强的分裂、增殖能力,更有利于瘤细胞的生长及侵袭。乳腺恶性叶状肿瘤Piwil2蛋白的阳性表达与CyclinD1蛋白阳性表达之间有统计学意义,这提示Piwil2蛋白的表达与CyclinD1蛋白的表达之间存在相互协调强化作用,进而实现了瘤细胞的增殖。同时,生存分析结果显示,乳腺恶性叶状肿瘤Piwil2蛋白阳性表达病人10年生存率明显低于阴性表达病人。
综上所述,乳腺纤维腺瘤是具有演变为乳腺恶性叶状肿瘤的潜在前驱事件。Piwil2蛋白的表达水平可为临床预测乳腺恶性叶状肿瘤细胞的生物学行为及对病人预后的影响提供有价值的参考。随着分子生物学检测技术的发展,Piwil2蛋白也有可能成为乳腺恶性叶状肿瘤靶向治疗的潜在靶点。
