重度再生障碍性贫血患者外周血IL-2、IL-18、CD34+细胞表达及其预后相关性
2022-07-11高慧何婷婷高玲
高慧,何婷婷,高玲
(1.河南科技大学第一附属医院检验科,河南 洛阳471000;2.洛阳市第五人民医院精神一科,河南 洛阳471000;3.河南省肿瘤医院妇瘤科,河南 郑州450000)
再生障碍性贫血(Aplastic anemia,AA)是一种以骨髓造血干细胞增生能力低下、 外周血全血细胞减少为主的获得性骨髓造血功能衰竭性疾病[1-2]。AA 可分为遗传和获得性两类, 又可分为重型AA(SAA)和非重型AA(NSAA)。 SAA 病情进展迅速,预后凶险,其发病机制尚不明确,有学者认为与细胞免疫异常有关, 细胞免疫异常可引发造血功能衰竭,另外Th1 细胞过度表达时可导致AA 发生[3]。白细胞介素-18(Interleukin-18,IL-18)是T 细胞炎症的诱导因子,可通过刺激Th1 细胞过度表达,导致免疫紊乱[4]。 有研究显示,外周血T 淋巴细胞被异常活化后,可产生抑制造血的细胞因子,如白细胞介素-2(Interleukin-2,IL-2)等[5]。 造血干细胞是各种血细胞和免疫细胞的起始细胞, 具有多向分化和自我复制的能力[6]。 正常情况下,机体内造血干细胞的多向分化能力和自我复制能力是处于动态平衡的,一旦平衡被打破,机体的造血系统将发生严重的疾病[7]。 CD34+抗原是造血干细胞表面的糖蛋白,当机体造血功能出现损坏时,可导致骨髓中CD34+细胞向外周血迁移[8]。 目前有关IL-2、IL-18 和CD34+细胞表达与SAA 患者的预后关系的报道较少, 本研究拟探讨三者对SAA 患者的预后评估价值,旨在为预估患者预后,及时调整治疗方案提供依据。
1 材料与方法
1.1 一般资料 选取2016 年1 月至2018 年1 月本院收治的SAA 患者60 例为研究对象(SAA 组),男32 例, 女28 例, 年龄15~55 岁, 平均年龄(37.85±9.72)岁。 纳入标准:(1)符合《血液病诊断及疗效标准》中SAA 的诊断标准,属于获得性AA[9];(2)入院后经骨髓涂片、骨髓活检等检查确诊;(3)患者/患者家属了解本次研究, 且已签署同意书;(4)随访时间>6 个月。排除标准:(1)患有自身免疫性疾病;(2)患有感染类疾病;(3)合并严重心、肝、肾功能障碍疾病。 选择同期在本院体检的健康者60 例为对照组,男30 例,女30 例,年龄15~60 岁,平均年龄(42.18±11.65)岁。 患者及家属同意签署知情同意书和临床研究协议书, 本研究通过本院伦理委员会批准,符合《世界医学协会赫尔辛基宣言》。
1.2 主要试剂及仪器 IL-2 ELISA 试剂盒(货号:SEA073Bo02)、IL-18 ELISA 试 剂 盒 (货 号:SCA064Hu02), 购自南京赛泓瑞生物科技有限公司;FACSCalibur 流式细胞仪,购自美国BD 公司。
1.3 研究方法
1.3.1 样品采集 对所有研究对象清晨空腹时采取静脉血5~6 mL 装于含乙二胺四乙酸(EDTA)采血管中,平均分成两份,一份4℃,4000 r/min,离心8 min,留上清,冻存于-80℃冰箱中,待测;另一份直接冻存于-80℃冰箱中,待测。
1.3.2 检测血清中IL-2、IL-18 水平 采用酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)法检测血清中IL-2、IL-18 水平, 操作步骤严格依据IL-2 ELISA 试剂盒、IL-18 ELISA 试剂盒进行。IL-2 参考范围为5~15 pg/mL,IL-18 参考范围为5~ 200 ng/L。
1.3.3 CD34+细胞检测 检测所有研究对象外周血中CD34+细胞百分比。取出外周血样品,4000 r/min离心8 min,分离出上层血浆成分,向试管中加入等体积的PBS 稀释试管中成分, 再加入淋巴细胞分离液,继续梯度离心,获取外周血单个核细胞。加入藻红蛋白 (PE) 标记的CD34 单抗20 μL 和PreCP 标记的CD45 单抗10 μL,4℃避光孵育30 min,加入450 μL 溶血素,室温静置30 min,混匀,采用流式细胞仪ProCOUNT 软件检测,获得CD34+细胞百分比,参考范围为0.5%~3.5 %。
1.4 随访 所有SAA 患者均接受随访,本次随访截止日期2020 年6 月。 通过打电话或复诊的方式对所有患者均进行2 年随访。 根据随访情况将SAA患者分为预后良好组50 例和预后不良组10 例。
1.5 统计学分析 采用软件SPSS 25.0 对数据进行分析,计数资料用n(%)表示,采用χ2检验。本研究数据符合正态分布, 计量资料以平均值±标准差(±s)表示,两组间行独立样本t 检验。 采用COX法分析影响SAA 患者不良预后的因素。 P<0.05 为差异有统计学意义。
2 结果
2.1 对照组和SAA 患者IL-2 和IL-18 水平及CD34+表达水平比较 与对照组相比,SAA 组患者IL-2 和IL-18 水 平 较 高,CD34+比 例 较 低 (P<0.05),见表1。
表1 对照组和SAA 患者IL-2 和IL-18水平及CD34+表达水平比较(±s)
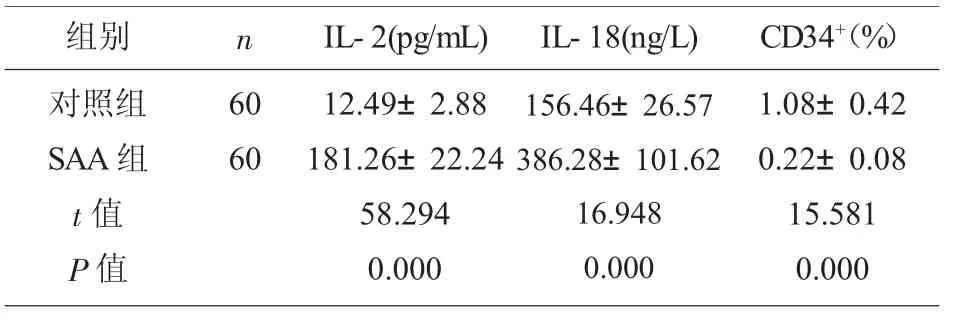
表1 对照组和SAA 患者IL-2 和IL-18水平及CD34+表达水平比较(±s)
组别 n对照组SAA 组t 值P 值60 60 IL-2(pg/mL) IL-18(ng/L)12.49±2.88 181.26±22.24 58.294 0.000 156.46±26.57 386.28±101.62 16.948 0.000 CD34+(%)1.08±0.42 0.22±0.08 15.581 0.000
2.2 预后不良与预后良好SAA 患者一般资料比较SAA 患者预后不良与预后良好组间性别、年龄、体重、病程、中性粒细胞、血小板数、网织红细胞数、骨髓淋巴细胞数比较, 差异无统计学意义 (P>0.05),见表2。
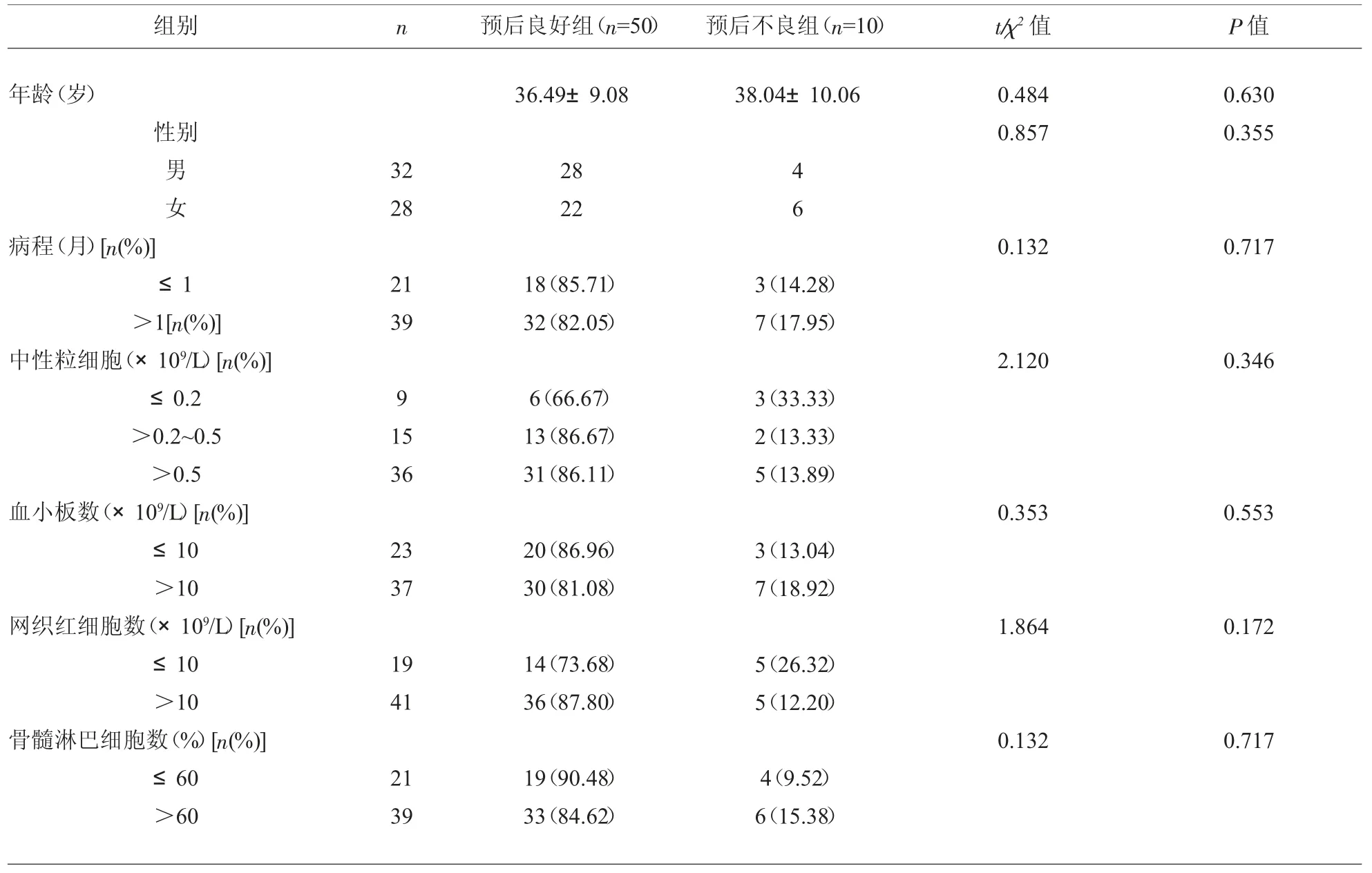
表2 预后不良与预后良好SAA 患者一般资料比较
2.3 预后不良与预后良好SAA 患者IL-2 和IL-18水平及CD34+表达水平比较 与预后良好组相比,预后不良组患者SAA 患者IL-2 和IL-18 水平较高,CD34+比例较低(P<0.05),见表3。
表3 预后不良与预后良好SAA 患者IL-2 和IL-18 水平及CD34+表达水平比较(±s)
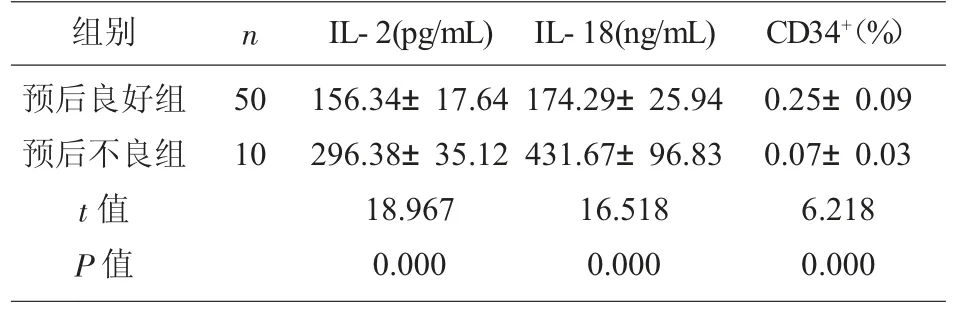
表3 预后不良与预后良好SAA 患者IL-2 和IL-18 水平及CD34+表达水平比较(±s)
组别 n预后良好组预后不良组t 值P 值50 10 IL-2(pg/mL) IL-18(ng/mL)156.34±17.64 296.38±35.12 18.967 0.000 174.29±25.94 431.67±96.83 16.518 0.000 CD34+(%)0.25±0.09 0.07±0.03 6.218 0.000
2.4 影响SAA 患者患者不良预后的COX 分析 单因素COX 分析显示,IL-2、IL-18、CD34+均是影响SAA 患者预后的危险因素; 多因素COX 分析显示,高水平IL-2、高水平IL-18 及低表达CD34+细胞是影响SAA 患者不良预后的危险因素 (HR=2.142,HR=2.086,HR=2.286,P<0.05)。 见表4。
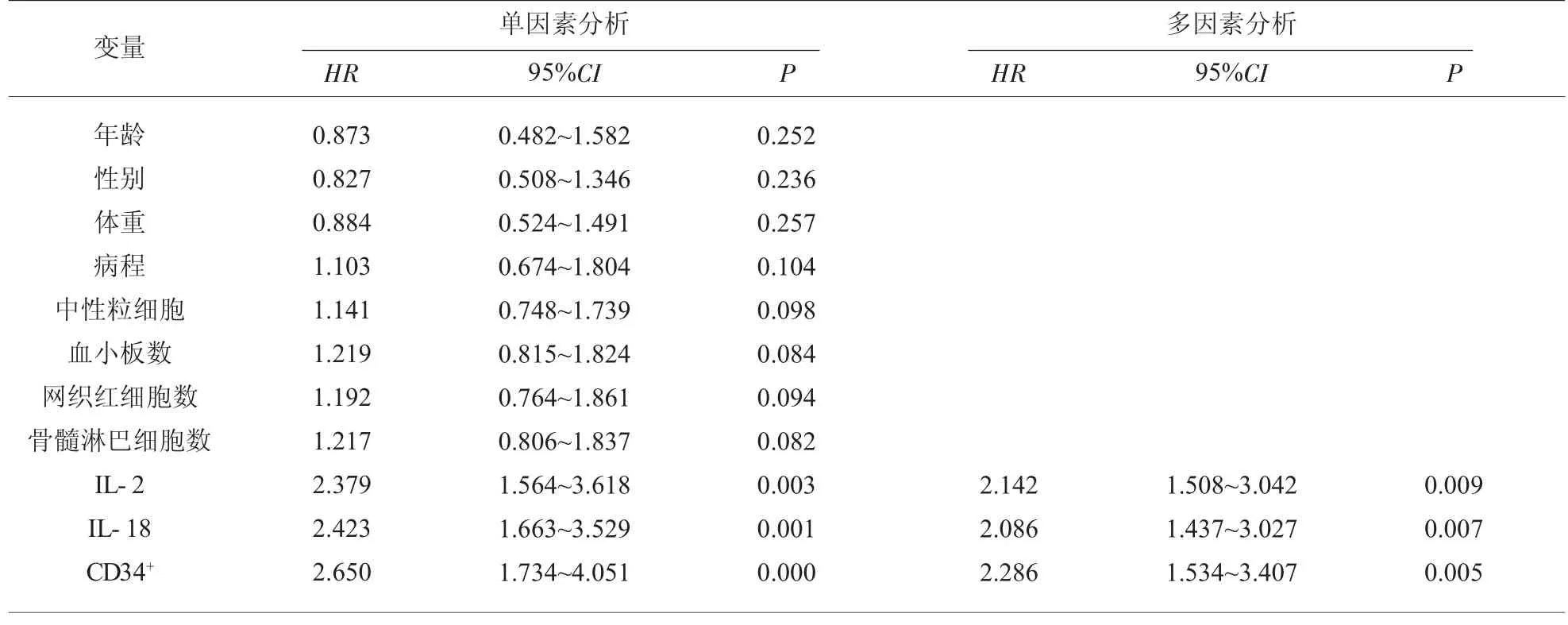
表4 影响SAA 患者不良预后的COX 分析
3 讨论
据流行病学报道,AA 在中国每年的发病率是7.4/10 万,男女发病率几乎相等[10]。 SAA 是难治型血液疾病,可危及患者生命,我国为SAA 高发区[11]。目前SAA 在临床上主要以免疫抑制法治疗为主,虽然治疗效果明显, 但是仍然有大约30%的患者治疗无效或出现疾病复发现象, 而长期给患者使用免疫抑制剂会容易使患者向肿瘤类疾病转化[12]。因此在临床上需要及早预测SAA 患者预后情况,调整治疗方案。
在人体细胞免疫系统中,T 淋巴细胞是主要的效应细胞;在AA 疾病发生、发展过程中,T 淋巴细胞扮演着重要角色[13-14]。 Th1 细胞与Th2 细胞之间表达平衡是机体免疫内环境稳定的重要因素。 卢远强等[15]研究认为骨髓造血功能被抑制主要与Th1 细胞与Th2 细胞之间平衡被打破有关, 随着Th1 细胞过度表达,Th1 细胞分泌的细胞因子 (如IL-2、IFN-γ 等)含量升高,造血功能被抑制。 IL-2细胞抗原活化后产生的一种多效性细胞因子,主要由CD4+和CD8+T 细胞产生,以自分泌或旁分泌的方式参与免疫应答[16]。 有研究发现IL-2 水平异常升高与免疫紊乱相关[17]。 IL-18 主要由巨噬细胞和Kupffer 细胞产生, 是一种多效性细胞因子,可参与调节先天性和获得性免疫反应。 以往研究显示IL-18 具有抗肿瘤作用,其作用机制是通过抑制肿瘤血管生成、 增加肿瘤细胞毒性进而抑制肿瘤细胞生长[18]。 近年来发现IL-18 能作用于Th1 细胞, 已有研究认定在T 细胞和自然杀伤细胞中,IL-18 是IFN-γ 的诱导因子,可诱导IFN-γ 产生,并促进Th1 细胞极化[19]。 IL-18 可通过调节CD8+细胞毒性,导致骨髓造血细胞凋亡[20-21]。 本研究发现SAA 患者血清中IL-2、IL-18 水平显著高于健康体检者,且预后不良组显著高于预后良好组,与Dutta A[22]、夏正萍等[17]研究显示外周血IL-2 在获得性AA 较正常对照者显著升高相一致,提示IL-2、IL-18 可能与SAA 患者发生有关,对SAA 患者预后不良可能也具有一定的影响, 但对于具体作用机制仍需深入研究。
SAA 患者骨髓造血干细胞是T 细胞和Th1 型淋巴因子的靶细胞,骨髓CD34+细胞数减少与骨髓造血细胞数减少有关, 骨髓抑制性细胞因子 (如IFN-γ、TNF-α 等)通过TRAIL 等途径在体外诱导CD34+细胞凋亡[23]。 CD34+抗原是造血干细胞表面的一种糖蛋白,其在造血干细胞中呈特异性表达[24]。国外学者Choudhury 等[25]研究显示,CD34+在多数AA 患者中水平较低。 本研究发现,SAA 患者外周血中CD34+表达水平较健康体检者低,且预后不良组患者低于预后良好组,提示外周血CD34+细胞表达水平与SAA 发生、发展有关,对SAA 预后不良可能具有评估作用。 研究进一步采用COX 分析显示,高水平IL-2、高水平IL-18 及低表达CD34+是影响SAA 患者不良预后的危险因素, 提示监测外周血IL-2、IL-18、CD34+细胞水平对预估SAA 患者预后情况可能具有作用。
综上所述,SAA 患者血清IL-2、IL-18 水平明显升高,CD34+水平降低,高水平IL-2 及IL-18、低CD34+是SAA 不良预后的危险因素。但本研究仅纳入60 例SAA 患者检测分析,可能影响结果的准确性, 因此后期可在大样本量基础, 并延长随访时间, 对IL-2、IL-18、CD34+细胞在疾病中作用机制进行深入分析。
