LncRNA NEAT1 与miR-495-3p 对重症肺部感染的诊断价值及其对T 淋巴细胞凋亡的影响
2022-07-11赵童孟明哲孙栋
赵童,孟明哲,孙栋
(焦作市人民医院重症医学科北区,河南 焦作454000)
重症肺部感染患者的临床症状不具有典型性导致临床无法判断患者肺部感染的严重程度,进而降低治疗效果,影响患者预后。 目前部分血清指标可用于诊断重症肺部感染但诊断准确率较低[1-2]。因而, 探寻重症肺部感染相关的分子标志物有助于提高临床诊断效率。 研究报道指出,T 淋巴细胞在机体免疫功能调节过程中发挥重要作用, 若细胞凋亡率增多可降低机体免疫力并可促进全身炎症反应及感染性疾病的发生[3-4]。 长链非编码RNA NEAT1 (Long non-coding RNA NEAT1,LncRNA NEAT1)在炎症性疾病中呈高表达,并可参与免疫调节过程[5]。 微小RNA-495-3p(microRNA-495-3p,miR-495-3p)在脂多糖诱导的牙周膜细胞中表达下调,并可抑制细胞炎症损伤[6]。 但NEAT1 与miR-495-3p 在重症肺部感染患者中的表达及其临床意义尚未可知。 本研究主要探讨NEAT1 与miR-495-3p 对重症肺部感染的诊断价值及其对T淋巴细胞凋亡的影响, 为提高重症肺部感染的诊断准确率及治疗效果提供参考。
1 资料与方法
1.1 一般资料 收集2016 年5 月至2018 年10 月本院收治的肺部感染患者95 例为研究对象,其中重症感染患者50 例作为重症感染组,非重症感染患者45 例作为非重症感染组,所有患者均符合相关诊断标准[7]。 重症感染组中男30 例,女20 例,年龄60~75 岁,平均年龄(65.32±6.12)岁;非重症感染组中男25 例,女20 例,年龄60~80 岁,平均年龄(68.38±7.21)岁。 选取同期于本院体检的40 例健康志愿者为对照组,其中男20 例,女20 例,年龄60~78 岁,平均年龄(66.36±5.21)岁。 三组患者年龄、性别等一般资料比较差异无统计学意义(P>0.05), 具有可比性。 本研究经本院伦理委员会批准,所有患者知情且签署同意书。
1.2 方法
1.2.1 主要试剂 Trizol 试剂、 反转录与荧光定量PCR 试剂盒购自北京天根生化科技有限公司;Lipofectamine 2000 购自美国Invitrogen 公司;杜氏改良培养基(DMEM)培养基、胎牛血清购自美国Gibco 公司;CD3 试剂盒购自加拿大Stem Cell 公司;NEAT1 小干扰RNA(si-NEAT1)、乱序无意义阴性序列(si-NC)购自广州锐博生物科技有限公司; 膜联蛋白V (Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(Propidium Iodide,PI)细胞凋亡试剂盒购自美国Sigma 公司;RIPA 裂解液、二喹啉甲酸(BCA)蛋白定量检测试剂盒、增强型化学发光试剂(ECL)购自北京全式金生物技术有限公司;兔抗人B 淋巴细胞瘤-2(Bcl-2)、B 淋巴细胞瘤-2 相关蛋白(Bax)抗体购自美国CST 公司;辣根过氧化物酶 (HRP) 标记的IgG 二抗购自美国Abcam 公司。
1.2.2 外周血T 淋巴细胞分离与培养 所有受试者均于入组次日清晨抽取外周静脉血10 mL,其中5 mL 血液样本经3000 r/min 离心15 min,吸取血清置于离心管内,置于-80 ℃超低温冰箱内保存。 另一部分血液样本5 mL 置于EDTA-K2 抗凝试管内保存,进行T 淋巴细胞分离。按照CD3 试剂盒说明书进行操作, 将血血样转移至聚乙烯管内(14 mL), 加入等体积的1×RBC lysisi Buffer, 充分混匀,加入EasySep 阳性选择混合物,充分混匀,室温孵育15 min, 加入磁珠, 充分混匀, 室温孵育10 min, 反复吹打2~3 次, 将试管置于磁极中放置5 min,4 ℃条件下经3000 r/min 离心10 min, 弃上清,远离磁极,加入PBS,反复吹打2~3 次,再次放入磁极中,5 min 后加入PBS 重悬细胞 (即CD3+T淋巴细胞)。
1.2.3 实验分组 T 淋巴细胞培养于含有10%胎牛血清的培养基中,培养条件:37℃、5%CO2、相对湿度95%, 待细胞生长至80%融合度时进行传代培养。 重症感染患者T 淋巴细胞接种于24 孔板,待细胞生长至80%融合度时更换为不含血清的培养基, 分别将si-NC、si-NEAT1 转染至T 淋巴细胞,分别命名为si-NC 组、si-NEAT1 组, 严格按照Lipofectamine2000 说明书进行操作, 转染48 h 后收集细胞。
1.2.4 实时荧光定量聚合酶链反应(Quantitative Real-time PCR,qRT-PCR)检测NEAT1、miR-495-3p 的表达水平 采用Trizol 法提取血清、T 淋巴细胞中的总RNA, 应用Nanodrop2000c 超微量分光光度计测定RNA 浓度。 根据反转录试剂盒说明书操作将总RNA 反转录合成cDNA。 NEAT1 正向引物5’-TCTGTGTGTCAAAGCAAGGC-3’,反向引物5’-AGATGCCACTGAATCACCCA-3’;miR-495-3p正向引物5’-GACGAAACAAACATGGTGCAC-3’,反向引物5’-TACCCACCATTCCCTTCTCC-3’;U6正向引物5’-ATTGGAACGATACAGAGAAGATT-3’,反向引物5’-GGAACGCTTCACGAATTTG-3’;GAPDH 正 向 引 物 5’ -AACGGATTTG GTCGTATTG-3’, 反 向 引 物 5’ -GGAAGATGGTGATGGGATT-3’, 引物均由上海生工生物工程股份有限公司合成。反应条件:95 ℃2 min,95 ℃15 s,60 ℃30 s,72 ℃30 s, 共循环40 次。 置于ABI 7500 实时荧光定量PCR 仪检测NEAT1、miR-495-3p 的 对 表 达 量,NEAT1 以GAPDH 为 内 参,miR-495-3p 以U6 为 内 参, 采 用2-ΔΔCt法 计 算NEAT1、miR-495-3p 的相对表达量。
1.2.5 流式细胞术检测细胞凋亡率 收集各组T 淋巴细胞, 预冷PBS 清洗, 加入500 μL Binding Buffer 悬浮细胞, 依次分别加入5 μL Annexin VFITC 与5 μL PI,充分混匀,室温避光孵育10 min,利用流式细胞仪检测各组细胞凋亡率。
1.2.6 蛋白免疫印迹(Western blot)检测Bcl-2、Bax蛋白表达 收集各组T 淋巴细胞, 加入RIPA 蛋白裂解液, 冰上裂解30 min,4 ℃条件下经12000 r/min 离心10 min,吸取上清液。 采用BCA 法测定蛋白浓度, 严格按照试剂盒说明书进行操作。 取40 μg 蛋白样品与上样缓冲液充分混匀后点样, 采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDSPAGE)分离蛋白,转膜、封闭,加入一抗稀释液(1:1000),4 ℃孵育24 h,TBST 洗涤, 加入二抗稀释液,室温孵育1 h,滴加ECL,暗室内曝光显影,应用ImageJ 软件分析蛋白条带灰度值。
1.3 统计学处理 采用统计学软件SPSS 21.0 进行分析, 符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用两独立样本t 检验,多组间比较采用单因素方差分析及两两比较的LSD-t 检验;计数资料采用检验;采用受试者工作特征(ROC)分析血清NEAT1、miR-495-3p 对重症感染的诊断价值,P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清LncRNA NEAT1 与miR-495-3p 表达量比较 与对照组相比,非重症感染组与重症感染组患者血清NEAT1 的表达水平显著升高 (P<0.05),miR-495-3p 的 表 达 水 平 显 著 降 低 (P <0.05);与非重症感染组相比,重症感染组患者血清NEAT1 的表达水平显著升高(P<0.05),miR-495-3p 的表达水平显著降低(P<0.05),见表1。
表1 各组血清LncRNA NEAT1 与miR-495-3p 表达量比较(±s)
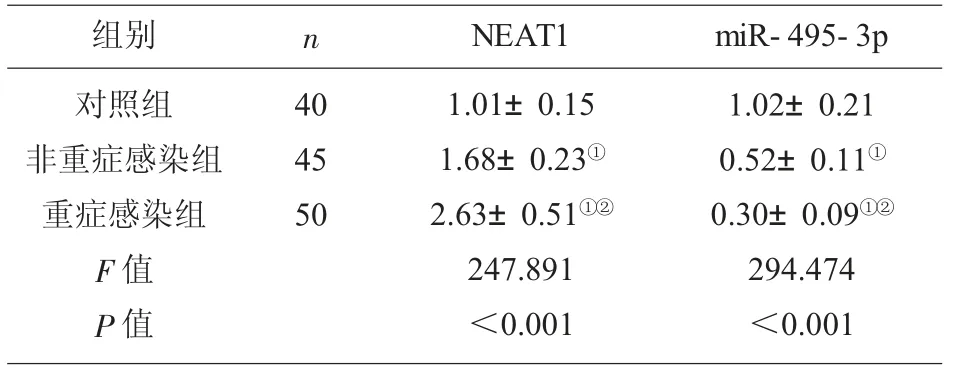
表1 各组血清LncRNA NEAT1 与miR-495-3p 表达量比较(±s)
注:与对照组相比,①P<0.05;与非重症感染组相比,②P<0.05。
组别 n对照组非重症感染组重症感染组F 值P 值40 45 50 NEAT1 miR-495-3p 1.01±0.15 1.68±0.23①2.63±0.51①②247.891<0.001 1.02±0.21 0.52±0.11①0.30±0.09①②294.474<0.001
2.2 血清NEAT1、miR-495-3p 对重症肺部感染的诊断价值 绘制ROC 曲线分析血清NEAT1、miR-495-3p 对重症肺部感染的诊断价值, 结果显示NEAT1 在重症肺部感染诊断时敏感度为82.00%,特 异 度 为84.44%,AUC 面 积 为0.816,95%CI:0.723~0.888,截断值为2.065;miR-495-3p 在重症肺部感染诊断时敏感度为78.00%, 特异度为82.22%,AUC 面 积 为0.820,95%CI:0.727~0.891,截断值为0.413,见图1。
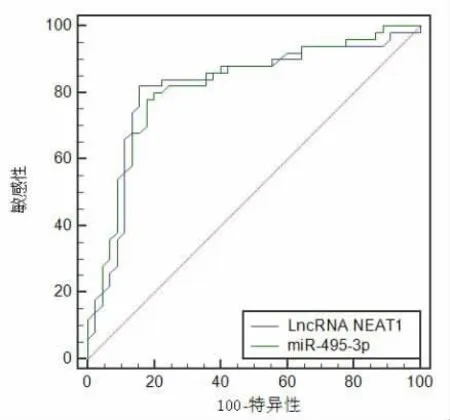
图1 血清NEAT1、miR-495-3p 对重症感染诊断的ROC 分析图
2.3 重症肺部感染患者T 淋巴细胞中NEAT1 与miR-495-3p 表达量比较 与对照组相比, 非重症感染组与重症感染组患者T 淋巴细胞中NEAT1的表达水平显著升高(P<0.05),miR-495-3p 的表达水平显著降低(P<0.05);与非重症感染组相比,重症感染组患者T 淋巴细胞中NEAT1 的表达水平显著升高(P<0.05),miR-495-3p 的表达水平显著降低(P<0.05),见表2。
表2 重症肺部感染患者T 淋巴细胞中NEAT1与miR-495-3p 表达量比较(±s,n=9)

表2 重症肺部感染患者T 淋巴细胞中NEAT1与miR-495-3p 表达量比较(±s,n=9)
注:与对照组相比,①P<0.05;与非重症感染组相比,②P<0.05。
组别 NEAT1对照组非重症感染组重症感染组F 值P 值miR-495-3p 1.00±0.18 0.63±0.11①0.35±0.10①②52.662<0.001 1.02±0.16 1.52±0.29①2.01±0.18①②46.558<0.001
2.4 重症肺部感染患者T 淋巴细胞凋亡的变化与对照组相比,非重症感染组与重症感染组患者T淋巴细胞凋亡率显著升高(P<0.05),Bcl-2 蛋白水平显著降低(P<0.05),Bax 蛋白水平显著升高(P<0.05);与非重症感染组相比,重症感染组患者T 淋巴细胞凋亡率显著升高(P<0.05),Bcl-2 蛋白水平显著降低 (P<0.05),Bax 蛋白水平显著升高 (P<0.05),见图2、表3。
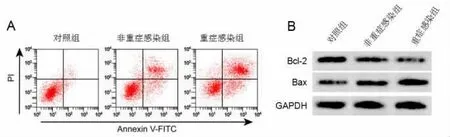
图2 重症肺部感染患者T 淋巴细胞凋亡的变化
表3 重症肺部感染患者T 淋巴细胞凋亡的变化(±s,n=9)
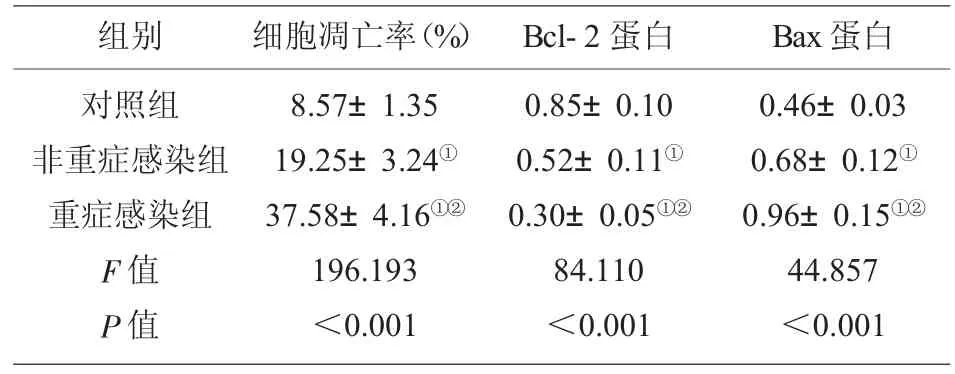
表3 重症肺部感染患者T 淋巴细胞凋亡的变化(±s,n=9)
注:与对照组相比,①P<0.05;与非重症感染组相比,②P<0.05。
组别对照组非重症感染组重症感染组F 值P 值细胞凋亡率(%) Bcl-2 蛋白8.57±1.35 19.25±3.24①37.58±4.16①②196.193<0.001 0.85±0.10 0.52±0.11①0.30±0.05①②84.110<0.001 Bax 蛋白0.46±0.03 0.68±0.12①0.96±0.15①②44.857<0.001
2.5 沉默NEAT1 表达对重症肺部感染患者T 淋巴细胞凋亡的影响 与si-NC 组相比,si-NEAT1 组重症肺部感染患者T 淋巴细胞凋亡率显著降低(P<0.05),Bcl-2 蛋白水平显著升高 (P<0.05),Bax蛋白水平显著降低(P<0.05),miR-495-3p 的表达水平显著升高(P<0.05),见图3、表4。
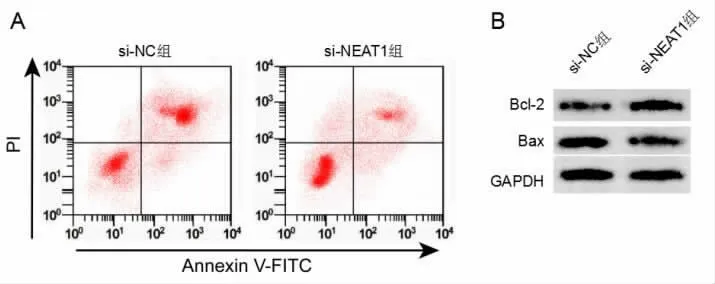
图3 沉默NEAT1 表达对T 淋巴细胞凋亡的影响
表4 沉默NEAT1 表达对T 淋巴细胞凋亡的影响(±s,n=9)

表4 沉默NEAT1 表达对T 淋巴细胞凋亡的影响(±s,n=9)
组别 细胞凋亡率(%)si-NC 组si-NEAT1 组t 值P 值36.57±5.11 16.45±3.21 10.002<0.001 Bcl-2 蛋白 Bax 蛋白0.33±0.08 0.87±0.16 9.056<0.001 0.95±0.17 0.42±0.10 8.062<0.001 miR-495-3p 0.38±0.17 0.95±0.23 5.979<0.001
3 讨论
T 淋巴细胞凋亡与感染性疾病发生过程有关,并可促进自身免疫及感染的发生[8-9]。 目前,关于重症肺部感染与T 淋巴细胞凋亡的相关分子机制尚未阐明。 因此,本研究从分子水平探究重症肺部感染相关基因对T 淋巴细胞凋亡的影响及其分子机制。
NEAT1 在感染的巨噬细胞中表达上调, 并可在结核病免疫反应过程中发挥重要调控作用[10]。研究表明,肺结核患者外周血中NEAT1 表达水平升高,其高表达量与肺结核的发展密切相关[11]。 与上述研究结果相似,本研究结果显示,NEAT1 在重症肺部感染患者血清中表达上调, 其表达量高于对照组与非重症感染组,提示NEAT1 表达量升高可能促进肺部感染的发生及发展。 本研究通过ROC曲线分析NEAT1 对重症肺部感染的诊断价值,发现其灵敏度与特异度均较高,提示NEAT1 可能作为重症肺部感染的有效分子标志物。 研究表明NEAT1 可充当miR-495-3p 的海绵分子, 从而促进心肌缺血-再灌注损伤[12]。但NEAT1 是否可调控miR-495-3p 参与重症肺部感染的发生过程尚未可知。 研究表明,miR-495-3p 表达异常可参与肺纤维化、肿瘤等发生过程[13-14]。 本研究结果显示,miR-495-3p 在重症肺部感染患者血清中表达下调,进一步研究显示miR-495-3p 对重症肺部感染具有一定诊断价值, 可明显区别重症肺部感染与非重症肺部感染,提示miR-495-3p 可能作为重症肺部感染诊断及治疗的潜在靶标基因。
T 细胞凋亡与增殖在维持机体免疫稳态中发挥重要作用,T 淋巴细胞凋亡可促使机体免疫稳态发生改变[15]。本研究为探讨重症肺部感染患者T 淋巴细胞凋亡的原因, 采用磁珠分选方法分离重症肺部感染患者T 淋巴细胞,结果显示,重症肺部感染患者T 淋巴细胞凋亡率明显高于非重症感染患者,Bcl-2 表达量降低,Bax 表达量升高, 说明重症感染环境下T 淋巴细胞凋亡明显增加, 随着病情的加重T 淋巴细胞凋亡率也随之升高。 提示重症肺部感染患者外周血T 淋巴细胞数目减少可能引发免疫抑制。 同时本研究结果还发现,重症肺部感染患者T 淋巴细胞中NEAT1 的表达水平明显升高,miR-495-3p 的表达水平明显降低, 进一步分析显示沉默NEAT1 表达后T 淋巴细胞凋亡率明显降低,Bcl-2 表达量显著升高,Bax 表达量显著降低, 提示重症肺部感染患者可通过降低抗凋亡蛋白Bcl-2 表达及促进凋亡蛋白Bax 表达,从而增加T 淋巴细胞凋亡, 而沉默NEAT1 表达可明显抑制T 淋巴细胞凋亡。
综上所述,NEAT1 在重症肺部感染患者血清中呈高表达,miR-495-3p 表达量降低, 二者对重症肺部感染具有一定诊断价值,体外细胞实验中,沉默NEAT1 表达可能通过上调miR-495-3p 表达从而抑制重症肺部感染患者T 淋巴细胞凋亡,可为临床诊断及治疗重症肺部感染提供理论依据。
