丙基菊粉纳米粒子作为益生元对植物乳杆菌抑菌性能的影响
2022-07-11刘曦宇杜丽欣万入汇张建斌马吉飞胡德宝
刘曦宇 杜丽欣 万入汇 邹 雪 张建斌 蒲 蕾 马吉飞 胡德宝 洪 亮
(天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300392)
抗生素作为一种具有预防、治疗和促生长作用的药物,被广泛应用于畜禽生产中,推进了畜牧业的发展。然而,部分畜牧工作者大量使用、甚至滥用抗生素,导致病原菌耐药性和抗生素残留的问题愈发严重。继欧美国家陆续禁止在饲料中添加抗生素作为促生长类药物之后,我国农业农村部也宣布,自2020年1月1日起,我国饲料中全面禁止添加所有促生长类药物饲料添加剂。在“禁抗”的大环境下,合生元(synbiotics)作为主要的绿色饲料添加剂之一而备受关注。合生元又称合生素,是由益生菌和益生元组合而成的混合制剂。益生菌和益生元的使用往往具有替代抗生素促进动物生长及提高动物机体免疫力的作用[1]。之前已有研究,如由纳豆菌和甘露寡糖[2]、芽孢杆菌和果寡糖[3]组成的合生元,能调控畜禽消化道内微生态环境,提高生长性能。
益生菌是一种对畜禽生长和发育有促进作用的微生物,通常有乳酸菌、芽孢菌和酵母菌三大类,功能主要体现在防控疾病、增加营养、促进黏膜免疫、抵抗应激和促进饲料的消化等方面[4]。植物乳杆菌是乳酸菌的一种,不但能分解饲料中的蛋白质、糖类,并具有合成维生素[5]、促进动物的消化吸收、调节肠道菌群平衡、增强动物免疫力、提高生长性能等诸多功能[6],还有很好的遗传稳定性[7]和热稳定性[8],有非常强的杀菌能力,尤其对革兰氏阳性病原菌有很好的控制能力[9],被认为是最理想的益生菌之一。
益生元是对调节肠道功能和维持肠道微生态平衡有重要作用的因子,可被益生菌利用从而促进益生菌生长,具有增加益生菌菌群数量以及发酵产生挥发性脂肪酸等作用[3]。大多数益生元是基于菊粉的果糖低聚物或低聚半乳糖。菊粉是一种天然果糖聚合物,被认为具有调节消化道微生物区系的作用,是促进有益菌生长和抑制有害菌生长的益生元[10]。菊粉几乎不被胃酸水解和消化,而在结肠中被大量有益微生物发酵生成短链脂肪酸,在动物的免疫调节中发挥着重要作用。据研究,丙酸可作为有效的免疫调节辅助因子,摄入丙酸后,不仅可使调节性T细胞(Treg)的线粒体功能和形态正常化,还能使肠道中T细胞诱导基因的表达增加,使T细胞数量显著增加,而辅助性T细胞1(Th1)和辅助性T细胞17(Th17)数量显著减少[11],此外,丙酸可通过提高紧密连接蛋白的表达提高肠道屏障的功能[12]。
近年来,许多研究人员已经开始合成和应用基于多糖的自组装纳米颗粒的药物传递系统。由疏水核和亲水壳组成的自组装聚合物纳米颗粒,由于其在疏水核内负载药物后能迅速被哺乳动物细胞内吞,现已成为一种很有前途的药物载体[13]。但本试验合成的丙基菊粉纳米粒子(propyl-inulin nanoparticles,IPrN)不是药物或基因载体,而是作为一种新型的益生元剂型探究其作用机理。因此,本试验旨在研究由菊粉和丙酸酐合成的丙基菊粉纳米粒子处理后的植物乳杆菌的抑菌活性,为畜牧业开发一种新型替代抗生素的益生元剂型提供思路。
1 材料与方法
1.1 主要试剂与仪器
菊粉、N,N-二甲基甲酰胺、醋酸钠、荧光染色剂[4’,6-二脒基-2-苯基吲哚(DAPI)、异硫氰酸荧光素(FITC)]购于西格玛奥德里奇(上海)贸易有限公司,MRS肉汤/琼脂、LB肉汤、麦康凯琼脂购于上海玉博生物科技有限公司。主要仪器包括共聚焦激光扫描显微镜(CLSM)(德国奥博科亨卡尔·蔡司股份公司)、电子显微镜(SEM)(德国奥博科亨卡尔·蔡司股份公司)、Avance Ⅱ 600MHz核磁共振波谱仪(AVANCE 600,瑞士布鲁克公司)、动态光散射粒度分析仪(DLS-7000,日本大塚电子公司)。
1.2 合成丙基菊粉(PI)
准确称取1 g菊粉投加到250 mL三口烧瓶中,添加10 mL N,N-二甲基甲酰胺和催化剂醋酸钠,氮气吹入5 min。加热至40 ℃时投入适量丙酐并氮气吹入5 min后反应24 h,在4 ℃环境下将反应产物置于蒸馏水中透析,过滤未反应的丙酐与有机溶剂,将得到的产物进行冷冻干燥。将冷冻干燥产物溶解于N,N-二甲基甲酰胺蒸馏水中进行第二次透析,在4 ℃温度条件下搅拌,过夜。将得到的产物冷冻干燥保存,得到丙基菊粉纳米粒子(图1-A),丙酐与菊粉合成的化学式见图1-B。
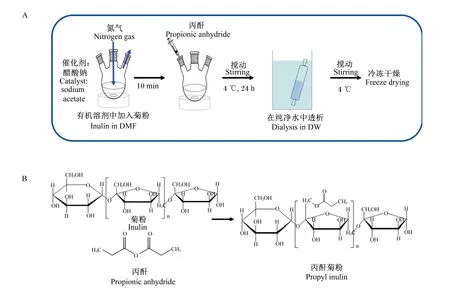
图1 丙基菊粉的合成试验步骤(A)和合成原理(B)
1.3 丙基菊粉物理特性的鉴定
丙基菊粉中丙基的置换率通过600 MHz1H-核磁共振(NMR)光谱确认。使用扫描电子显微镜分析丙基菊粉的表面形貌。用动态光散射(DLS)测量丙基菊粉纳米粒子的尺寸。
1.4 通过CLSM确定纳米粒子的内化
制备FITC标记的丙基菊粉。将5 mg FITC与100 mg丙基菊粉混合溶解在2 mL二甲基亚砜中,室温下在不透明管中搅拌4 h,在4 ℃条件下将产物用蒸馏水透析24 h,将FITC标记的丙基菊粉冻干并保存在20 ℃下备用。
为了观察植物乳杆菌对丙基菊粉的内化,将植物乳杆菌(2.0×106CFU/mL)接种到1 mL MRS肉汤中,用0.5%(w/v)FITC标记的丙基菊粉在37 ℃条件下温育2 h。用磷酸盐缓冲溶液洗涤样品,并通过CLSM分析。为了证实纳米颗粒内化到植物乳杆菌中,在CLSM中通过Z-截面模式观察用FITC标记丙基菊粉处理的植物乳杆菌[8]。
1.5 丙基菊粉纳米粒子对植物乳杆菌生长及产酸的影响
分别分析加入菊粉的植物乳杆菌试验组、加入丙基菊粉的植物乳杆菌试验组和植物乳杆菌对照组,通过测量其生长培养基的pH和指定时间点的乳酸菌活细胞数来检查不同益生元制剂对植物乳杆菌的生长特征及产乳酸的影响[9]。
1.6 通过共培养法和琼脂扩散试验分析植物乳杆菌的抑菌能力
参考了共培养法[10]和琼脂扩散试验[11]测定植物乳杆菌对大肠杆菌K88和鸡沙门氏菌的抑菌活性的方法,本试验中做了一些改动。2.0×106CFU/mL的大肠杆菌K88分别与加入0.5%(w/v)菊粉或丙基菊粉纳米粒子的植物乳杆菌、以及未作处理的植物乳杆菌进行共培养,置于37 ℃震荡培养箱(250 r/min)中振荡8 h。将其共培养的培养液涂布在麦康凯琼脂上,37 ℃下培养24 h,计大肠杆菌K88的菌落数,抑菌活性是由病原菌的存活率决定。植物乳杆菌对鸡沙门氏菌的抑菌活性也通过上述的共培养法来确定。
琼脂扩散试验:将100 μL大肠杆菌K88原液(2.0×108CFU/mL)涂布在LB琼脂上,放置药敏纸片。将使用0.5%(w/v)菊粉或丙基菊粉纳米粒子处理的植物乳杆菌和未处理的植物乳杆菌培养液滴加到药敏纸片上。药敏纸片在室温下干燥后,37 ℃过夜培养。通过抑菌圈的大小判断植物乳杆菌的抑菌能力。用同样的方法评判植物乳杆菌对鸡沙门氏菌生长的抑制作用。用1 mg/mL蛋白酶K处理使用0.5%(w/v)菊粉或丙基菊粉纳米粒子处理的植物乳杆菌和未处理的植物乳杆菌培养液,在37 ℃条件下培养2 h后将每种培养液的上清液在100 ℃条件下加热30 min。再用上述方法进行植物乳杆菌对大肠杆菌K88和鸡沙门氏菌的琼脂扩散试验。
1.7 数据统计与分析
试验数据用Excel 2010软件进行处理后,采用GraphPad Prism软件进行单因素方差分析。P>0.05表示差异不显著,P<0.05表示差异显著。
2 结 果
2.1 丙基菊粉的合成
首先化学合成了丙基菊粉,并对其进行了核磁共振氢谱分析。结果表明,丙基在菊粉的取代率为76.88 mol%(图2-A)。在电镜下成像可观察到球形粒子(图2-B)。进一步通过动态光散射试验测出了其直径为366.6 nm(图2-C)。

图2 通过600 MHz 1H-核磁共振(NMR)光谱(A)、发射扫描电子显微镜(B)、动态光散射(DLS)试验(C)鉴定丙基菊粉的物理特性
2.2 共聚焦内化分析
为了证实植物乳杆菌对丙基菊粉纳米粒子的内化,首先通过不同染色剂对植物乳杆菌和丙基菊粉纳米粒子进行染色,可观察到DAPI荧光和FITC荧光信号重合在一起(图3)。为了进一步探究丙基菊粉纳米粒子是否位于植物乳杆菌表面,在CLSM中通过Z-截面模式可观察到FITC的荧光在植物乳杆菌的中心处最强,结果表明丙基菊粉纳米粒子进入到了植物乳杆菌内(图4)。
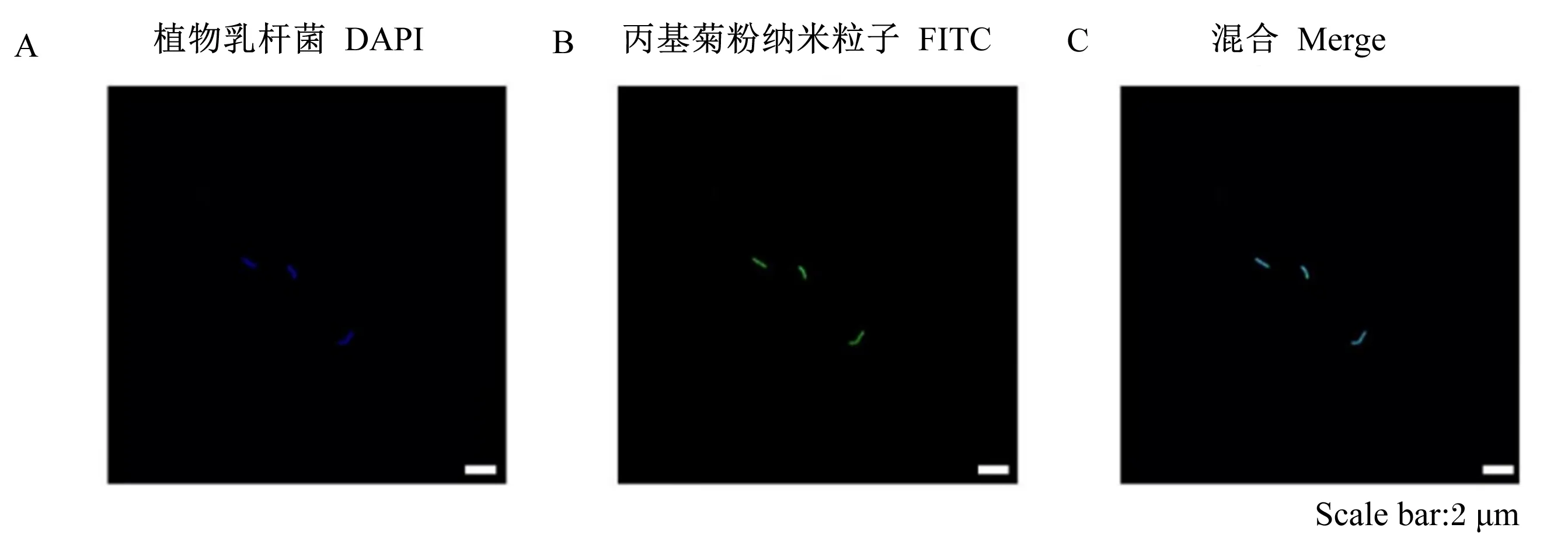
DAPI:4’,6-二脒基-2-苯基吲哚 4’,6-diamidino-2-phenylindole;2,FITC:异硫氰酸荧光素 fluorescein isothiocyanate;Scale bar:比例尺。
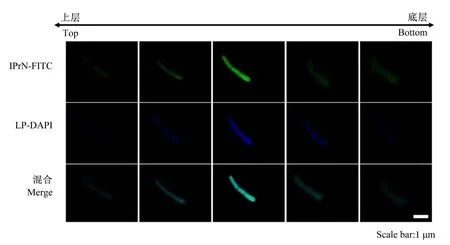
IPrN:丙基菊粉纳米粒子 propyl-inulin nanoparticle;FITC:异硫氰酸荧光素 fluorescein isothiocyanate; LP:植物乳杆菌 Lactobacillus plantarum; DAPI:4’,6-二脒基-2-苯基吲哚 4’,6-diamidino-2-phenylindole;Scale bar:比例尺。
2.3 丙基菊粉纳米粒子对植物乳杆菌的抑菌能力的影响
为了评估丙基菊粉纳米粒子的内化作用对植物乳杆菌的抑菌能力是否有影响,通过检测共培养法中病原体的活细胞数和琼脂扩散试验中抑菌圈大小来分析植物乳杆菌对大肠杆菌K88和鸡沙门氏菌的抑菌能力的影响。由图5可见,通过琼脂扩散试验结果显示,植物乳杆菌、加入菊粉的植物乳杆菌以及加入丙基菊粉的植物乳杆菌均表现出抑菌能力,但菊粉的添加对植物乳杆菌的抑菌能力没有影响,而添加丙基菊粉纳米粒子的植物乳杆菌的抑菌圈相对较大,表明其抑菌能力比植物乳杆菌和加入菊粉的植物乳杆菌有了提升,且对鸡沙门氏菌表现出的抑菌能力有显著提升(P<0.05)。此外,共培养试验进一步评估了其抑菌能力,结果显示,当丙基菊粉纳米粒子处理植物乳杆菌时,病原体的活细胞数目比植物乳杆菌和加入菊粉处理的植物乳杆菌的活细胞数目显著减少(P<0.05),且对于鸡沙门氏菌有显著抑菌能力(P<0.05)。
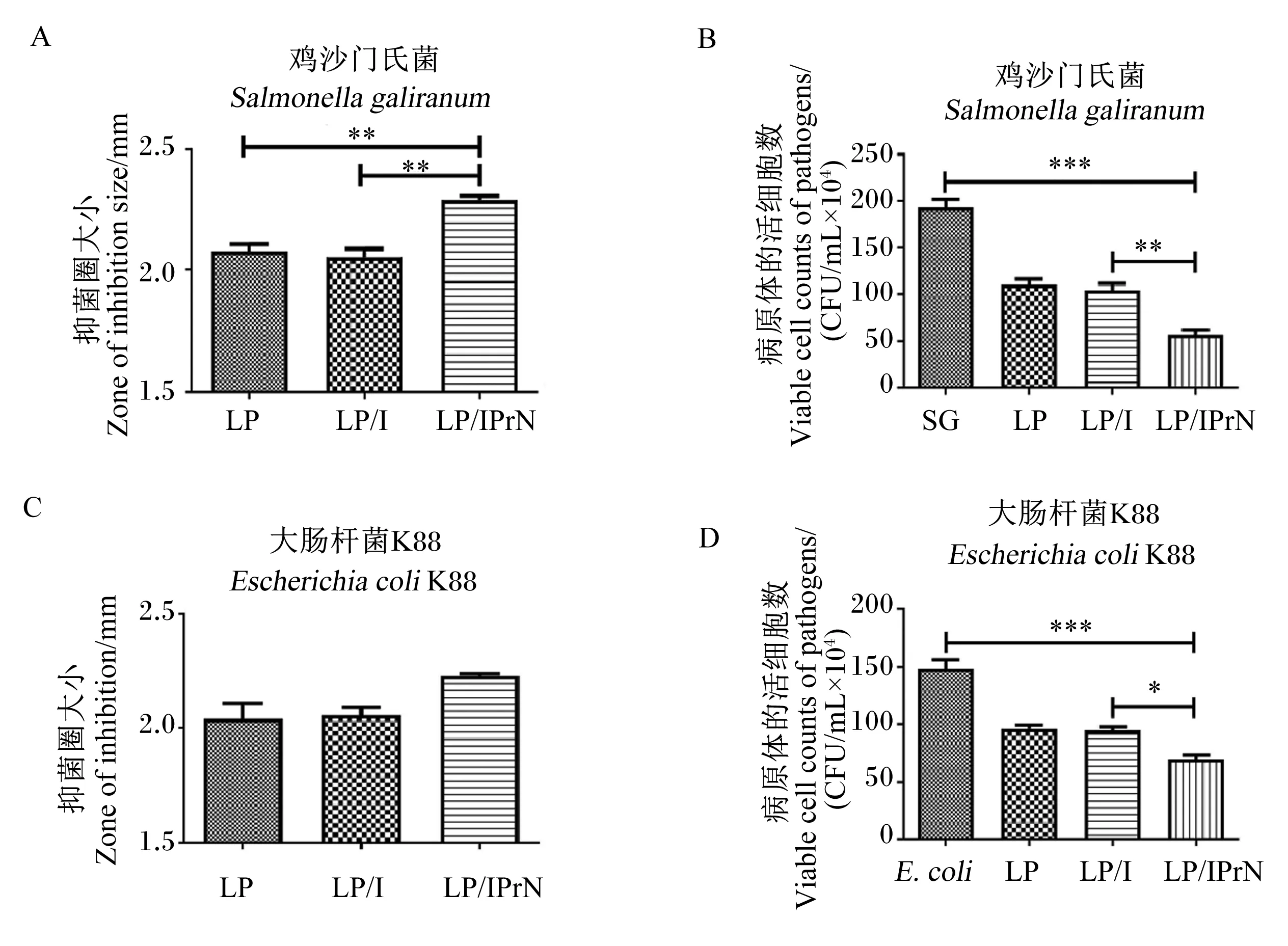
SG:鸡沙门氏菌 Salmonella galiranum;E. coli:大肠杆菌K88 Escherichia coli K88;LP:植物乳杆菌Lactobacillus plantarum;LP/I:植物乳杆菌/菊粉 Lactobacillus plantarum/inulin;LP/IPrN:植物乳杆菌/丙基菊粉纳米粒子 Lactobacillus plantarum/propyl-inulin nanoparticles。
2.4 丙基菊粉纳米粒子对植物乳杆菌的作用机制
通过在不同时间点计数菌落的形成单位来研究丙基菊粉纳米粒子对植物乳杆菌的生长的影响,结果显示(图6-A),添加菊粉或丙基菊粉纳米粒子对植物乳杆菌的生长没有影响。进一步测定了处理后植物乳杆菌培养基的pH以评估菊粉或丙基菊粉的添加对其乳酸产生的影响,结果显示(图6-B),不同处理对植物乳杆菌的乳酸产生没有直接影响。因此,丙基菊粉纳米粒子的内化对植物乳杆菌的生长和产酸没有影响。为了测试植物乳杆菌是否通过分泌细菌素发挥其抑菌能力,先在菊粉、丙基菊粉处理的植物乳杆菌和未处理的植物乳杆菌中加入蛋白酶K,之后进行琼脂扩散试验,可观察到添加蛋白酶K的3组的抑菌能力基本相等,且抑菌能力明显小于未添加蛋白酶K的处理(图6-C、图6-D),结果表明影响抑菌能力的主要物质为细菌素。为了进一步证实细菌素的表达,可知编辑植物乳杆菌细菌素的基因为planS,通过荧光定量PCR法检测到植物乳杆菌在处理丙基菊粉纳米粒子后planS的基因表达水平显著提高(P<0.05),即丙基菊粉纳米粒子的加入可有效提高植物乳杆菌细菌素的表达,planS的基因表达水平清楚地证实丙基菊粉纳米粒子处理的植物乳杆菌的细菌素表达量增多(图6-E)。
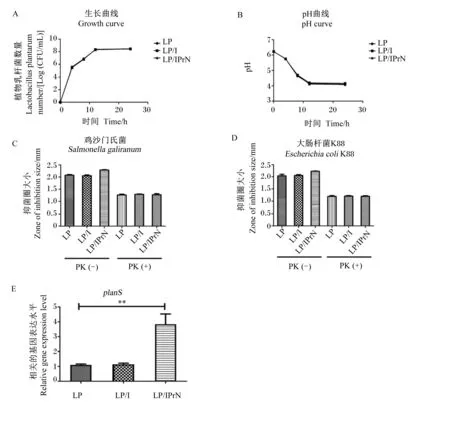
LP:植物乳杆菌 Lactobacillus plantarum;LP/I:植物乳杆菌/菊粉 Lactobacillus plantarum/inulin;LP/IPrN:植物乳杆菌/丙基菊粉纳米粒子 Lactobacillus plantarum/propyl-inulin nanoparticles;PK:蛋白酶K proteinase K。
3 讨 论
世界卫生组织数据表明,抗生素的滥用是病原微生物产生耐药性的主要原因。抗生素耐药性不仅影响家畜健康,也影响人类健康,且在很多国家中已经被禁用[14]。一些研究已经证明益生菌已成为一种潜在的替抗物质,因为它们能够抑制肠道内的细菌定植或通过其分泌的细菌素直接杀死病原体[15]。因此,研究人员已经进行了许多尝试来提高细菌素的产生,其中包括生物和物理方法。以益生菌和益生元组合而成的合生元就是生物方法之一[16]。益生元通常被定义为非消化性化合物,通过选择性的刺激肠胃中1种或几种细菌的生长与活性而对寄主产生有益的影响,从而改善家畜寄主肠道健康。一些益生元也可以被肠道菌群发酵产生以乙酸、丙酸和丁酸为主的短链脂肪酸,在宿主能量代谢和免疫调节等方面发挥重要作用。短链脂肪酸在肠道内参与三羧酸循环和门静脉循环为机体供能,可促进白细胞介素-10(IL-10)等抗炎因子生成,增强肠道免疫机能。此外,短链脂肪酸还可以通过促进5-羟色胺(5-HT)合成进而激活迷走神经来调节胃肠动力[17]。
在本试验研究中,利用丙酸合成了丙基菊粉纳米粒子作为益生元,通过改良益生元的剂型来提高益生菌的抑菌活性。其基于自组装纳米颗粒的形式进行内化,因方法简单,可更广泛的应用于临床。在哺乳动物细胞的研究已经证实了纳米粒子如何进入到细胞中[18],而聚合物纳米粒子可以将治疗药物递送到必要的作用位置[19],并且可以用于在递送疏水性药物时克服细胞屏障[20],然而除了金属纳米粒子外,原核生物如何将益生元纳米颗粒内化的研究仍处于早期。本试验只从共聚焦结果中得出益生元纳米粒子内化作用完成,并未深入研究证明其内化的过程和机制。接下来,我们将进一步探究乙酸化菊粉和丁酸化菊粉是否能形成纳米颗粒,并进一步探索短链脂肪酸化纳米颗粒进入益生菌以及其提高益生菌抑菌能力的机制。探明其作用机理对益生元材料的改良和新型合生元制剂的研发具有重要意义。
本研究的另一个目标是评估益生元对益生菌抑菌特性的影响。试验中选用益生菌的原因在于其能分泌天然的抑菌物质,而益生元是用来提高益生菌的抑菌能力,其主要具有增强益生菌或肠道中其他有益菌的活性或生长速度等功能。
益生菌分泌细菌素属于自身防御机制[21]。丙基菊粉纳米粒子的直径为366.6 nm,当植物乳杆菌对其进行内化时,对于植物乳杆菌来说属于相对庞大的一种入侵物质,使植物乳杆菌在有压强环境中产生对抗性,从而刺激提高细菌素的分泌。此外,细菌产生细菌素的机制是通过调控自身的群体感应机制,因此,我们猜测颗粒化益生元大量存在于植物乳杆菌的周围环境,可能触发了植物乳杆菌的群体感应机制使其分泌出大量的细菌素[22-23]。将来我们要进一步验证未经透析的直链益生元与颗粒化益生元的内吞与否是否会改变植物乳杆菌群体感应机制相关基因的表达。虽然益生元纳米颗粒刺激植物乳杆菌的细菌素分泌,但没有影响其生长和乳酸的分泌。与菊粉单独处理植物乳杆菌相比,用丙基菊粉纳米粒子处理植物乳杆菌增强了其对大肠杆菌K88和鸡沙门氏菌的抑菌活性,且对植物乳杆菌不显示毒性。通过planS的基因表达证实丙基菊粉纳米粒子的内化增加了植物乳杆菌细菌素的产生。
最终,以聚合物纳米颗粒为益生元可以对益生菌产生实质性影响,通过提高益生菌细菌素的表达来增强抑菌能力。
4 结 论
本研究通过植物乳杆菌对丙基菊粉纳米粒子的内化产生的温和应激,提高了细菌素的产量,使其抑菌能力提高。益生元纳米粒子和益生菌作为新型的合生元组合,为抗生素替代剂的研发提供了新思路。
