不同修复材料对设施土壤理化性状及酶活性的影响
2022-07-11贾慧李蕾王永云兴福
贾慧 李蕾 王永 云兴福





摘 要:為研究不同修复材料对设施土壤的修复效果,设置有机肥(T1)、玉米秸秆段(T2)、玉米秸秆段+微生物菌剂(T3)3种不同修复材料和不施加修复物(CK),先在非种植状态下修复30 d,然后定植黄瓜,持续修复至拉秧,测定其对设施土壤理化性状和酶活性的影响。结果表明,不同修复材料对设施土壤理化性状及酶活性均有影响。修复30 d,T1处理的土壤pH和EC值较对照显著降低,土壤有机质、速效氮、有效磷、脲酶、碱性磷酸酶和蛋白酶含量显著增加。修复115 d,T3处理的土壤pH和EC值显著降低,0~10 cm土壤有机质、速效氮和速效钾含量分别较对照增加17.42%、41.13%和46.69%,10~20 cm土壤有机质、速效氮和速效钾含量分别较对照增加35.61%、48.82%和69.16%,显著增加了土壤过氧化氢酶、淀粉酶和蔗糖酶活性。综合各项指标,修复期内,3种材料对设施土壤的修复效果表现为T3>T1>T2。
关键词:黄瓜;有机肥;秸秆;微生物菌剂;土壤理化性状;土壤酶活性
中图分类号:S642.2+S506 文献标志码:A 文章编号:1673-2871(2022)06-041-09
Restoration materials affect soil physical and chemical properties and enzyme activities under protected cultivation
JIA Hui LI Lei WANG Yong YUN Xingfu
(1. College of Horticulture and Plant Protection, Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia, China; 2. Manzhouli Russian Vocational College, Manzhouli 021400, Inner Mongolia, China; 3. Inner Mongolia Academy of Agriculture and Animal Husbandry, Hohhot 010010, Inner Mongolia, China)
Abstract: In order to study the effect of different remediation materials on greenhouse soil, three different remediation materials, namely organic fertilizer (T1), corn stalk segment (T2), corn stalk segment + microbial agent (T3) and no remediation (CK), were set up in this experiment. First, they were remediated for 30 days in the non-planting state, then cucumber was planted in the field, and the effects on physical and chemical characteristic and enzyme activities of greenhouse soil were measured. The results showed that the physical and chemical characteristic and enzyme activities of the soil were affected by different restoration materials. After 30 days of restoration, T1 treatment significantly decreased soil pH and EC values, and significantly increased soil organic matter, available nitrogen, available phosphorus, urease, alkaline phosphatase and protease contents. After 115 days of remediation, T3 treatment significantly reduced soil pH and EC values. Soil organic matter, available nitrogen and available potassium in 0-10 cm increased by 17.42%, 41.13% and 46.69% respectively compared with the control, and soil organic matter, available nitrogen and available potassium in 10-20 cm increased by 35.61%, 48.82% and 69.16% respectively, which was significant. According to the comprehensive indexes, the restoration effect of facility soil was T3 > T1 > T2 during the restoration period.
Key words: Cucumber; Organic fertilizer; Straw; Microbial agent; Soil physical and chemical properties; Soil enzyme activity
设施农业是利用先进技术来装备农业进行农作物高效生产的现代农业生产方式,作为全球最重要的农业生产方式之一,它在很大程度上解决了部分人地矛盾问题,属于劳动密集型产业[1]。设施农业对水、土地及自然资源的高利用率,可以改善我国耕地和水资源匮乏的状况[2]。推动发展设施农业,可以有效调节农业的产业结构、转化农业的发展方式。近年来,我国的设施蔬菜产业发展迅速。有研究表明,我国的设施农业面积位居世界第一,以蔬菜生产为主[3-4],塑料大棚是一种广泛应用于茄果类蔬菜种植的设施农业生产方式。为提高经济效益,设施蔬菜高度集约化种植,施肥量大,复种指数高,常年连作,改变了设施土壤理化性状,导致作物产量和品质下降[5]。
随着农业种植理念的全面更新,设施土壤修复成为近年来人们重点关注的问题[6]。设施土壤修复技术是通过合理配施有机肥、各类植物秸秆及生物菌肥,改良和修复设施土壤,减轻土地污染,优化农产品品质,提高农产品产量[7]。玉米秸秆和禽畜粪便等土壤修复材料价格低廉、易于获取,而且合理施用能有效修复设施土壤理化性状,增加土壤养分,从而提高设施土壤的生产力[8]。
关于用有机肥和作物秸秆修复设施土壤的研究已有报道,但其研究方法均是施加修复物后立即播种或定植[9-11]。而施加修复物先在非种植状态下修复30 d,然后定植作物,持续修复至拉秧,比较其土壤理化性状及酶活性的研究尚未见报道。笔者对比不同修复材料对设施土壤的理化性状和酶活性的影响,筛选出修复效果显著的设施土壤修复材料,以期为有效修复设施土壤提供理论依据。
1 材料与方法
1.1 材料
1.1.1 修复材料 充分腐熟的有机肥(羊粪,内含有机质≥45%,N+PO+KO≥3.8%),购于呼和浩特市赛罕区金河镇;玉米秸秆段[3~5 cm,有机碳≥40%,全氮含量(w,后同)9.51 g·kg,全钾含量17.64 g·kg,全磷含量1.05 g·kg],购于呼和浩特市赛罕区金河镇;微生物菌剂(菁贝,有效活菌数100亿个·g,主要成分为芽孢杆菌群、放线菌群、酵素菌群和木霉菌),购于山东贝佳生物科技有限公司。
1.1.2 植物材料 津优35号黄瓜种子,由天津科润农业股份有限公司培育。在内蒙古农业大学教学科研试验基地的温室内穴盘(32孔)育苗,培育27 d后作为试验用黄瓜秧苗。
1.2 方法
本试验设置有机肥修复(T1)、玉米秸秆段修复(T2)、玉米秸秆段+微生物菌剂修复(T3)和不施加修复物(CK)4个处理,施加修复物深翻修复30 d后定植黄瓜秧苗,4次重复,小区面积为11.25 m,随机区组排列。黄瓜株距40 cm,行距60 cm,小区株数为40株。测定开始修复前到修复115 d(拉秧时)的土壤理化性状和土壤酶活性。
2020年5月31日将充分腐熟的有机肥(羊粪,8 kg·m)、玉米秸秆段(6 kg·m)、玉米秸秆段+微生物菌剂(6 kg·m+6 g·m)平铺在前茬为黄瓜的内蒙古农业大学教学科研试验基地的塑料大棚试验地上,用旋耕机进行旋耕(包括CK),旋耕深度20 cm,各处理等量灌溉(相同管道相同时间灌水);先在非种植状态下修复30 d,于2020年7月1日在试验地上定植育好的黄瓜秧苗,继续修复,直至2020年9月19日拉秧。所有田间管理一致。
修复前取土样测定试验地概况;定植前(非种植状态下修复30 d)到拉秧后(修复115 d)期间每隔30 d对各处理及对照进行土壤取样,采用五点取样法,用土钻取0~10 cm和10~20 cm土层土样,各处理及对照不同土层土样分别充分混合均匀,用自封袋带回实验室,将土样薄薄的平铺于样品盘上,在室内自然风干,避免暴晒,风干后测定土壤的理化性状和酶活性。
1.3 指标测定
1.3.1 土壤理化性状指标 使用雷磁pHS-3C型pH计测定土壤pH,水土体积比为5∶1,振荡60 min之后,取出并立即测量pH值[12]。使用ST300C便携式电导率仪测定土壤EC值,以水土体积比5∶1在土样中加入去离子水,振荡30 min,静置30 min,将上清液过滤后,测定土壤提取液电导率[13]。用烘干法测定[14]土壤含水量,土壤含水量/%=(原土质量-烘干土质量)/烘干土质量×100。采用KCr2O7容量法-外加热法测定土壤有机质含量;采用扩散吸收法测定土壤速效氮含量;采用NH4OAc 浸提-火焰光度法测定土壤速效钾含量;采用NaHCO3 浸提-钼锑抗比色法测定土壤有效磷含量。
1.3.2 土壤酶活性指标 采用紫外分光光度法测定土壤过氧化氢酶活性;采用靛酚蓝比色法测定土壤脲酶活性;采用3,5-二硝基水杨酸比色法测定土壤淀粉酶活性;采用磷酸苯二钠比色法测定土壤碱性磷酸酶活性;采用3,5-二硝基水杨酸比色法测定土壤蔗糖酶活性;采用茚三酮比色法测定土壤蛋白酶活性;土壤葡聚糖酶活性测定参照关松荫[15]《土壤酶及其研究法》。
1.4 数据分析
采用Excel 2017进行数据处理,采用Duncan’s新复极差法进行显著性检验,在WPS 2019软件中绘制图。
2 结果与分析
2.1 不同修复材料对设施土壤理化性状的影响
2.1.1 设施土壤pH的变化 由图1可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤pH值均呈先下降后上升趨势。修复30~115 d,T1和T3处理土壤pH值始终低于对照。修复30 d,T1处理0~10 cm、10~20 cm的土壤pH值均与对照差异显著,分别较对照下降3.03%和1.59%,且低于其他处理。修复115 d,T3处理0~10 cm、10~20 cm的土壤pH值均显著低于对照及其他处理,分别较对照下降1.19%和1.18%,且随着土壤深度增加土壤pH值增大。
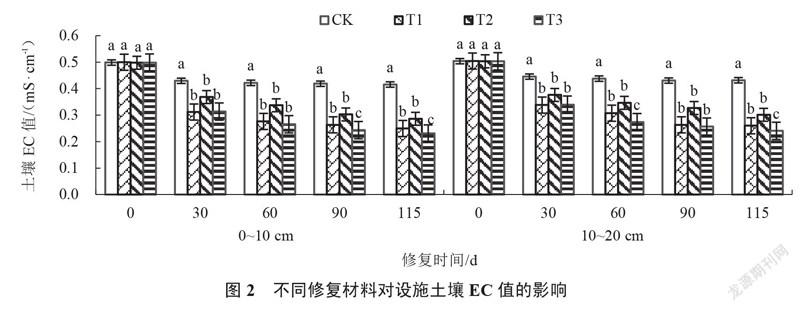
2.1.2 设施土壤EC值的变化 由图2可以看出,修复0~115 d,各处理0~10 cm、10~20 cm土壤EC值呈下降趋势。修复30~115 d,各处理土壤EC值始终显著低于对照。修复30 d,T1处理0~10 cm、10~20 cm土壤EC值最小,分别较对照下降27.47%和24.19%,但与其他处理无显著性差异。修复115 d,T3处理0~10 cm、10~20 cm土壤EC值均显著低于对照及其他处理,分别较对照下降44.52%和44.26%,且随着土壤深度增加土壤EC值增大。
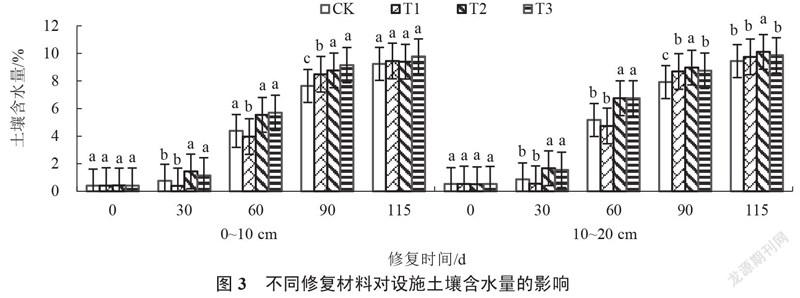
2.1.3 设施土壤含水量的变化 由图3可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤含水量均呈上升趋势,T2和T3处理土壤含水量始终高于对照。修复30 d,T2和T3处理0~10 cm、10~20 cm的土壤含水量均与对照差异显著,其中T2处理最高,分别较对照增加89.47%和94.19%。修复115 d,各处理0~10 cm的土壤含水量与对照均无显著性差异,其中T3处理高于其他处理,较对照增加5.74%;T2处理10~20 cm的土壤含水量显著高于对照及其他处理,较对照增加7.10%。
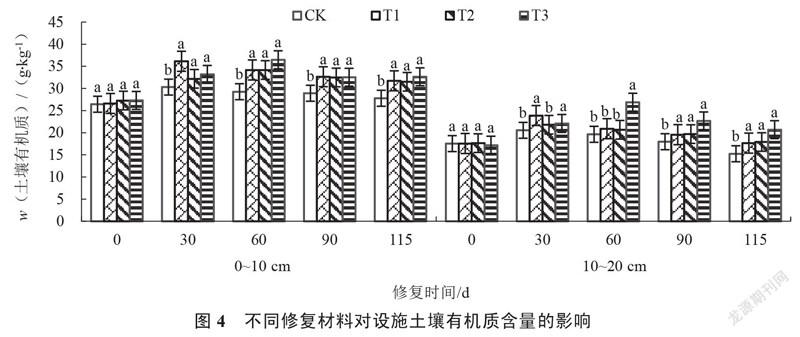
2.1.4 设施土壤有机质含量的变化 由图4可以看出,修复0~115 d,各处理0~10 cm、10~20 cm各处理的土壤有机质含量均呈先上升后下降趋势,各处理土壤有机质含量始终高于对照。修复30 d,T1和T3处理0~10 cm、10~20 cm的土壤有机质含量与对照差异显著,其中T1处理最高,分别较对照增加19.27%和16.26%。修复115 d,各处理0~10 cm、10~20 cm的土壤有机质含量均显著高于对照,其中T3处理最高,分别较对照增加17.42%和35.61%,且随着土壤深度增加土壤有机质含量降低。
2.1.5 设施土壤速效氮含量的变化 由图5可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤速效氮含量均呈先上升后下降趋势。修复30~115 d,各处理土壤速效氮含量始终高于对照。修复30 d,T1处理0~10 cm、10~20 cm的土壤速效氮含量均显著高于对照及其他处理,分别较对照增加25.07%和33.45%。修复115 d,各处理0~10 cm、10~20 cm的土壤速效氮含量均显著高于对照,其中T3处理最高,分别较对照增加41.13%和48.82%,且随着土壤深度增加土壤速效氮含量降低。
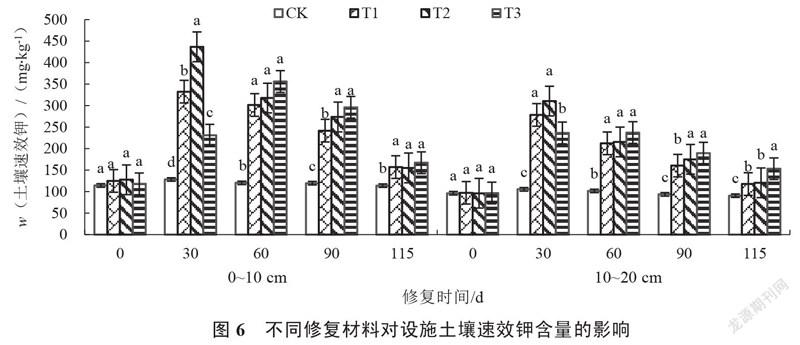
2.1.6 设施土壤速效钾含量的变化 由图6可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤速效钾含量均呈先上升后下降趋势。修复30~115 d,各处理土壤速效钾含量始终显著高于对照。修复30 d,T2处理0~10 cm、10~20 cm的土壤速效钾含量分别较对照增加240.55%和194.81%,且显著高于T3处理。修复115 d,T3处理0~10 cm的土壤速效钾含量最高,较对照增加46.69%;T3处理10~20 cm的土壤速效钾含量显著高于其他处理,较对照增加69.16%,且随着土壤深度增加土壤速效钾含量降低。
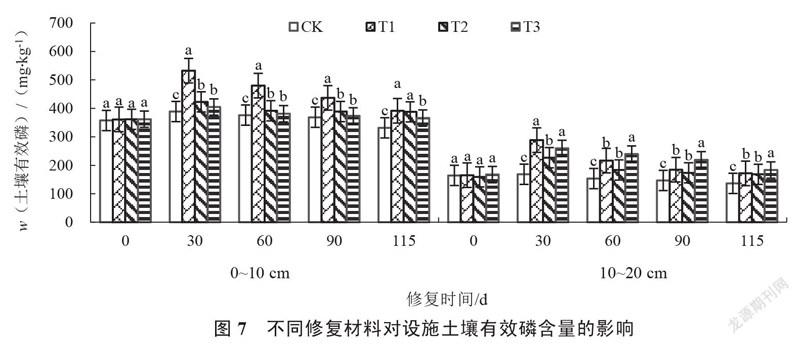
2.1.7 设施土壤有效磷含量的变化 由图7可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤有效磷含量均呈先上升后下降趋势。修复30~115 d,各处理的土壤有效磷含量始终显著高于对照。修复30 d,T1处理0~10 cm、10~20 cm的土壤有效磷含量最高,显著高于T2处理,分别较对照增加36.89%和71.44%。修复115 d,T1处理0~10 cm的土壤有效磷含量较对照增加18.21%,显著高于T3处理;T3处理10~20 cm的土壤有效磷含量显著高于其他处理,较对照增加34.59%,且随着土壤深度增加土壤有效磷含量明显降低。
2.2 不同修复材料对设施土壤酶活性的影响
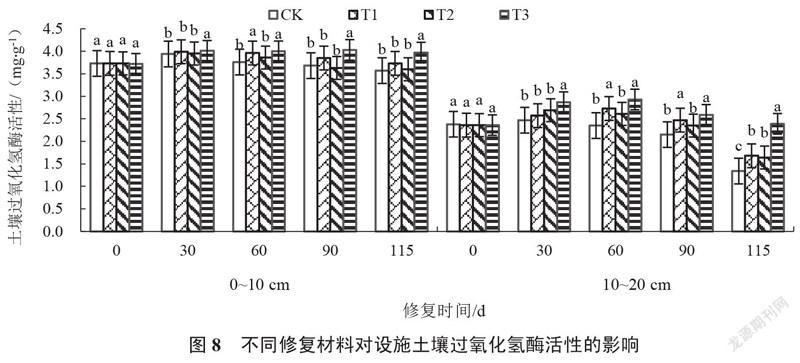
2.2.1 设施土壤过氧化氢酶活性的变化 由图8可以看出,修复0~115 d,各处理0~10 cm、10~20 cm土壤过氧化氢酶活性均呈先上升后下降趋势。修复30~115 d,各处理土壤过氧化氢酶活性始终高于对照。修复30 d,T3处理0~10 cm、10~20 cm的土壤过氧化氢酶活性均显著高于对照及其他处理,分别较对照增加1.78%和16.19%。修复115 d,T3处理0~10 cm、10~20 cm的土壤过氧化氢酶活性均显著高于对照及其他处理,分别较对照增加11.20%和78.36%,且随着土壤深度增加土壤过氧化氢酶活性降低。
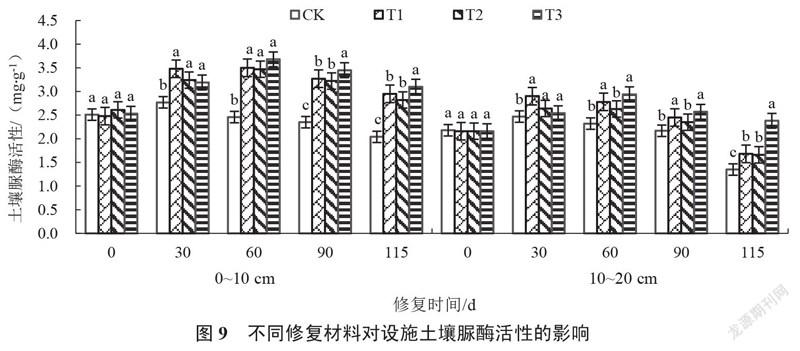
2.2.2 设施土壤脲酶活性的变化 由图9可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤脲酶活性均呈先上升后下降趋势。修复30~115 d,各处理土壤脲酶活性始终高于对照。修复30 d,各处理0~10 cm、10~20 cm土壤脲酶活性均显著高于CK,其中T1处理土壤脲酶活性最高,且与其他处理无显著差异,分别较对照增加25.63%和17.41%。修复115 d,T3处理0~10 cm、10~20 cm的土壤脲酶活性均显著高于对照及其他处理,分别较对照增加51.96%和76.30%,且随着土壤深度增加土壤脲酶活性降低。
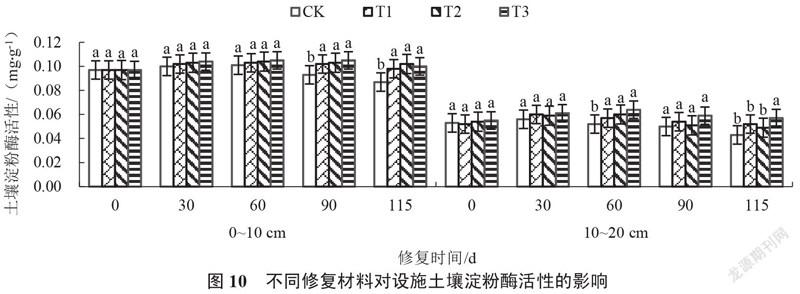
2.2.3 设施土壤淀粉酶活性的变化 由图10可以看出,修复0~115 d,各处理0~10 cm、10~20 cm土壤淀粉酶活性均呈先上升后下降趋势。修复30~115 d,各处理土壤淀粉酶活性始终高于对照。修復30 d,各处理0~10 cm、10~20 cm土壤淀粉酶活性均与对照无显著性差异,其中T3处理最高,分别较对照增加4.00%和8.93%。修复115 d,各处理0~10 cm土壤淀粉酶活性均显著高于对照,其中T2处理最高,较对照增加17.24%;T3处理10~20 cm的土壤淀粉酶活性最高,显著高于对照及其他处理,较对照增加32.56%,且随着土壤深度增加,土壤淀粉酶活性降低。
2.2.4 设施土壤碱性磷酸酶活性的变化 由图11可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤碱性磷酸酶活性均呈先上升后下降趋势。修复30~115 d,各处理土壤碱性磷酸酶活性始终高于对照。修复30 d,T1处理0~10 cm、10~20 cm的土壤碱性磷酸酶活性均最高,分别较对照增加2.06%和8.02%,在10~20 cm与对照差异显著。修复115 d,T3處理0~10 cm的土壤碱性磷酸酶活性最高,与对照差异显著,较对照增加14.73%,与T2处理也差异显著;T1处理10~20 cm的土壤碱性磷酸酶活性与对照差异显著,较对照增加31.2%,高于其他处理但差异不显著。随着土壤深度增加,土壤碱性磷酸酶活性降低。
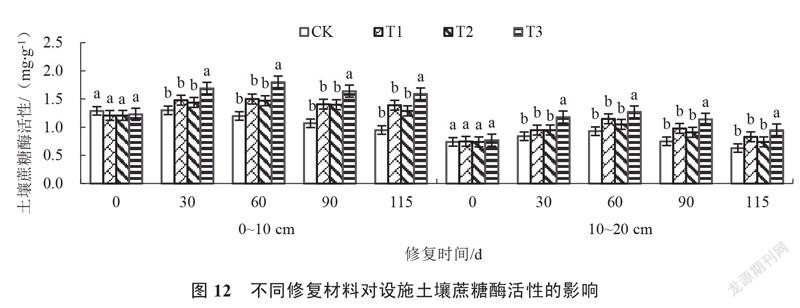
2.2.5 设施土壤蔗糖酶活性的变化 由图12可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤蔗糖酶活性均呈先上升后下降趋势。修复30~115 d,T3处理土壤蔗糖酶活性始终显著高于对照及其他处理。修复30 d,T3处理0~10 cm、10~20 cm的土壤蔗糖酶活性分别较对照增加30.00%和40.48%。修复115 d,T3处理0~10 cm、10~20 cm的土壤蔗糖酶活性分别较对照增加67.37%和50.79%,且随着土壤深度增加,土壤蔗糖酶活性降低。
2.2.6 设施土壤蛋白酶活性的变化 由图13可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤蛋白酶活性均呈先上升后下降趋势。修复30~115 d,各处理土壤蛋白酶活性均显著高于对照。修复30 d,T1处理0~10 cm、10~20 cm的土壤蛋白酶活性最高,显著高于其他处理,分别较对照增加72.46%和55.32%。修复115 d,T3处理0~10 cm的土壤蛋白酶活性高于其他处理但无显著性差异,较对照增加47.73%;T1处理10~20 cm土壤蛋白酶活性较对照增加76.19%,高于其他处理,与T2处理差异显著,且随着土壤深度增加,土壤蛋白酶活性降低。
2.2.7 设施土壤葡聚糖酶活性的变化 由图14可以看出,修复0~115 d,各处理0~10 cm、10~20 cm的土壤葡聚糖酶活性均呈先上升后下降趋势。修复30~115 d,各处理土壤葡聚糖酶活性均显著高于对照。修复30 d,T2处理0~10 cm、10~20 cm的土壤葡聚糖酶活性最高,但与其他处理无显著差异,分别较对照增加10.61%和15.15%。修复115 d,T3处理0~10 cm、10~20 cm的土壤葡聚糖酶活性最高,但与其他处理无显著差异,分别较对照增加82.76%和138.46%,随着土壤深度增加,土壤葡聚糖酶活性降低。
3 讨论与结论
土壤pH、EC值和含水量是影响作物吸收土壤有机质和矿质元素的重要指标,受土壤盐分状况和土壤结构等土壤理化性状的影响[16-18]。逄焕成等[19]在盆栽玉米装盆时施入牛粪、尿素等基肥,配施微生物菌剂或基质,结果表明,施入微生物菌剂明显降低了土壤pH值和EC值。刘杏认等[20]研究表明,将玉米秸秆和氮肥在装盆时施入盆栽油菜中,可以降低土壤EC值。本试验中,修复30~115 d,各处理在0~10 cm、10~20 cm土壤pH和含水量呈上升趋势,土壤EC值呈下降趋势;随深度增加,土壤pH和EC值增加。与CK相比,T3处理在修复后期显著降低了0~10 cm、10~20 cm土壤pH值和EC值,提高了0~10 cm土壤含水量;修复115 d,T3处理在0~10 cm土壤pH值和EC值分别较对照降低了1.19%和44.52%,含水量较对照增加了5.74%,在10~20 cm土壤pH值和EC值分别较对照降低了1.18%和44.26%;T2处理提高了10~20 cm土壤含水量,较对照增加7.10%。修复60~90 d,0~10 cm增加土壤含水量效果为T3>T2>T1。可能是由于施用秸秆配施微生物菌剂可以提高土壤有机质含量,土壤中的碱性物质可以被有机质中的大分子羧基所中和,使土壤胶体吸附阳离子形成腐殖酸盐[21],从而降低土壤pH和EC值。这与前人[22-24]的研究结果相似,施加修复材料可以改善土壤结构,降低pH值,提高土壤含水量。
土壤有机质、速效氮、速效钾和有效磷含量是土壤的主要肥力指标,可以反映出土壤的养分状况,直接影响种植作物的生长发育,对于研究土壤养分有重要意义。赵伟等[25]研究表明,在塑料大棚内种植西瓜时基施有机肥和油渣,显著提高了西瓜整个生育期的土壤养分含量。宋时丽等[26]将水稻秸秆还田后,次年播种小麦时施用基质或复合菌剂,结果表明,基质配施复合菌剂显著提高了土壤有机质含量。李本旭等[27]在播种作物时施用秸秆和秸秆腐熟菌剂,研究表明秸秆配施秸秆腐熟菌剂可以增加土壤肥力。李国等[28]和甄静等[29]研究表明,微生物菌剂会促进土壤养分的释放。本试验中,修复0~115 d,各处理0~10 cm、10~20 cm的土壤有机质、速效氮、速效钾和有效磷含量均呈先上升后下降趋势;随深度增加,土壤有机质、速效氮、速效钾和有效磷含量均降低。各处理在修复后期均显著增加了0~10 cm、10~20 cm土壤有机质、速效氮、速效钾和有效磷含量。修复115 d,T3处理0~10 cm的土壤有机质、速效氮和速效钾含量分别较对照增加了17.42%、41.13%和46.69%,10~20 cm的土壤有机质、速效氮、速效钾和有效磷含量分别较对照增加了35.61%、48.82%、69.16%和34.59%,高于其他处理;T1处理提高了0~10 cm的土壤有效磷含量,较对照增加18.21%,高于其他处理。
土壤酶是组成土壤的成分之一,其活性会直接影响土壤养分状况,和文祥等[30]和Burns等[31]研究表明,土壤有机质、速效氮、速效钾和有效磷的形态和含量均和土壤酶活性密切相关,进而影响种植作物的生长和发育。因此,土壤酶活性常作为评判土壤肥力状况和土壤生物活性的指标[32-33]。弓建泽等[34]研究表明将有机肥在装盆时施入盆栽油菜中可以提高土壤有机质含量和土壤酶活性。袁颖红等[35]研究表明施用生物炭土壤改良剂,次年可以显著提高土壤淀粉酶和蔗糖酶的活性。本试验中,修复0~115 d,各处理在0~10 cm、10~20 cm的土壤酶活性均呈先上升后下降趋势;随深度增加,土壤酶活性均降低。各处理在整个修复期均增加了0~10 cm、10~20 cm土壤酶活性。修復后期,T3处理0~10 cm的土壤过氧化氢酶、脲酶、碱性磷酸酶、蔗糖酶、蛋白酶和葡聚糖酶活性均高于其他处理;10~20 cm的土壤过氧化氢酶、脲酶、淀粉酶、蔗糖酶和葡聚糖酶活性高于其他处理。可能是因为随着修复时间的推移,微生物菌剂对腐熟秸秆起到了促进分解作用,改善土壤的整体生态环境,进而促进土壤酶活性提高。
不同修复材料对设施土壤均有修复效果。修复后期,与对照相比,T3处理较对照显著降低了土壤pH和EC值,显著增加了土壤有机质、速效氮和速效钾含量,显著增加了土壤过氧化氢酶、淀粉酶和蔗糖酶活性。综上所述,T3处理对设施土壤的修复效果最佳。
参考文献
[1] 张震,刘学瑜.我国设施农业发展现状与对策[J].农业经济问题,2015,36(5):64-70.
[2] 唐恒,刘帅,金玉成.国内外设施农业技术研究开发热点与发展趋势:基于专利分析视角[J].中国农业大学学报,2016,21(11):185-194.
[3] 李天来,许勇,张金霞.我国设施蔬菜、西甜瓜和食用菌产业发展的现状及趋势[J].中国蔬菜,2019(11):6-9.
[4] 张真和,马兆红.我国设施蔬菜产业概况与“十三五”发展重点:中国蔬菜协会副会长张真和访谈录[J].中国蔬菜,2017(5):1-5.
[5] 蒋卫杰,邓杰,余宏军.设施园艺发展概况、存在问题与产业发展建议[J].中国农业科学,2015,48(17):3515-3523.
[6] HUANG S W,JIN J Y,BAI Y L,et al.Evaluation of nutrient balance in soil-vegetable system using nutrient permissible surplus or deficit rate[J].Communications in Soil Science and Plant Analysis,2007,38(7/8):959-974.
[7] 吴凤芝,潘凯,刘守伟.设施土壤修复及连作障碍克服技术[J].中国蔬菜,2013(13):39.
[8] 泮琇.温州市设施蔬菜土壤连作障碍治理调控技术研究[D].南京:南京农业大学,2009.
[9] 桑卫民,刘杨,傅留义.土壤修复菌剂在设施番茄上的应用效果[J].中国土壤与肥料,2021(4):267-272.
[10] 郑雪芳,刘波,朱育菁,等.设施番茄连作障碍土壤修复及其对青枯病害的防治效果[J].中国生物防治学报,2018,34(1):117-123.
[11] 钱晓雍,沈根祥,郭春霞,等.不同废弃物对设施菜地次生盐渍化土壤的修复效果[J].农业环境科学学报,2014,33(4):737-743.
[12] 徐辉.砒砂岩区主要树种AMF接种效应和AMF与土壤的相互影响[D].陕西杨凌:西北农林科技大学,2009.
[13] 何雨江,时磊.土壤溶液浓度的野外测定方法研究[J].水土保持通报,2013,33(6):213-215.
[14] 张学礼,胡振琪,初士立.土壤含水量测定方法研究进展[J].土壤通报,2005(1):118-123.
[15] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:260-337.
[16] CHEN Y,HUANG Y,SUN W J.Using organic matter and pH to estimate the bulk density of afforested/reforested soils in northwest and northeast China[J].Pedosphere,2017,27(5):890-900.
[17] 刘广明,杨劲松.土壤含盐量与土壤电导率及水分含量关系的试验研究[J].土壤通报,2001(S1):85-87.
[18] 王舒华,陈爽,王悦,等.不同有机物料对盐碱土的淋洗效果研究[J].水土保持学报,2021,35(6):376-383.
[19] 逄焕成,李玉义,严慧峻,等.微生物菌剂对盐碱土理化和生物性状影响的研究[J].农业环境科学学报,2009,28(5):951-955.
[20] 刘杏认,任建强,刘建玲.有机肥对油菜硝酸盐含量和土壤盐分累积的影响[J].土壤通报,2006,37(5):920-923.
[21] 王庆蒙,景宇鹏,李跃进,等.不同培肥措施对河套灌区盐碱地改良效果[J].中国土壤与肥料,2020(5):124-131.
[22] 尹春艳,赵举,刘虎,等.水煤浆气化渣对毛乌素沙地土壤改良与菊芋生长的促进效应研究[J].土壤通报,2021,52(6):1411-1417.
[23] 韦武思.秸秆改良材料对沙质土壤结构和水分特征的影响[D].重庆:西南大学,2010.
[24] 刘骁蒨.秸秆还田方式与施肥对水稻土壤微生物学特性的影响[D].成都:四川农业大学,2013.
[25] 赵伟,杨圆圆,刘梦龙,等.商品有机肥用量对设施土壤养分及西瓜营养品质的影响[J].中国农学通报,2016,32(31):154-160.
[26] 宋时丽,吴昊,黄鹏伟,等.秸秆还田土壤改良培肥基质和复合菌剂配施对土壤生态的影响[J].生态学报,2021,41(11):4562-4576.
[27] 李本旭,张小峰,金海洋.微生物制剂在秸秆直接还田中的应用试验初报[J].上海农业科技,2019(3):96-97.
[28] 李国,易强,许世武,等.微生物菌剂对新疆棉花连作障碍的消减研究[J].中国土壤与肥料,2020(1):202-207.
[29] 甄静,杜志敏,李冠杰,等.复合菌剂对玉米秸秆的降解及土壤微生物多样性的影响[J].河南农业大学学报,2019,53(5):791-798.
[30] 和文祥,朱铭莪.陕西土壤脲酶活性与土壤肥力关系分析[J].土壤学报,1997(4):392-398.
[31] BURNS R G,DICK R P. Enzymes in the environment:activity,ecology,and applications[M].USA CRC Press,2002:451-452.
[32] 王群,夏江宝,张金池,等.黄河三角洲退化刺槐林地不同改造模式下土壤酶活性及养分特征[J].水土保持学报,2012,26(4):133-137.
[33] 孙慧,张建锋,胡颖,等.土壤过氧化氢酶对不同林分覆盖的响应[J].土壤通报,2016,47(3):605-610.
[34] 弓建泽,张心然,李志勇,等.有机肥施用和外源镉添加对土壤理化性质、油菜生长及其镉积累的影响[J].土壤通报,2021,52(3):679-685.
[35] 袁颖红,张文锋,周际海,等.改良剂对旱地红壤活性有机碳及土壤酶活性的影响[J].土壤,2017,49(5):909-918.
