基于合成路线分析的盐酸阿托莫西汀有关物质研究进展
2022-07-09李树英倪志伟张庆卢大峰臧淑超王玉玲翟光喜
李树英,倪志伟,张庆,卢大峰,臧淑超,王玉玲,翟光喜
(1.山东大学药学院,山东 济南 250012;2.青岛双鲸药业股份有限公司,山东 青岛 266000)
盐酸阿托莫西汀,化学名为(R)-N-甲基-3-(2-甲基苯氧基)-3-苯丙基胺盐酸盐,结构式如图1所示,为一种选择性去甲肾上腺素摄取抑制剂,是由Eli Lilly公司研制开发的新一代治疗儿童注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)的非中枢神经兴奋剂[2-3],可以用于治疗所有年龄段的ADHD患者[1]。本品已于2002年7月获美国食品药品监督管理局(FDA)批准,于2003年1月在美国上市,已上市的剂型包括胶囊剂以及口服溶液剂两种,是FDA许可用于治疗ADHD的第一个非中枢神经兴奋剂,为提高其用药顺应性,有文献先后对盐酸托莫西汀口服溶液[4-5]、盐酸托莫西汀片速溶片[6]、口崩片[7]、口腔速溶膜剂[8]进行了系统研究。
杂质控制是药品安全性得到有效控制的关键手段,而基于合成路线分析是杂质控制的重要策略,可以通过对药品中的每一个杂质,从源头追溯,可以较为全面地依据其生理活性制定相应的限度要求,以便加深对药品各杂质产生原因的理解,为工艺优化、处方开发、包装形式、存储运输等提供重要的技术支持[9-10]。药品的杂质可能来源于起始物料、试剂、配位体、催化剂、中间体以及副产物等合成、精制工艺过程,也可能来源于储存、运输以及制剂生产中产生的降解杂质[11-13],对于药品的杂质进行全面剖析,需要一条主线贯穿整个过程,以防漏掉或分析不全面现象的出现,杂质谱便是这条主线。近年来,特别是因沙坦类药物中的亚硝胺类遗传毒性杂质引发了国内对于基因毒性杂质研究的关注[14-16],杂质谱研究日益引起了药学工作者以及药品监管者的重视。
随着盐酸阿托莫西汀胶囊及口服溶液在临床应用地逐步推广以及其他新剂型的开发,特别是对于儿童用药,临床用药安全性日益重要,本文对已有的盐酸阿托莫西汀及其制剂有关物质文献报道进行全面归纳分析,从合成路线的角度,全面系统地对盐酸阿托莫西汀的有关物质进行了总结,以期为该产品的质量控制,特别是有关物质的控制提供参考。
1 盐酸阿托莫西汀有关物质分析
对盐酸阿托莫西汀的合成路线进行检索可知[17],已产业化的合成路线均是以3-甲胺基苯丙醇为起始物料,在碱性条件下与邻氟甲苯经醚化、拆分、成盐得到[18-19],结合EP9.0、USP41药典中盐酸阿托莫西汀质量标准以及文献报道[20-21],从起始物料、拆分剂、中间体以及副产物等合成、精制工艺过程以及可能存在的降解路径进行了分析,盐酸阿托莫西汀可能的有关物质如图1所示。
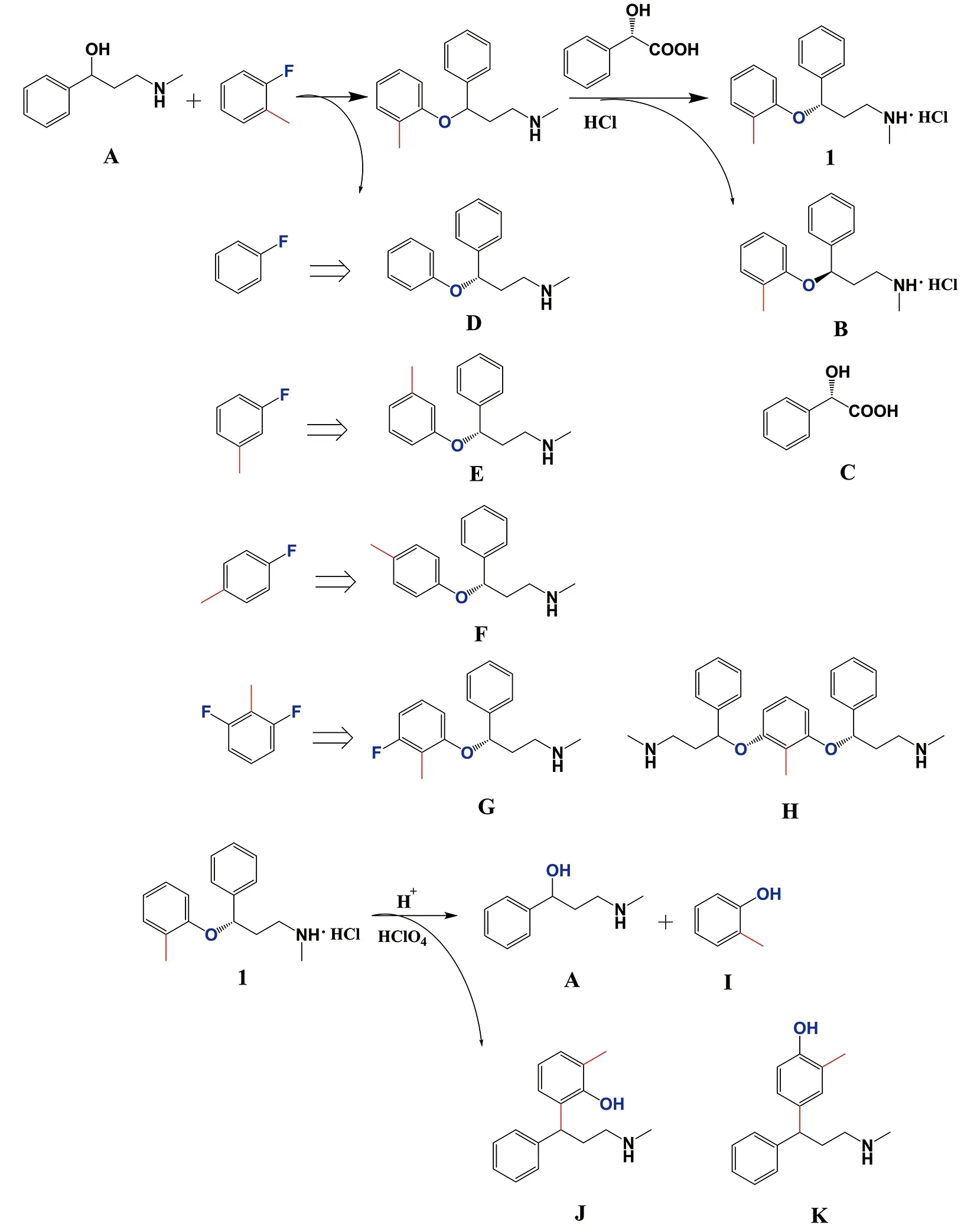
图1 盐酸阿托莫西汀的合成路线及相关杂质
由图1可知,在合成过程中由于拆分过程中存在可能产生S-异构体B以及拆分试剂C的残留、起始物料A的残留等杂质;同时对于醚化试剂邻氟甲苯,由于其自身存在的位置异构体(间氟甲苯、对氟甲苯)以及工艺杂质(氟苯、2,6-二氟甲苯),导致在盐酸阿托莫西汀合成过程中因起始物料引入相应的工艺杂质D、E、F、G、H;且据报道[17-18]盐酸阿托莫西汀在硫酸作用下,可降解为杂质A、I;在高氯酸强酸性、强氧化作用下可降解为J、K。基于图1的盐酸阿托莫西汀合成路线及相关杂质分析,盐酸阿托莫西汀及其制剂中可能存在的各杂质结构及溯源如表1所示。
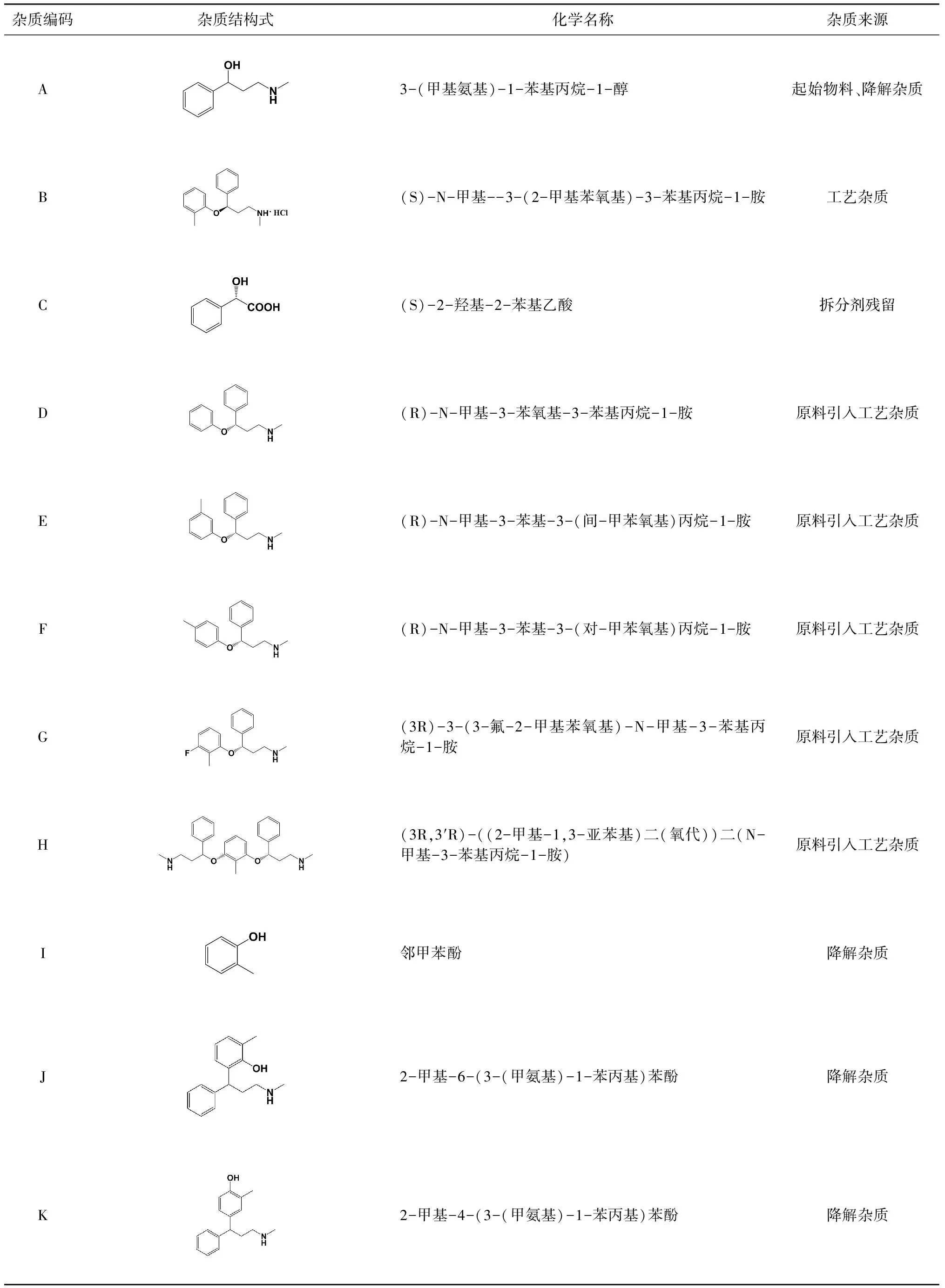
表1 盐酸阿托莫西汀各杂质结构、名称及来源信息
2 正相高效液相色谱法
由图1可知:杂质E、F与主成分互为同分异构体,由起始物料邻氟甲苯中的杂质间氟甲苯、对氟甲苯引入的工艺杂质;杂质B与主成分为对映异构体,是拆分的副产物残留引入。上述3个杂质均与主成分分子式一致,且结构相似,常规的反相高效液相法较难分离完全。
对于杂质B、E、F 3个杂质的分离《欧洲药典》EP9.0以及《美国药典》USP41-NF36均采用纤维素衍生物硅胶柱,以二乙胺-三氟乙酸-异丙醇-正庚烷(1.5∶2.0∶150∶846.5)为流动相,杂质B与D的系统适应性实验中分离度大于1.8,亦能满足对映异构体B、同分异构体E、F的分离要求。
Eli Lilly公司的Sellers等[22]系统研究了杂质B、D、E、F之间以及各杂质与主成分之间的色谱分离方式,采用非水系多糖手性柱、磺化β-环糊精改性辛基柱以及HS-β-CD(高磺化β-环糊精,七-6-磺化β-环糊精)为手性选择剂的毛细管电泳法三种方法进行分离实验,结果表明,采用Chiralcel OD-H柱,以正庚烷/异丙醇/二乙胺/三氟乙酸 (85/15/0.15/0.2,V/V/V/V)为流动相,各杂质间以及各杂质与主成分之间的分离度能够满足要求,优化后最终确定的色谱图如图2所示。
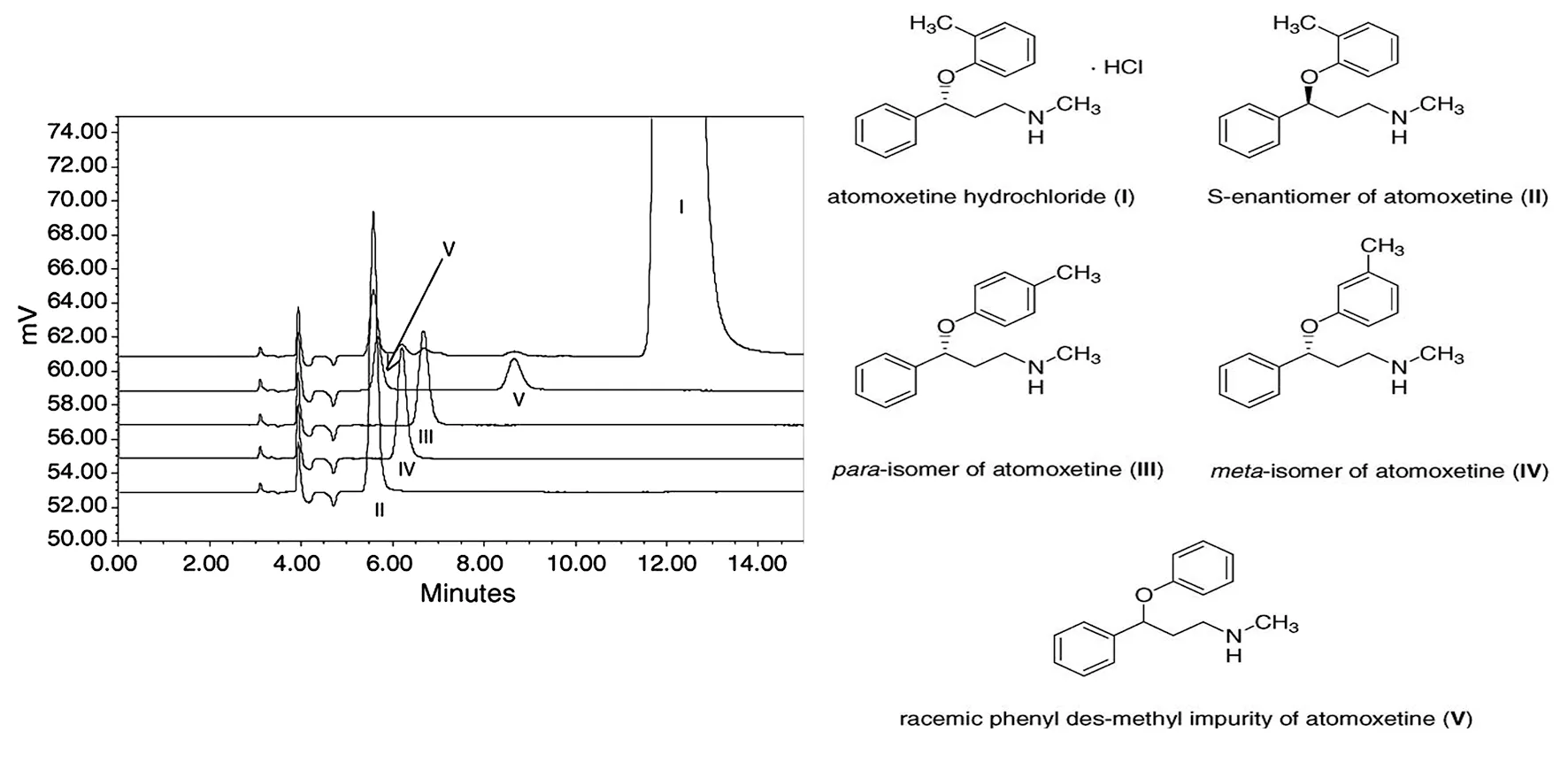
图2 各杂质在色谱条件(色谱柱:Chiralcel OD-H,4.6 mm×250 mm,5 μm;流动相:正庚烷/异丙醇/二乙胺/三氟乙酸 (85/15/0.15/0.2,V/V/V/V);1.0 mL·min-1;检测波长:273 nm;柱温:室温)的分离情况,其中杂质V为消旋体
陈杰等[23]采用新型的硅胶键合聚甲基丙烯酸酯手性柱CHIRLPAK©OT (+),流动相为甲醇-异丙醇-三乙胺(960∶40∶0.5),检测器为蒸发光散射检测器,漂移管温度为90 ℃,气流速度为2.5 L·min-1,该色谱柱具有传统硅胶正相柱的分离特点,但又不具有后者对水高度敏感的特性,且与后者比较另具有手性分离能力。同时将紫外二极管阵列检测器(DAD)串联蒸发光散射检测器(ELSD),利用ELSD能够检出无紫外吸收的杂质的特点,比较两种检测器检出杂质谱的差异,从而建立了盐酸阿托莫西汀中包括旋光异构体及同分异构体在内的有关物质的检查方法。
吴拥军等[24]采用Chiralcel OD(4.6 mm×250 mm,5 μm)手性柱,以正己烷-异丙醇-二乙胺(80∶20∶0.2)为流动相对对映异构体的分离进行了研究,结果表明左旋盐酸阿托莫西汀峰和右旋盐酸阿托莫西汀峰能很好地分开,分离度为5.5,拖尾因子小于1.2,理论塔板数大于5 000,可以用于原料药中S-盐酸阿托莫西汀含量的测定。
孙冬雪等[25]采用硅胶表面涂敷有直链淀粉-三(3,5-二甲苯基氨基甲酸酯)为填料的手性色谱柱,以一定比例的正己烷低级醇碱性添加剂为流动相,建立了一种可以有效分离杂质B、D、E、F的分离方法。
3 反相高效液相色谱法
由图1可知,除B、D、E、F 4种杂质外,其他各杂质在结构上存在一定的差异,可以采用一般的反相高效液相色谱进行分离控制。
Gavin等[20]以质量源于设计(Quality by Design,QbD)的理念,对盐酸阿托莫西汀中的杂质A、B、C、D、F、G、H、I(其中D、F、G、H为消旋体)以及其它6个杂质进行了系统研究,采用离子对-液相色谱法,以拖尾因子、运行时间、分离度[RS(A-C)、RS(D-主成分)、RS(G-主成分)]以及柱压为评价指标,考察缓冲盐浓度、pH值、离子度浓度、正丙醇比例以及柱温的影响,如图3所示,在此基础上得到了最佳的色谱条件,并进行了全面的分析方法学验证。
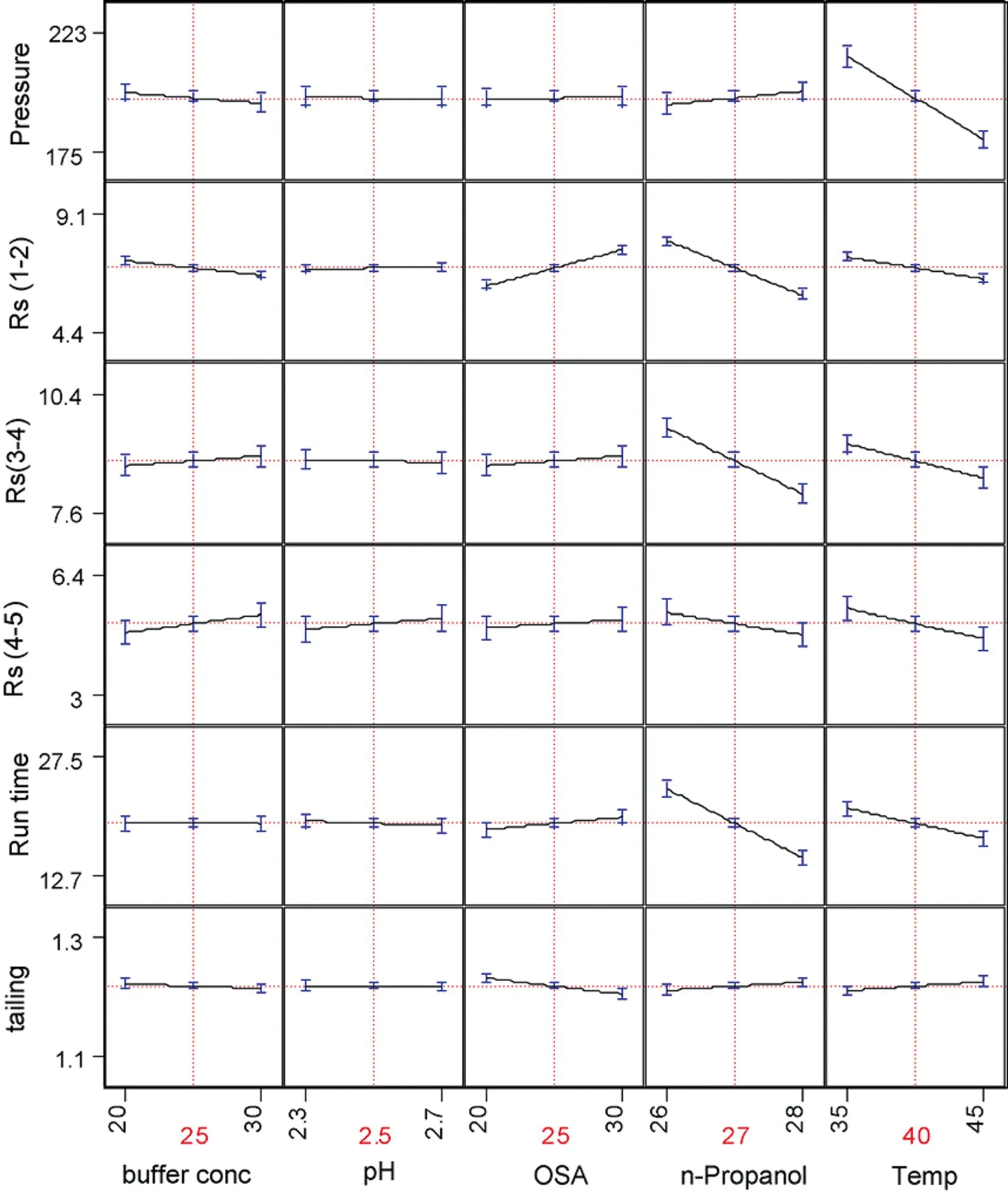
图3 缓冲盐浓度、pH值、离子度浓度、正丙醇比例以及柱温对拖尾因子、运行时间、分离度[RS(A-C)、RS(D-主成分)、RS(G-主成分)]以及柱压的影响。其中:Rs(1-2)为RS(A-C)、Rs(3-4)为RS(D-主成分)、Rs(5-4)为RS(G-主成分)
吕和平等[26]采用Elclipse XDB-C8(4.6 mm×150 mm,3.5 μm)色谱柱,以正丙醇:缓冲液(2.9 g·L-1磷酸用1 000 mL水溶解,用5 mol·L-1KOH调pH值至2.5,再加入5.9 g辛烷磺酸钠)- (27∶73) 为流动相,检测波长为215 nm,杂质A、E、H三者之间以及三者与主成分之间均能够有效分离,且经强制破坏无干扰,建立一种可以有效控制盐酸阿托莫西汀原料药有关物质的分析方法。
张小燕等[27]采用Kromasil C18(4.6 mm×250 mm,5 μm) 色谱柱,流动相:乙腈-水-三乙胺溶液(40∶60∶0.5,冰醋酸调pH至6.0),流速为1.0 mL·min-1,检测波长为270 nm,柱温为室温,对盐酸阿托莫西汀的有关物质进行了测定。虽经强制降解试验进行专属性考察,但未对特定杂质进行定位研究。
何淑旺等[28]在建立的高效液相色谱(HPLC)法测定盐酸阿托莫西汀原料药的含量方法中,对杂质A、E、F 3个工艺杂质进行了定位,可以采用该方法对杂质A、E、F进行分离,由于该方法用于含量的测定,未对其他杂质的分离情况进行相关研究。
Gavin等[19]对盐酸阿托莫西汀的起始物料3-(甲基氨基)-1-苯基丙烷-1-醇进行了系统研究,针对不同合成路线所引入的杂质,采用亲水相互作用色谱法(HILIC)、离子对-液相色谱法、离子相互作用色谱法对6条路线引入的12个杂质(如图4所示)进行了分离研究,并通过气质色谱以及液质色谱进行了结构确认。
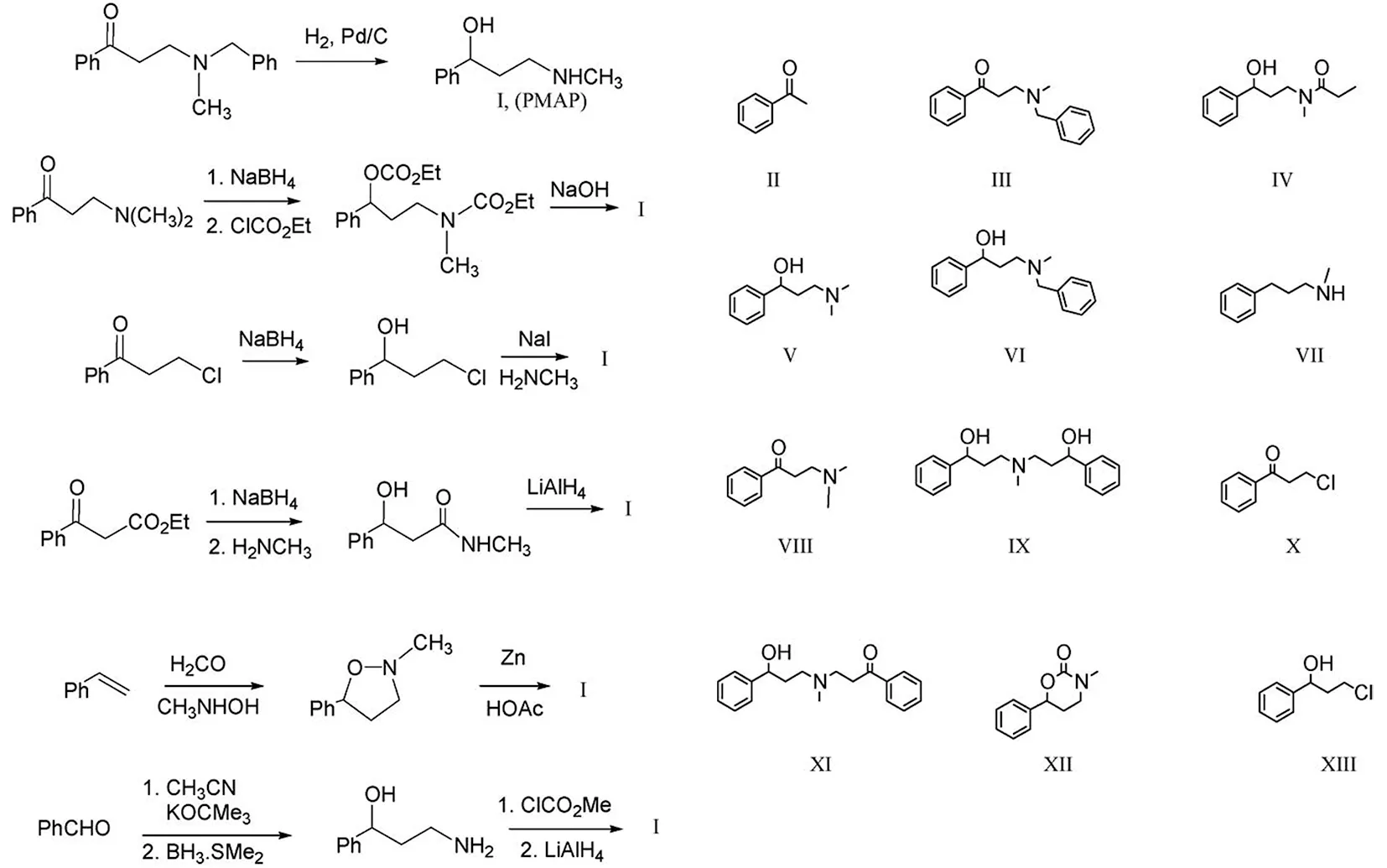
图4 盐酸阿托莫西汀起始物料3-(甲基氨基)-1-苯基丙烷-1-醇合成路线及相关杂质
张小燕等[29]以2,3,4,6-四-O-乙酰基-β-D-葡萄糖异硫氰酸酯(GITC)为柱前手性衍生化试剂,采用Agilent Zorbax SB-C18(4.6 mm×250 mm,5 μm)色谱柱,以乙腈-四氢呋喃-水(体积比为41∶14∶45)为流动相,流速1.0 mL·min-1;检测波长254 nm,柱温35 ℃。在优化试验条件下,盐酸阿托莫西汀与S-异构体的分离度R>1.5,避免手性柱成本高、寿命短、通用性差等缺点,建立了一种柱前衍生化反相高效液相色谱(RP-HPLC)法测定盐酸阿托莫西汀中S-异构体杂质的方法。
4 小结
有关物质作为贯穿药品杂质研究的主线,可以从起始物料、中间体、催化剂、副产物等工艺杂质以及可能存在的降解途径入手,对药品有机杂质谱进行全面剖析。通过对杂质结构的分析,对不同结构的杂质进行分门别类,可以为后续的分析方法建立提供参考。盐酸阿托莫西汀作为FDA批准治疗ADHD的第一个非中枢神经兴奋剂药物,在临床上得到了广泛应用,本文通过对其有关物质的全面剖析,并依据合成路线涉及的有关物质对国内外的质控研究进行了归纳总结,针对同分异构体难以分离难题,可以采取不同的控制策略,以正相色谱以及反相色谱相结合的方式可以较为全面地加以有效控制,但是在分析过程中存在交叉检测情景,需要针对性加以分析,以最大的检测能力以及检测结果作为选择依据。通过本文对于盐酸阿托莫西汀有关物质及质控情况的归纳总结,为该品种系列制剂的有关物质的质控提供参考,确保儿童临床用药安全性。
