基于在线生物监测系统的氨氮胁迫下斑马鱼行为响应
2022-07-08何雅琪任宗明
何雅琪 任宗明
(山东师范大学环境与生态研究院,济南 250300)
传统的水质监测方法包括经典分析法、重量分析法和滴定分析法。其中滴定分析法包括酸碱滴定法、络合滴定法、沉淀滴定法和氧化还原滴定法[1]。传统监测方法因存在操作相对复杂繁琐、精确度较低及适用范围受限的问题,已不能满足当下水质监测的需求。水生生物监测方法基于生物结构改变定量分析水环境的变化,可以实时精确掌握水质变化趋势[2],具有监测污染时间长、敏感度更强、结果更全面和功能多样化的特点[3]。生物监测方法包括主动监测和被动监测[4],本研究使用的在线生物监测系统属于前者,基于受试生物应对环境胁迫的行为响应,实现实时在线监测水质和评估污染状况的目标[5,6]。以生物生理生态指标为划分依据,在线生物监测方法主要分为 3 类[7]:(1)基于生物行为变化监测;(2)基于生物新陈代谢变化监测;(3)基于生物心电变化监测。基于行为变化的在线生物监测是应用于水质监测的方法之一,主要包括摄像示踪监测[8]、双壳软体类监测[9]和四极阻抗监测[10]等。摄像示踪监测通过摄像技术对水生生物的游动速度和轨迹等行为进行连续观察并记录,实现精准示踪[8];双壳软体类监测根据蚌类对环境胁迫的防御机制,双壳闭合抵御外界污染物,在贝壳上安装电磁感应器对水质进行监测[9];四极阻抗监测运用四极阻抗技术,通过实时在线监测传感器内受试生物的行为强度变化程度,进而对水环境进行分析,运用此技术,更有利于实时评估水质,达到精准监测水质的目的[10—13]。
为应对外界环境不断变化,生物在发展进化过程中也形成一套自我保护机制,即生物内稳态机制(Homeostasis)。生物内稳态是指生物控制自身的体内环境使其保持相对稳定[14],具有内稳态机制的生物借助于内环境的稳定而相对独立于外界条件,大大提高了生物的耐受范围。行为适应和调节是维持内稳态最简单高效的方法,生物通过行为调节将内环境维持在耐受范围之内,减少对外界环境的依赖[15]。调节过程主要有5个阶段:无效应、刺激、适应调节、再调节和毒性效应阶段。假设生物处于外界环境压力不断增大,但不足以对生物体造成影响的条件下,为无效应阶段;当环境压力持续增大,超过生物最低抵抗阈值时,会本能地做出回避行为,生物逐渐适应环境压力,且行为活动逐渐稳定,为适应阶段;若环境压力持续增加,生物将再次适应新的环境压力,为再调节阶段;当环境压力超过生物最大抵抗阈值,便会因毒性效应发生死亡,为毒性效应阶段[16]。
有研究表明氨氮胁迫会抑制斑马鱼(Danio rerio)的繁殖行为,进而导致斑马鱼产卵量降低[17],氨氮胁迫下鱼类会发生急性和慢性毒性效应,并受到外界环境的影响[18—20]。在本次实验中假设氨氮胁迫对斑马鱼的行为响应产生明显的影响,基于在线生物监测系统开展对照组(Control),氨氮胁迫组(NH3-N,0.15和1.5 mg/L)对斑马鱼行为响应研究,探究氨氮胁迫下斑马鱼的行为响应为本研究的核心目标。通过实时监测获取连续 15d 斑马鱼在氨氮胁迫下的行为数据,对斑马鱼昼夜节律和行为响应特征进行总结,以期为环境胁迫下斑马鱼的行为响应提供数据支撑,为提高在线生物监测系统结果的精确性和突发性水质监测技术提供有效的支持和帮助。
1 材料与方法
1.1 材料
实验装置本次研究实验装置是在线生物行为监测系统(OBBMS),该装置由山东师范大学环境与生态研究院自主开发研制,由流水循环系统、生物传感系统和监测采集系统3部分组成(图 1)。
采集监测系统数字信号传送至计算机通过快速傅立叶转换(Fast fourier transform)成可视信号,并形成相应曲线图,在计算机系统中直观展示(图 1a)。行为强度是指斑马鱼运动能力的行为参数的强度,由系统直接检测[22],系统每秒钟记录1次斑马鱼行为强度,每分钟输出1次行为强度的平均值,存储为数值文件。行为强度值在[0—1]区间内,0 表示失去行为能力,1 表示行为的完整表达,通过行为强度的数值反映斑马鱼行为响应变化[23]。

图1 在线生物行为监测系统Fig.1 Online biological behavior monitoring system
流水循环系统内置有蠕动泵、储水槽和充氧泵(图 1b)。蠕动泵可以根据实验设计与需求控制水流速度,保持流水系统的循环。本次实验水流速度控制在 2 L/h 左右,储水槽内放置实验用水。充氧泵为流水系统提供充足的氧气。三者结合实现自动化水流循环,为斑马鱼提供基本生存环境。
生物传感系统由4个生物传感器组成,生物传感器内放置5尾斑马鱼(图 1c)。生物传感器下端为进水口,上端为出水口,设有两组电极,一组为信号发射电极,发射低压交流高频电信号(电压 0.5—5 V,频率 100 Hz)形成电场;另一组为信号接受电极,接收传感器内斑马鱼行为对电场的干扰[21],利用信号滤除技术进行信号采集和处理,得到斑马鱼模拟行为学变化信号,结合模拟信号/数字信号转换器(Analog-digital converters,A/D)将模拟电信号转换为数字信号[21]。
受试生物斑马鱼本次研究受试生物为斑马鱼,其易于大规模养殖,与人类基因高度相似,实验操作简单且对环境胁迫反应灵敏[24,25]。近年来已有研究证明斑马鱼是一种具有昼夜节律的优良模式生物[26]。斑马鱼具备的优势十分符合本次研究的要求,能够达到预期实验目标。实验室具有构建完善的斑马鱼养殖系统,可以满足本次实验受试生物的需要;目前已经具备体系完整的斑马鱼 OBBMS对水体环境进行评估,为本次研究提供技术支持。
1.2 实验设计
设置3组实验,分别为对照组(Control),氨氮胁迫组(NH3-N,0.15和 1.5 mg/L),每组实验设置4个平行实验。
实验步骤如下:①受试生物的选择:在斑马鱼养殖系统中,随机抽取20尾健康状况良好、体长35—45 mm斑马鱼,雌雄比例为1∶1,实验 24h 前停止喂食。② 实验用水:在养殖系统饲养缸内备置实验用水(斑马鱼养殖系统中,设有曝气水装置和循环水装置。将水体加入曝气装置充分曝气 3d 以上,待残留的氯完全消除,溶氧充分后,加入水箱,通过纤维棉、清水树脂、生化棉和瓷环等材料过滤,紫外杀菌后通过潜水泵进入饲养缸,通过循环水装置再次进行过滤消杀,并定期更换过滤材料及养殖用水)。水温(26±0.5)℃,硬度(CaCO3)(250±25) mg/L,pH(7.8±0.2),每组实验水量为 4 L。③药品配置:氯化铵(NH4Cl,纯度≥99.5%)购自中国标准样品中心,按照 NH4+离子浓度配制成浓度为 1 g/L的母液,根据实验需求稀释至所需浓度,放置于储水箱内。④ 毒性暴露:仪器校准,开启流水循环系统,使液面与生物传感器上沿齐平。实验开始前生物传感器内不放置斑马鱼,启动在线生物监测系统,1h后待水流稳定,使用仪器自带的校准程序进行校准。
校准后,每个生物传感器内放置5尾斑马鱼,稳定运行后进行流水试验,在实验过程中,对水源进行避光处理,系统自动采集并记录数据(实验开始后30min的数据为准),第一天上午8:00开始采集数据,光源放置在实验装置上方 2 m 处,强度在3000—4500 lx,光暗比为 16h∶8h。
每两天对斑马鱼进行一次饱食投喂(9:30),喂食结束30min后更换全部实验用水,每天定时用电动虹吸泵清除粪便。
1.3 分析方法
本研究所有的数据分析,图表绘制等工作主要基于 Excel 2010、SPSS22.0 和 MATLAB 环境(The Mathworks,R2014a)完成。
实验数据均以平均值±标准差(Mean±SD)呈现,利用 Excel 2010 对实验数据进行初步处理,计算出光暗周期行为强度的平均值,通过行为强度平均值的变化评估斑马鱼的回避行为。再将初步处理后的数据通过 MATLAB 软件进行 Autocorrelation 和SOM 分析。对实验数据使用 SPSS22.0 进行显著性差异分析。在光暗周期下斑马鱼的行为强度数值根据P值确定其统计学意义,当P<0.01 时表示光周期与暗周期行为强度值的差异性,并且具有统计学意义;在氨氮暴露条件下斑马鱼的行为强度数值P<0.05,P<0.001 表示实验组与对照组行为强度值的差异性,并且具有统计学意义。
Autocorrelation 又称为串行相关或交叉自相关,它是一个查找重复模式的数学分析工具,用于数据周期性分析。运用 Autocorrelation分析 OBBMS所监测的信号与信号之间在不同时间序列点的关联程度,分析评价斑马鱼昼夜节律的周期性特征[9]。
SOM 是一种基于神经网络的聚类分析,神经网络只包含输入层和隐藏层,隐藏层中的一个节点代表一个需要聚成的类,每一个数据在隐藏层中与其最匹配的节点聚合,节点产生向周围逐渐衰减的聚合现象,最终实现聚类。对数据进行 SOM 处理,通过交互计算对斑马鱼的行为进一步分析,更直观地观察氨氮胁迫下斑马鱼的行为响应。使用 Ward连接法,依据欧几里德距离以树状图的表现形式进行聚类分析[27],揭示 SOM 单元之间的关联程度。
2 结果
2.1 对照组斑马鱼行为响应
将15d(360h)斑马鱼行为强度(Behavior strength,BS)数值整理见表 1。对照组斑马鱼行为强度平均值(Average behavior strength values,AV) 0.69±0.13,光周期行为强度平均值(Average behavior strength values in light periods,AVL) 0.73±0.13,暗周期行为强度平均值(Average behavior strength values in dark periods,AVD) 0.66±0.14,光暗周期行为强度差异 [Differences between AVD and AVL,D(AVDAVL)] 10.61% 。分析数据,斑马鱼 AVL 明显高于AVD,说明斑马鱼光周期BS高于暗周期,反映出斑马鱼行为活动特点。基于斑马鱼BS数据,绘制斑马鱼行为强度变化曲线图(图 2)。
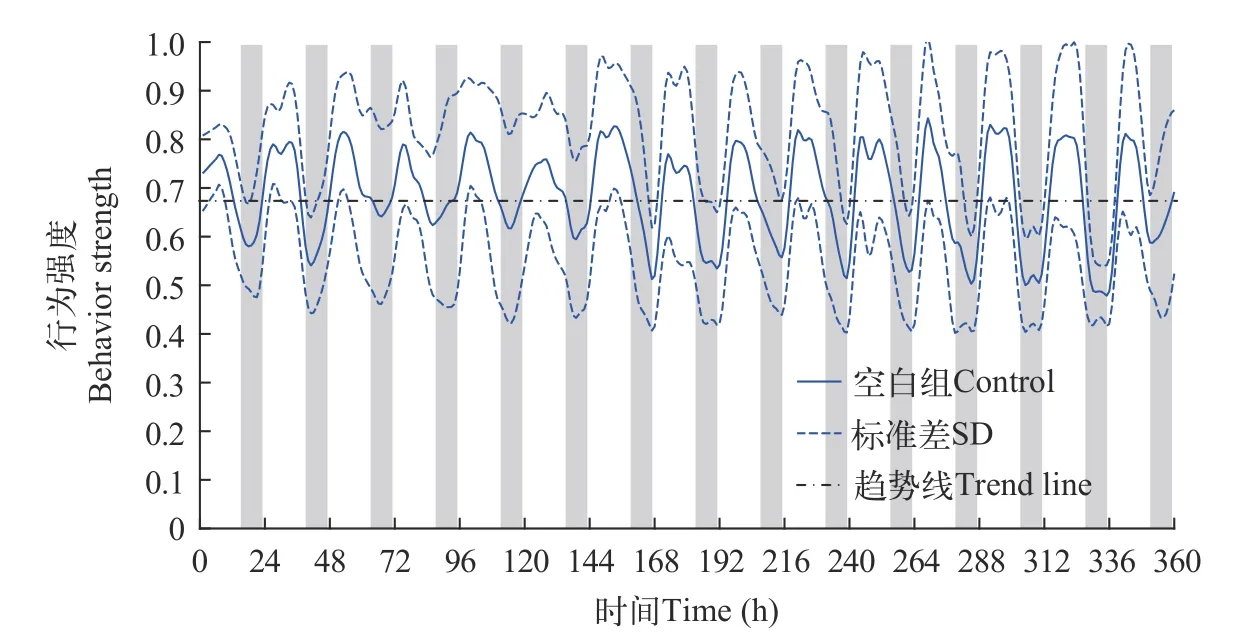
图2 对照组斑马鱼行为强度曲线Fig.2 The BS value curve of zebrafish in control
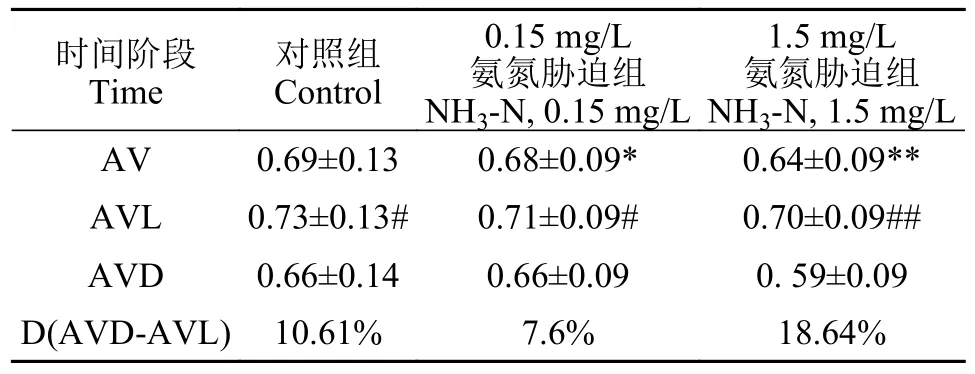
表1 实验周期中斑马鱼的行为强度平均值Tab.1 The BS mean values of zebrafish during 360h exposure
分析行为强度变化曲线,光周期斑马鱼BS增加至第1个峰值后降低,当进入暗周期时,BS逐渐降低至第1个谷值,随后又逐渐上升,到达第2个峰值后逐渐下降,进而又逐渐上升,之后变化趋势与第1天大致相同。
分析行为强度变化曲线的趋势线,发现斑马鱼BS比较稳定,强度值保持在 0.68 左右。在实验周期中,除2d、3d 和 4d时暗周期BS降幅较小外,基本每个暗周期 BS 都出现了明显的谷值,进入光周期后,BS 又逐渐升高到第2个峰值,周期性为 24h,这一现象证明斑马鱼行为响应具有明显的昼夜节律现象。
运用自相关分析昼夜节律的周期性(图 3)。
通过以下方面对图 3 进行分析:(1)斑马鱼BS正相关与负相关呈现周期性表达。(2)正负相关性的变化过程与实验过程中光暗周期范围一致,峰值交替出现的周期性为 24h。(3)自相关分析中正负相关峰值具有对称性,波峰有规律的降低。
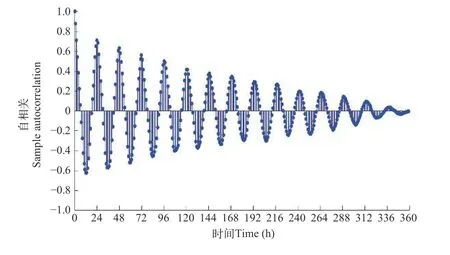
图3 斑马鱼行为强度自相关分析Fig.3 Autocorrelation function applies to BS values of zebrafish
得出,对照组斑马鱼行为响应具有昼夜节律现象,以 24h 为周期;每个周期中斑马鱼的 BS 变化整体较为规律,没有明显的波动现象。
综上,得出以下结论:斑马鱼的行为响应具有明显的昼夜节律现象,光周期BS高于暗周期BS,强度差异为 10.61%。实验周期中斑马鱼BS比较稳定,强度值保持在 0.68±0.13 左右。斑马鱼昼夜节律周期基本稳定在 24h 左右。
2.2 氨氮胁迫组斑马鱼的行为响应
氨氮胁迫组15d(360h)斑马鱼BS的数据见表 1。
根据表 1数据,氨氮胁迫组(NH3-N,0.15和1.5 mg/L)斑马鱼AV分别为 0.68±0.09和 0.64±0.09,AVL分别为0.71±0.09和0.70±0.09,AVD分别为0.66±0.09和0.59±0.09,D(AVD-AVL)分别为 7.6%和18.64%。
差异性方面,氨氮胁迫组(NH3-N,0.15 mg/L)与对照组相比,D(AVD-AVL)差异小于对照,氨氮胁迫组(NH3-N,1.5 mg/L)、D(AVD-AVL)大于对照。氨氮胁迫组(NH3-N,0.15 mg/L)与对照差异性P<0.05,氨氮胁迫组(NH3-N,1.5 mg/L)与对照差异性P<0.001,说明在有效氨氮浓度下,浓度越高,斑马鱼行为活动的抑制越显著(P<0.001)。
绘制氨氮胁迫组斑马鱼行为强度变化曲线图(图 4 和图 5)。

图4 氨氮胁迫组(NH3-N,0.15 mg/L)斑马鱼行为强度曲线Fig.4 The BS value curve of zebrafish under 0.15 mg/L ammonia nitrogen stress
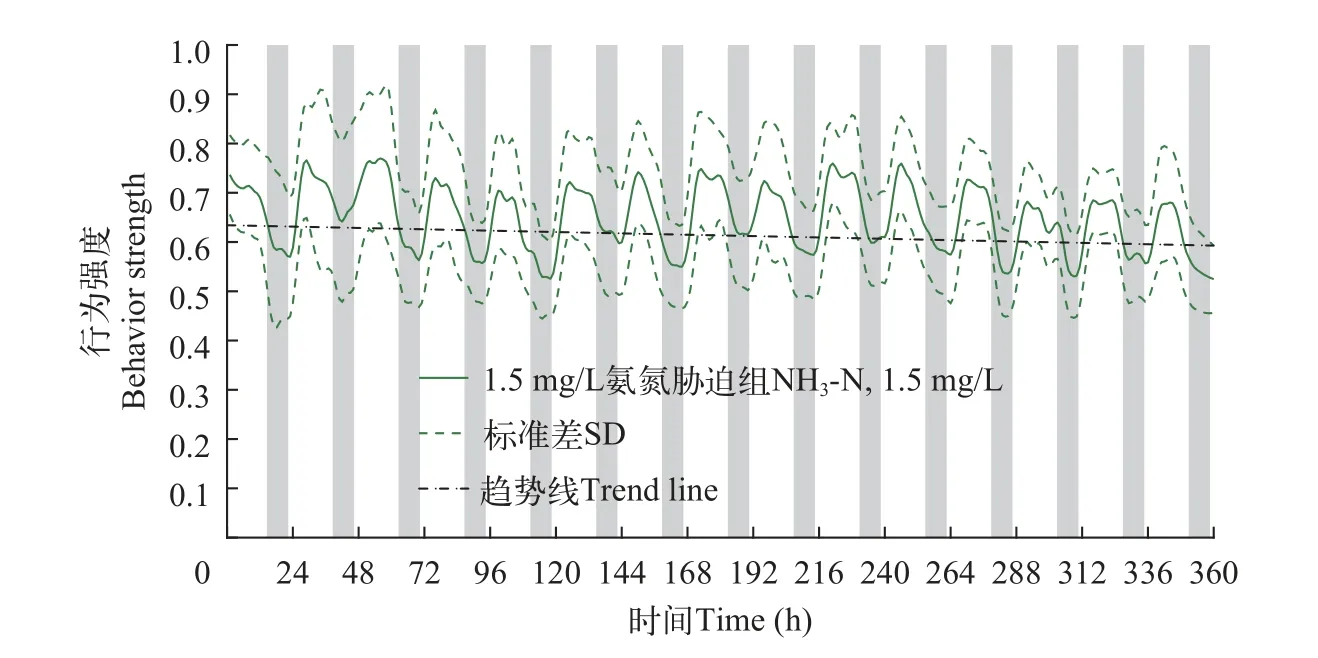
图5 氨氮胁迫组(NH3-N,1.5 mg/L)斑马鱼行为强度曲线Fig.5 The BS value curve of zebrafish under 1.5 mg/L ammonia nitrogen stress
从行为强度曲线整体分析,氨氮胁迫组(NH3-N,0.15 mg/L)的行为变化曲线趋势线略低于对照组,氨氮胁迫组(NH3-N,1.5 mg/L)的行为变化曲线趋势线明显低于对照组,且氨氮胁迫组(NH3-N,1.5 mg/L)暗周期行为强度的谷值出现延迟现象,以上特点和表 1 中的数据都表明,氨氮胁迫对斑马鱼的行为响应具有抑制作用,在有效氨氮浓度下,浓度越高,抑制作用越强。
氨氮胁迫组自相关分析结果(图 6 和 图 7)。
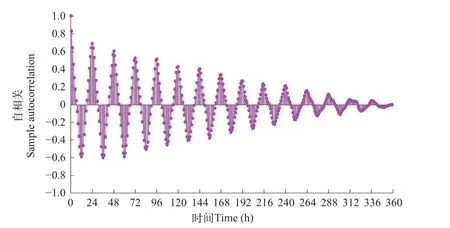
图6 氨氮胁迫组(NH3-N,0.15 mg/L)斑马鱼行为强度自相关分析Fig.6 Autocorrelation function applies to BS values of zebrafish under 0.15 mg/L ammonia nitrogen stress
通过以下方面对图 7 和图 8 进行分析:
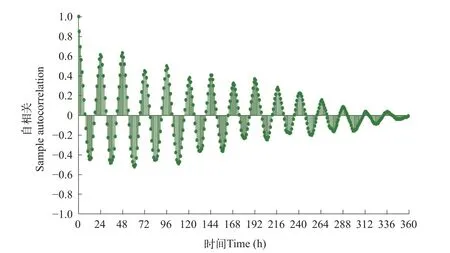
图7 氨氮胁迫组(NH3-N,1.5 mg/L)斑马鱼行为强度自相关分析Fig.7 Autocorrelation function applies to BS values of zebrafish under 1.5 mg/L ammonia nitrogen stress
(1)以 24h 为周期,正相关峰值与负相关峰值交替出现。(2)由于存在氨氮胁迫,斑马鱼行为响应昼夜节律发生变化。在氨氮胁迫组(NH3-N,0.15 mg/L)中,1d时负相关峰值明显低于对照组,14d和15d 时未出现明显的正负相关性。(3)与对照组相比,氨氮胁迫组(NH3-N,1.5 mg/L)正负相关性异常,对称性紊乱且峰值逐渐降低等。
得出,氨氮胁迫组(NH3-N,0.15 mg/L)中斑马鱼昼夜节律现象依旧明显,周期性未发生较大改变,基本维持在 24h 左右。在氨氮胁迫组(NH3-N,1.5 mg/L)中斑马鱼昼夜节律发生紊乱,周期性出现异常。
基于每小时AV分析行为响应与氨氮胁迫之间的关系,进行 SOM 聚类分析(图 8)。
图8A与8B相比,集群 2、3、5 表示光周期,集群 1、4、6 表示暗周期。对照组与 图 8A 表现出良好的相关性,集群 2、3、5 与行为强度较强的红色区域相匹配,说明 BS 在光周期较剧烈,集群1、4、6与行为强度较弱的蓝色区域相匹配,说明暗周期 BS 低于光周期。图 8C 中集群 3 和 5、集群 4和 6 紧密度最高,集群 3 和 5 与集群 2、集群 4 和6 与集群 1 紧密度次之,集群 2、3、5 与集群 1、4、6紧密度最低,表明相同周期的集群紧密度更高,从聚类分析的角度说明斑马鱼的昼夜节律现象。氨氮胁迫组与对照组相比(图 8D),在行为抑制方面,氨氮胁迫组(NH3-N,0.15 mg/L)蓝色区域面积变大,氨氮胁迫组(NH3-N,1.5 mg/L)蓝色区域面积较低浓度组更大,说明氨氮胁迫对斑马鱼BS存在抑制作用,在有效氨氮浓度下,浓度越高,抑制作用越强。在昼夜节律方面,氨氮胁迫组(NH3-N,0.15 mg/L)和 (NH3-N,1.5 mg/L) 中本应为光周期的集群 5与集群 2出现行为强度较低的蓝色区域,这可能是因为在氨氮胁迫下,斑马鱼的行为响应出现周期性延迟。

图8 斑马鱼行为响应 SOM 聚类分析Fig.8 SOM profiles of behavior strength of zebrafish
综上所述,可以得出以下结论:(1)氨氮胁迫下斑马鱼行为响应最显著的特点是行为活动遭到抑制。根据表 1 中的数据显示,氨氮胁迫组(NH3-N,0.15 mg/L)BS 轻微抑制,氨氮胁迫组(NH3-N,1.5 mg/L) BS 抑制作用更强。(2)对照组和氨氮胁迫组斑马鱼行为响应具有显著的昼夜节律现象。自相关分析中正负相关峰值交替性出现,总体表现出较为良好的对称性且周期性为 24h,通过 SOM 聚类分析,大部分BS 的数据符合光暗周期的时间分布,说明了斑马鱼行为响应具有昼夜节律现象。
本次研究的结果说明,在周期为 15d 的斑马鱼行为响应实验中,基于对 OBBMS采集的行为强度数据采取不同的分析手段,斑马鱼行为响应表现出明显的昼夜节律现象,周期为 24h 左右。在氨氮胁迫下斑马鱼行为强度遭到抑制,在有效氨氮浓度下,浓度越高,抑制作用越强,同时昼夜节律也出现时间节点延迟和聚类分析异常的现象。
3 讨论
游动是鱼类的重要行为之一,高度胁迫下鱼类进行力竭游动,此时供能物质为白肌的无氧糖,无氧糖酵解会加速氨的生成,致使机体内氨含量增加,氨氮毒性作用进一步加强。张云龙等[28,30]对鲤和鲫的研究中发现氨氮胁迫下鱼类游动能力降低,这可能是因为 NH4+的增加使鱼类代谢方式发生变化,并且替代 K+造成肌肉细胞膜去极化,损伤肌肉组织。因此,游动和氨氮胁迫对鱼类是两个相互作用的因素,游动扩大了氨氮毒性,氨氮胁迫降低了鱼类的游动能力。在本研究中,对照组斑马鱼 AV 为 0.69±0.13,氨氮胁迫组(NH3-N,0.15和 1.5 mg/L)AV分别为0.68±0.09和0.64±0.09,氨氮胁迫组 AV 低于对照组,表明氨氮胁迫降低了鱼类的游动能力,且氨氮胁迫组(NH3-N,0.15 mg/L)与对照组差异性P<0.05,氨氮胁迫组(NH3-N,1.5 mg/L)与对照组差异性P<0.001,说明在有效氨氮浓度下,浓度越高,斑马鱼行为活动的抑制越明显。
氨氮会影响鱼类的生长发育、渗透压平衡、行为活动等,并且会对鱼类产生急性和慢性毒性效应[19],处于氨氮胁迫下斑马鱼行为响应最显著的特点是行为活动遭到抑制,且在有效浓度下,浓度越高抑制作用越强,同时昼夜节律也出现时间节点延迟和聚类分析异常的现象。赵瑞彬[16]指出,行为活动遭受抑制是斑马鱼在环境胁迫下最显著的现象,抑制现象在实验组均有表现,其中3组高浓度暴露实验抑制程度(P<0.001)比两组低浓度暴露实验(P<0.05)更加显著,行为活动受抑制的程度与环境胁迫有关,在一定浓度范围内具有正相关关系,实验组 SOM聚类分析中 BS 分布图也有异常现象,暗周期内的聚类出现了行为强度较高的红色部分,显示出昼夜节律周期的延迟性,这与本研究结果一致。
潘宏伟[30]通过探究[0.52 μg/L(0.1TU),2 μg/L(10%地表水)]溴氰菊酯(DM)对斑马鱼脑和心脏中毒蕈碱受体(M1)、乙酰胆碱酯酶(AChE)及前动力蛋白 2(PK2)表达的影响,研究 DM 对斑马鱼行为响应的机制。发现实验组中斑马鱼脑和心脏中的AChE 大部分高于对照组,可能会造成乙酰胆碱含量降低,进而导致斑马鱼的 AV下降,且 DM 干扰斑马鱼脑和心脏中 PK2 的正常表达,影响行为节律信号输出,进而扰乱斑马鱼的昼夜节律。潘宏伟探究 DM 对斑马鱼的行为影响及内在机制,为本次研究结果提供理论依据。
现实中水体污染物种类不单单为一种,多种污染物的联合暴露的毒性效应尚不明确。王余江等[31]发现视黄酸的存在对因四溴联苯醚(BDE-47)和十溴联苯醚(BDE-209)暴露引起的斑马鱼运动行为异常起到恢复作用,李佳妮等[32]研究得出2 μmol四溴双酚A(TBBPA)对斑马鱼有较强的毒性作用,但是TBBPA 联合50 μg/mL Anti-IntegrinαVβ3 抗体(LM609)显微注射的斑马鱼胚胎的毒性作用减弱,说明LM609在一定程度上削弱了TBBPA 对斑马鱼的神经行为毒性影响。目前关于氨氮的联合暴露对水生生物的毒性效应进展较少,因此探究氨氮与多种污染物的联合暴露成为后续斑马鱼行为研究的方向。
由于水体突发污染事件频发,水质在线生物监测系统的发展与使用引起世界各国高度关注。近年来,我国在线水质监测系统和管理体系发展迅速,开发了基于四级阻抗技术的生物安全预警系统(BEWS),并在生产生活中应用广泛,在全国七十多个水厂和环境监测站运行,为保障城市居民饮水安全做出重大贡献。韩国在国内5 条主要河道干流安装水质监测网络(AWAMNs),在50 个 AWAMNs 监测站点中有 39 个应用OBBMS,且计划进一步增加 AWAMNs 的数量。在线生物监测系统具有运行经济性、技术先进性、监测实时性和结果精确有效性等特点,在处理水体应急污染事件,维护社会秩序、保证供水安全及社会经济持续健康发展等方面,将会发挥越来越重要的作用[20]。
综上所述,本次研究运用基于四级阻抗技术的在线生物监测系统,探究0.15和1.5 mg/L氨氮胁迫下斑马鱼行为响应,斑马鱼行为响应表现出明显的昼夜节律现象,周期为24h左右。在氨氮胁迫下斑马鱼行为强度遭到抑制,在有效氨氮浓度下,浓度越高,抑制作用越强,同时昼夜节律也出现时间节点发生延迟和聚类分析异常的现象。本研究是对氨氮胁迫下斑马鱼行为响应的初步研究,探究氨氮对斑马鱼的内在机制成为后续研究的方向。
