模拟捕食者风险对大黄鱼幼鱼行为、游泳能力及应激水平的影响
2022-07-08王莉平林听听刘声宇王孝杉李思平
王莉平 张 东 刘 鑫 林听听 刘声宇 王孝杉 李思平
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090)
在自然环境中,鱼类经常需要改变其行为以应对变化的环境,来提高生存几率[1],而捕食者是影响个体生存最强烈的环境因素之一[2—5]。鱼类识别和躲避捕食者的能力不仅受遗传因素影响,而且其行为特征还能通过环境发生改变[6—8]。研究表明,动物早期的生活环境可能会对其行为产生终身的影响[9],这取决于早期的经历能否满足个体后期的生存需求,如果遇到类似的情境,个体可以根据早期经验,轻松应对[10,11]。Robin等[12]将三刺鱼(Gasterosteus aculeatus)分别养殖在模拟捕食者环境、复杂环境和变化的社会环境中时,发现早期环境压力能够影响鱼的行为表型。由于在没有捕食压力的人工养殖环境中鱼类的行为可能无法得到充分的发育,因此,Brown等[13]指出,在养殖水体中利用抄网模拟捕食者对鱼类进行追赶训练,可以使人工养殖的鱼获得与野生个体相当的抗捕食者行为。Mirza 和Chivers[14]也证明了放流前进行适当的野化训练能够提高放流鱼的成活率。
人工增殖放流已成为恢复鱼类自然资源的重要手段,人工养殖鱼放流效果不佳的状况也日益受到重视,因此,放流前对鱼苗进行驯化使其具备应对多种风险的能力已成为共识。抄网追赶训练已被证实能够改变一些鱼类的行为特征,使其更好地应对复杂多变的外界环境,因而此类训练已作为鱼类放流前驯化的手段之一。此外,运动训练对于提高鱼类的游泳能力也有一定的作用[15,16]。研究已证实,抄网追赶训练可综合性地改善鱼类的行为特征及运动表现,是一种高效并且容易操作的驯化方式[17]。然而,抄网追赶对鱼类来说也是一种胁迫,胁迫对鱼类造成的影响可能是直接致死的,也可能是亚致死的。亚致死强度的胁迫会使鱼类产生应激反应[18],长期处于应激状态,会对鱼类的生长、抗病力等产生负面影响[19—22]。因此,不合理的训练设置可能导致鱼体生长受损、免疫能力和生存能力下降等[23,24]。
大黄鱼(Larimichthys croceaRichardson,1846),隶属于鲈形目(Perciformes)、石首鱼科(Sciaenidae)、黄鱼亚科(Larimichthysinae)、黄鱼属(Larimichthys),为我国传统“四大海产”之一,是我国福建和浙江等省重要的海洋经济鱼类之一。由于20世纪60、70年代的过度捕捞,导致其资源急剧衰退。尽管自1987年以来每年都会通过增殖放流对野外资源进行补充,然而收效并不理想[25]。主要原因可能是放流鱼苗没有获取足够的野外生存经验,存在着一些行为特征以及运动能力上的缺陷,使得成活率较低,这也是目前鱼类增殖放流中普遍存在的问题[26—28]。虽然抄网追赶模拟捕食者风险是一种高效并且容易操作的驯化方式,但由于不同鱼类对胁迫的敏感程度不同[29],因而针对不同种,操作方式也不同。大黄鱼对于机械操作胁迫的反应较为敏感且强烈,不管是幼鱼还是成鱼只要受到异常扰动,就会慌乱不安,严重时甚至会死亡[30],因此亟需对抄网追赶设置进行深入研究。本研究以80 dpf (Days post fertilization)的大黄鱼幼鱼为研究对象,探究了大黄鱼幼鱼在不同水平的追赶刺激下其生长、行为、游泳能力及应激水平的变化,以确定合理的刺激水平,旨在为后续研究大黄鱼的行为及对大黄鱼放流前的驯化奠定基础,同时本研究可为深入了解不同生态类型鱼类受到此类刺激后的反应机制提供更多案例。
1 材料与方法
1.1 实验对象
实验中所使用的大黄鱼鱼苗由中国水产科学研究院东海水产研究所福建福鼎研究中心自行孵育,鱼卵购自于福建省福鼎市沙埕镇大白鹭村闽海农业专业合作社。将鱼卵放入孵化桶中,20h左右即孵化出仔鱼,孵化水温为23℃,盐度为18.2,孵化后第3天开始投喂轮虫,第8天开始投喂丰年虫,第12天开始投喂桡足类,第19天开始投喂配合饲料。暂养及实验期间均投喂沉性颗粒饲料,每日投喂3次,分别在8:00—9:00、12:00—13:00和18:00—19:00进行,每天下午5:00—6:00排污换水,养殖期间水温为(20.43±1.55)℃,盐度为18.2,光照为1000 lx。
1.2 实验设计
将80日龄(dpf)的大黄鱼幼鱼[体长:(3.71±0.48) cm,体重:(1.27±0.42) g]随机分配到12个圆柱形养殖桶(直径×高=80 cm×80 cm),每桶100尾,暂养1周。实验设置抄网刺激对照组和处理组[2.5、5.0和7.5min/(F·D)][minute/(Frequency·Day),(分钟/次·天)],每天分别进行2次处理,每组3个重复,各养殖桶随机编号。
抄网刺激前,将所有养殖桶同时停气,并排水至30 cm深,用手抄网(直径:30 cm,网长:15 cm,网孔直径:2 mm,颜色:黑色,柄长:1 m)环绕桶周,速度为6 s/r,追逐鱼群,分别在每天上午9:00—11:00,下午14:00—17:00各进行1次抄网追赶训练,各组刺激时间分别为0、2.5min、5.0min和7.5min。在刺激过程中保证每条鱼都受到追赶,并避免网挂到鱼,对鱼造成损伤。且每日喂食前后至少超过1h再进行抄网追赶,避免刺激对鱼的摄食及消化造成影响。每日记录各养殖桶的死鱼数及鱼苗的游动情况,刺激结束后同时开气、加水,所有使用的工具前期均使用次氯酸钠消毒。刺激15d后,各桶随机捞出20尾暂养于另一养殖桶中进行后续分析,剩余幼鱼继续进行抄网追赶刺激,直至30d。在30d处理结束后,将鱼暂养7d,进行二次抄网追赶,追赶时间为10min(刺激强度同上),测试前期抄网追赶对大黄鱼幼鱼后期压力应对的影响。
1.3 取样及测定
分别对刺激15d和30d的大黄鱼幼鱼进行采样。采样时,使用丁香酚将停止刺激并暂养3d后的幼鱼麻醉,称量体长体重,并采集血样。同时,为探究不同水平的抄网追赶对大黄鱼幼鱼行为的影响,实验对停止刺激3d后的大黄鱼幼鱼分别进行行为测试,包括新环境测试、恢复性测试、压力应对方式测试和回避测试,还进行了游泳能力测试。此外,所有实验鱼在行为测试以及采样前均禁食24h。同上,二次刺激结束后立即麻醉取血样。
1.4 行为测试方法
所有行为测试均在长×宽×高=70 cm×35 cm×30 cm的玻璃缸中进行,测试水温及光照强度均与养殖环境相同。玻璃缸的底部及四周用白色防水纸粘贴,避免人为因素的干扰。底部平均划分成50个正方形小格(7 cm×7 cm),并进行分区:玻璃缸四个角的正方形小格代表角区域,距离缸壁一个正方形小格去除角区域部分为边区域,除去边角区域剩下的为中间区域。在玻璃缸顶端架一台摄像头(萤石云),全程拍摄记录,实验鱼都未被重复测试。
新环境测试(Novel environment test) 为了测试抄网追赶训练能否提高大黄鱼幼鱼对陌生环境的探索性,实验对不同水平抄网追赶下的大黄鱼幼鱼进行了新环境测试(图 1)。将距离玻璃缸一端14 cm处放置一块白色雪弗板,隔出35 cm×14 cm×30 cm的区域作为适应区。测试开始前,使用100 mL烧杯将鱼轻轻捞出,带水转移至玻璃缸的适应区适应30min,随后轻轻提起隔板,使鱼自由游出,共记录10min[31,32]。记录的指标包括变换区域的次数、进入边区域的次数、进入角区域的次数、出适应区的次数、在边区域待的总时间(s)、在角区域待的总时间(s)和在角区域单次持续的最长时间(s)。
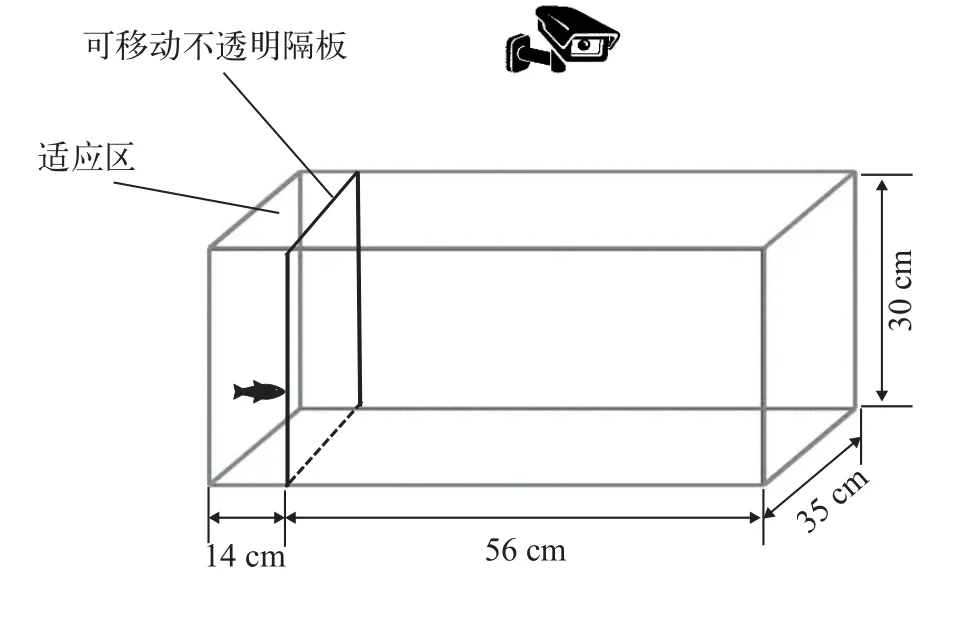
图1 新环境测试装置Fig.1 Schematic diagrams of the experimental procedures for the novel environment test
恢复性测试(Emergence test)为了测试抄网追赶训练能否影响大黄鱼幼鱼胁迫恢复后的运动活跃能力,实验对不同水平抄网追赶下的大黄鱼幼鱼进行了恢复性测试(图 3)。按照压力应对测试相同的方法先将鱼在小抄网上于空气中暴露60s,放入适应区恢复6min,随后轻轻抬起隔板至水面的2/3处,观察10min[13,17]。记录的指标包括:首次出适应区的时间、首次回适应区的时间(s)和在适应区外待的时间(s)。
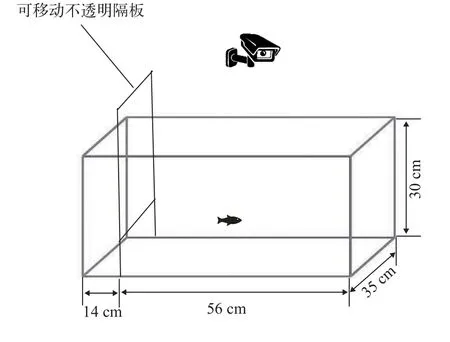
图3 恢复性测试装置Fig.3 Schematic diagrams of the experimental procedures for the emergence test
压力应对方式测试(Stress coping style test)为了测试抄网追赶训练能否改善大黄鱼幼鱼对胁迫的应激恢复能力,实验对不同水平抄网追赶下的大黄鱼幼鱼进行了缺氧应激测试(图 2)。将单尾鱼转移至手抄网(直径15 cm)于空气中暴露3min,随后将鱼轻轻放入水中,直至恢复稳定,判定标准为鱼能够正立身体、无倾斜、不乱窜、正常缓慢游动。记录指标:鱼恢复正常游动所需要的时间(s)[33]。
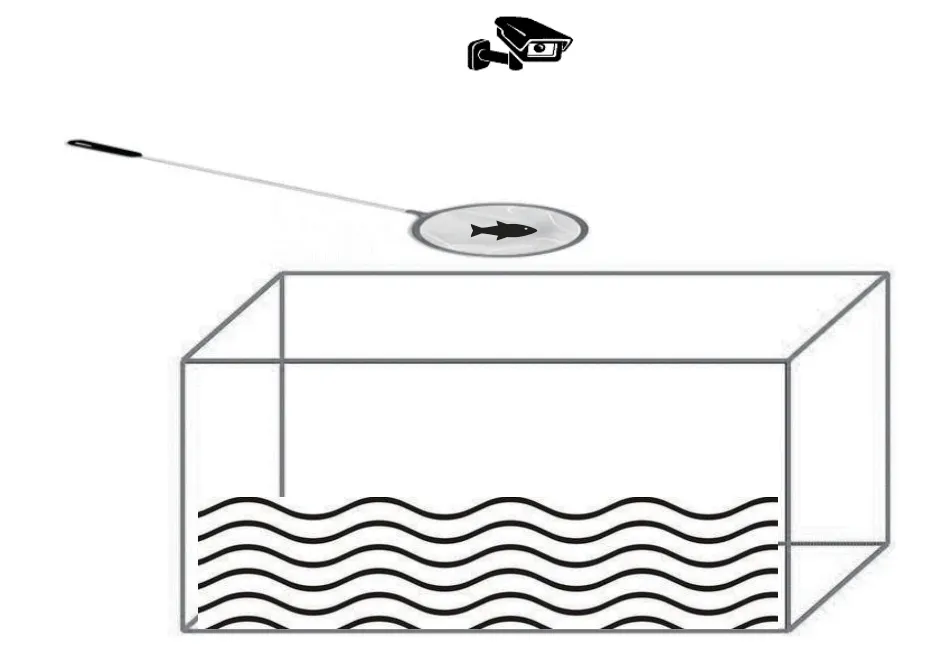
图2 压力应对方式测试装置Fig.2 Schematic diagrams of the experimental procedures for the stress coping style test
回避测试(Avoidance test)为了测试抄网追赶训练能否提高大黄鱼幼鱼逃避追捕的能力,本实验对不同水平抄网追赶下的大黄鱼幼鱼进行了回避测试(图 4)。回避测试在恢复性测试后进行,恢复性测试完成20min后,当鱼出现在鱼缸对面时,用一个和抄网追赶刺激中颜色、大小不同的手抄网(直径:10 cm,柄长:25 cm),给予其一个新的信号刺激,迅速捕捞鱼,并停留15s,15s内鱼逃回适应区则认为鱼有回避行为,比较各组鱼的回避情况[17]。

图4 回避测试装置Fig.4 Schematic diagrams of the experimental procedures for the avoidance test
1.5 游泳速度测定方法
为了探究抄网追赶训练对大黄鱼幼鱼游泳能力的影响,实验对不同水平抄网追赶下大黄鱼幼鱼的绝对临界游泳速度(Absolutely critical swimming speed,Ucrita)和相对临界游泳速度(Relatively critical swimming speed,Ucritr)进行了测定。设备购于丹麦Loligo Systems公司,实验中临界游泳速度的测定采用Brett流速递增法[34,35],测定方法参照王晓等[36]在探究温度梯度对四大家鱼临界游泳速度的影响中的操作。正式实验开始之前需要预先评估实验鱼的绝对临界游泳速度(Ue),操作方法为先将鱼用容器转移至泳道中,在低流速(5 cm/s)下适应15min,随后每2min增加0.4 BL/s (BL=Body length=体长)的速度,直至鱼力竭。表现为无游泳状态,贴在后方钢丝网上持续超过20s,此时的流速即为Ue,从而确定正式实验时绝对临界游泳速度实际值的增量ΔU(15%Ue)。
正式实验时,同样将鱼先在低流速(5 cm/s)下适应15min,随后每5min增加0.5 BL/s至60%Ue,之后每15min增加15%Ue,直至鱼疲劳力竭,贴在后方钢丝网上持续超过20s。此时的流速即为设定时间段的最大游泳速度(Umax)。
计算公式如下:
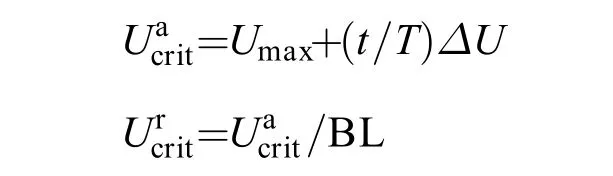
1.6 应激水平测定方法
为探究抄网追赶训练对大黄鱼幼鱼应激水平的影响,同时探究停训后大黄鱼幼鱼再次面对追赶胁迫时的应激水平,本实验采用南京建成生物研究所生产的试剂盒对大黄鱼幼鱼血浆中皮质醇水平进行测定。测定原理是酶联免疫吸附法(ELISA),按照试剂盒的说明书进行操作,在酶标仪450 nm波长下测定各孔的吸光度。根据浓度和吸光度算出标准曲线的回归方程,使用ELISA Calc软件选用logistic 四参数进行曲线拟合,然后代入标准曲线计算皮质醇浓度。
1.7 数据处理
为了避免观察者不同所导致的系统误差,本实验行为学数据均由同一人进行采集和分析[37]。所有实验数据均使用IBM SPSS Statistics 26和JASP16.1软件进行统计分析。数据先使用Shapiro-Wilk法进行正态性检验,如果不符合正态分布,使用blom法进行转换,之后使用单因素方差分析(Analysis of Variance,ANOVA)进行检验,如果ANOVA结果显著,将用Tukey(T)法进行多重比较。为了弥补显著性检验的不足,对效应量(η2)和贝叶斯因子(BF10)也进行了分析。低、中和高效应对应的η2分别为0.010、0.059和0.138,评价标准为小效应(0.010≤η2<0.059)、中等效应(0.059≤η2<0.138)和大效应(η2≥0.138)[38]。使用JASP16.1软件进行贝叶斯统计分析,贝叶斯因子(BF10)决策标准参考Jefferys(1961)[39]。由于样本量较少,回避测试结果采用Fisher’s exact test进行分析。本研究的零假设(H0)为抄网刺激对大黄鱼幼鱼的各项指标无显著影响,对应的备择假设(H1)为有显著影响。
2 结果
2.1 模拟捕食者风险对大黄鱼幼鱼生长的影响
实验开始时及处理15d和30d后实验鱼的体长和体重结果见表 1,数据均符合正态分布和方差齐性。结果表明不同强度抄网刺激未对体长及体重造成显著影响(P>0.05;表 2)。每天记录各处理是否有死亡,实验结束后比较各组鱼的死亡率,结果表明各组死亡率之间无显著差异(P>0.05),各处理组鱼的生长发育及健康状况良好。显著性检验接受H0;效应量表明15d刺激效应较弱,贝叶斯因子以中等程度的证据支持H0;效应量表明30d的刺激效应中等,贝叶斯因子表明支持H0的证据较弱。
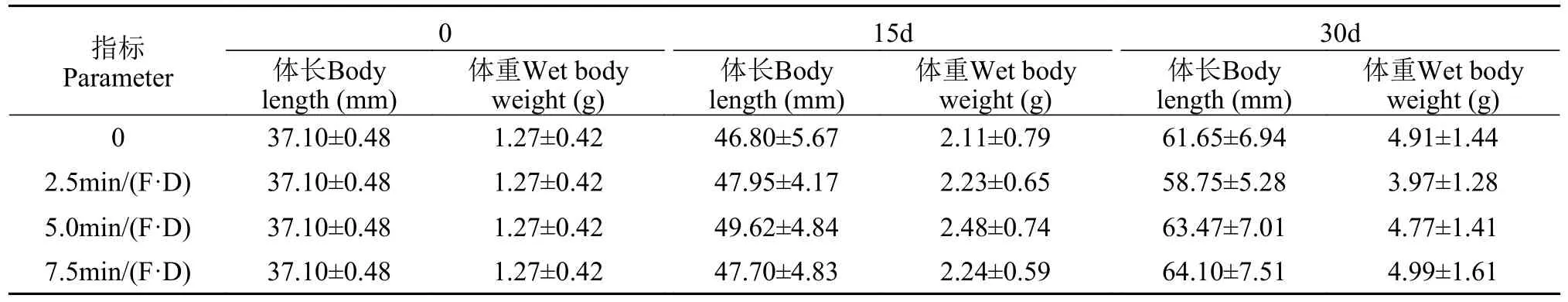
表1 模拟捕食者风险对大黄鱼幼鱼生长的影响(平均值±标准差)Tab.1 Body length and wet body weight of the large yellow croaker at different treatments (mean±SD)
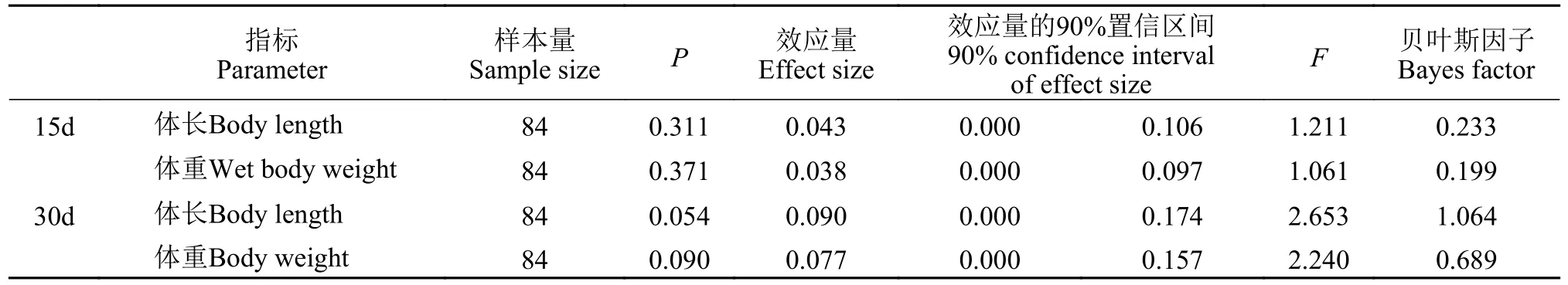
表2 生长相关数据分析结果Tab.2 Growth-related data analysis results
2.2 模拟捕食者风险对大黄鱼幼鱼行为的影响
新环境测试结果列于表 3。刺激15d后(图 5A和5B),各刺激水平下的大黄鱼幼鱼在变换区域次数(A)、进入边区域的次数(B)、进入角区域的次数(C)、出适应区的次数(D)、在边区域待的时间(E)均无显著差异(P值均大于0.05;具体见表 3)。角区域待的时间(F),显著性检验(P=0.008)接受H1,多重比较结果显示:5.0min/(F·D)组显著(P<0.05)高于7.5min/(F·D)组,其他各组之间差异不显著(P>0.05);贝叶斯因子(BF10=6.451)以中等程度的证据支持H1;效应量(η2=0.276)表明不同刺激强度对大黄鱼幼鱼在角区域所待时间的影响较大。在角区域单次持续的最长时间(G),显著性检验(P>0.05)接受H0,但效应量(η2=0.168)较大,贝叶斯因子(BF10=1.067)以较弱的证据支持H1。
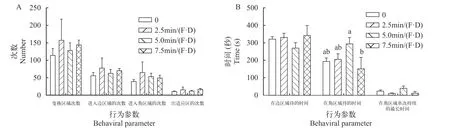
图5 第15天新环境测试行为参数Fig.5 The behavioral parameters of the large yellow croaker in the novel environment test after15-day chase treatment
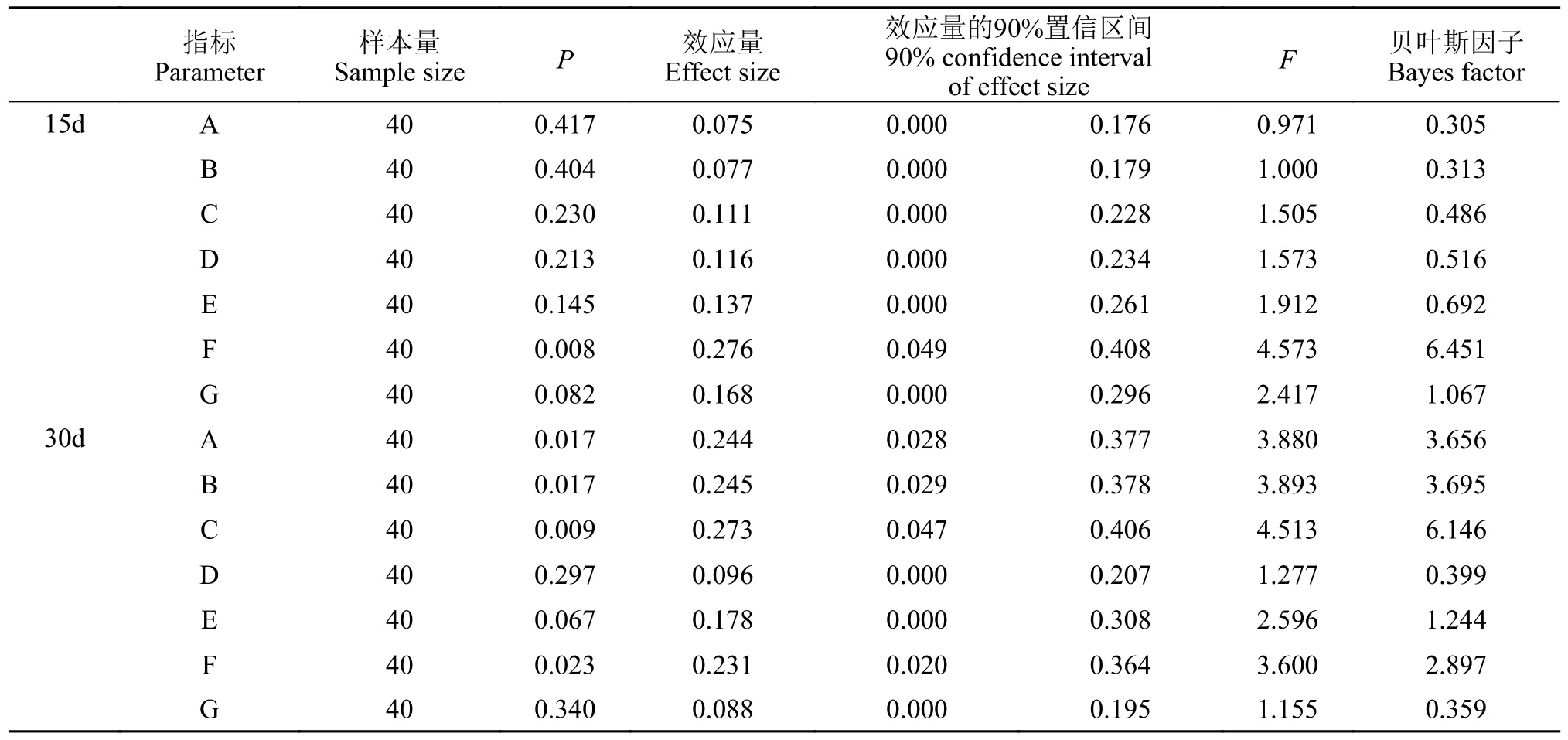
表3 新环境测试相关数据分析结果Tab.3 Novel environment test related data analysis results
刺激30d后(图 6A和6B),关于变换区域的次数(A),显著性检验(P=0.017)接受H1,多重比较结果显示:7.5min/(F·D)组显著(P<0.05)高于2.5min/(F·D)组;贝叶斯因子(BF10=3.656)以中等程度的证据支持H1;效应量(η2=0.244)表明不同刺激水平对大黄鱼幼鱼变换区域次数的影响较大。进入边区域的次数(B),显著性检验(P=0.017)接受H1,多重比较结果显示:7.5min/(F·D)组显著(P<0.05)高于2.5min/(F·D)组;贝叶斯因子(BF10=3.695)以中等程度的证据支持H1;效应量(η2=0.245)表明不同刺激水平对大黄鱼幼鱼进入边区域次数的影响较大。进入角区域的次数(C),显著性检验(P=0.009)接受H1,多重比较结果显示7.5min/(F·D)组显著(P<0.05)高于2.5min/(F·D)组;贝叶斯因子(BF10=6.146)以中等程度的证据支持H1;效应量(η2=0.273)表明不同刺激水平对大黄鱼幼鱼进入角区域的次数影响较大。在角区域待的时间(F),显著性检验(P=0.023)接受H1,多重比较结果显示:7.5min/(F·D)组显著(P<0.05)高于2.5min/(F·D)组;贝叶斯因子(BF10=2.897)以较弱的证据支持H1;效应量(η2=0.231)表明不同刺激水平对大黄鱼幼鱼在角区域待的时间影响较大。另外,出适应区的次数(D),在角区域单次持续的最长时间(G),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.399、0.359)以较弱的证据支持H0,效应量(η2=0.096、0.088)中等。在边区域待的时间(E),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=1.244)以较弱的证据支持H1;效应量(η2=0.178)表明不同刺激水平对大黄鱼幼鱼在边区域待的时间影响较大。
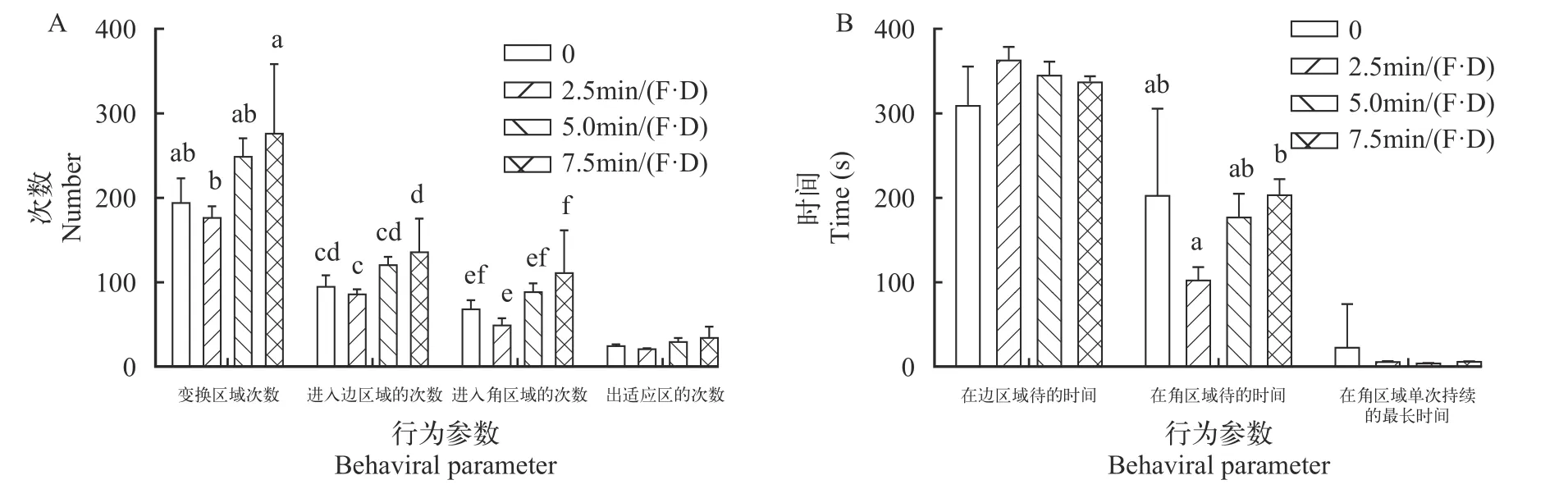
图6 第30天新环境测试行为参数Fig.6 The behavioral parameters of the large yellow croaker in the novel environment test after 30-day chase treatment
恢复性测试结果列于表 4。刺激15d后(图 7A),各个刺激水平下的大黄鱼幼鱼首次出适应区的时间(A),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=4.114)以较弱的证据支持H0;效应量(η2=0.250)表明不同刺激水平对大黄鱼幼鱼首次出适应区的时间影响较大。在适应区外待的时间(B),显著性检验P>0.05)接受H0;贝叶斯因子(BF10=0.295)以中等程度的证据支持H0;效应量(η2=0.070)表明不同刺激水平对大黄鱼幼鱼在适应区外待的时间影响中等。首次回适应区的时间(C),显著性检验(P=0.015)接受H1,多重比较的结果显示5.0min/(F·D)组,首次回适应区的时间显著(P<0.05)长于对照组;贝叶斯因子(BF10=4.114)以中等程度的证据支持H1;效应量(η2=0.147)表明不同刺激水平对大黄鱼幼鱼首次回适应区的时间影响较大。
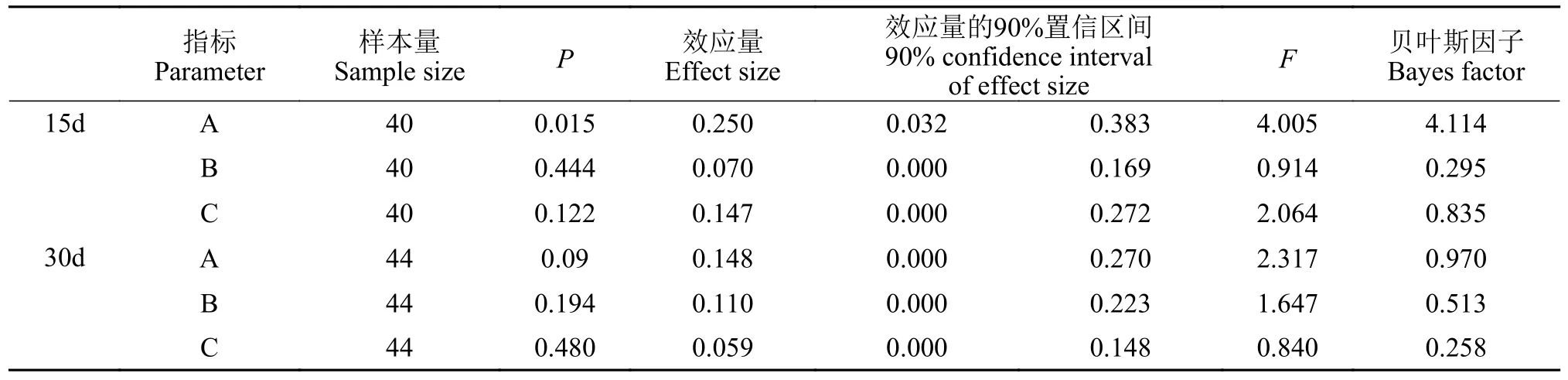
表4 恢复性测试相关数据分析结果Tab.4 Emergence test related data analysis results
追赶刺激30d后(图 7B),首次回适应区的时间(A)显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.970)以非常弱的证据支持H0;效应量(η2=0.148)表明不同刺激水平对大黄鱼幼鱼首次出适应区的时间影响较大。在适应区外待的时间(B),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.513)以较弱的证据支持H0;效应量(η2=0.110)表明不同刺激水平对大黄鱼幼鱼在适应区外待的时间影响中等。首次出适应区的时间(C),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.258)以中等程度的证据支持H0;效应量(η2=0.059)表明不同刺激水平对大黄鱼幼鱼首次出适应区的时间影响中等。
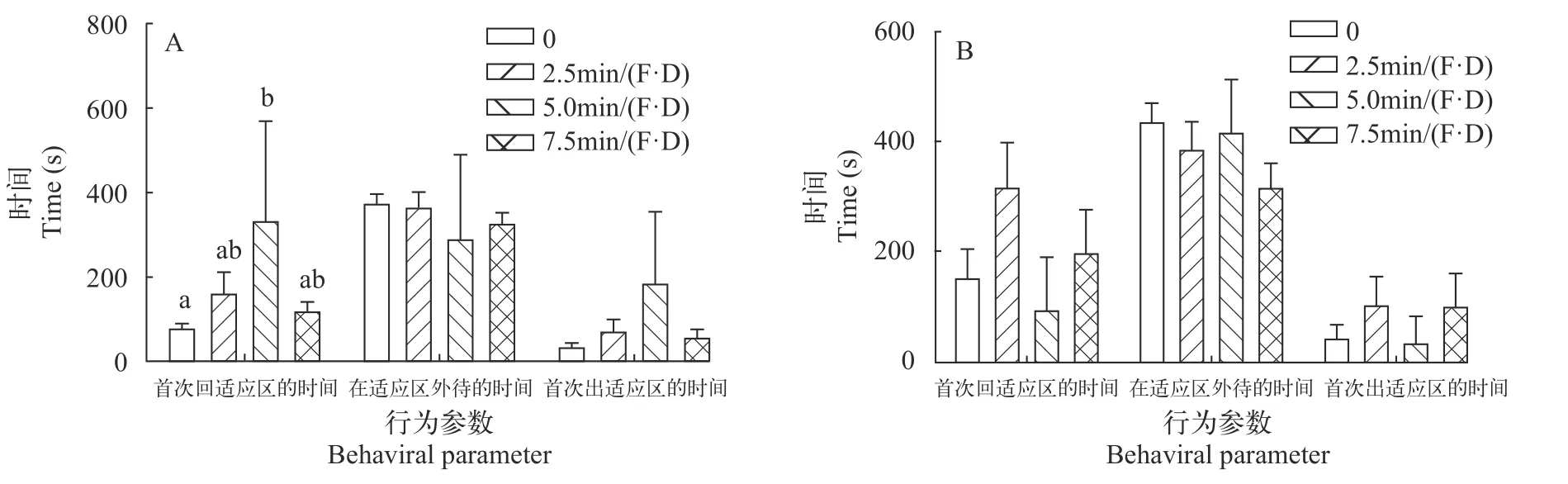
图7 刺激15d(A)和30d(B)恢复性测试行为参数Fig.7 The behavioral parameters of the large yellow croaker in the emergence test after 15-day (A) and 30-day (B) chase treatment
压力应对方式测试结果列于表 5。刺激15d后(图 8),各个刺激强度下的大黄鱼幼鱼在压力后的恢复时间上不存在显著差异,显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.224)以中等程度的证据支持H0;效应量(η2=0.049)较小,表明不同刺激水平对大黄鱼幼鱼压力后恢复时间影响不大。刺激30d后(图 8),各个刺激水平下的压力后恢复时间显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.378)以较弱的证据支持H0;效应量(η2=0.098)表明不同刺激水平对大黄鱼幼鱼压力后恢复时间影响中等。

图8 刺激压力应对方式测试行为参数Fig.8 The behavioral parameters of the large yellow croaker in the emergence test after chase treatment
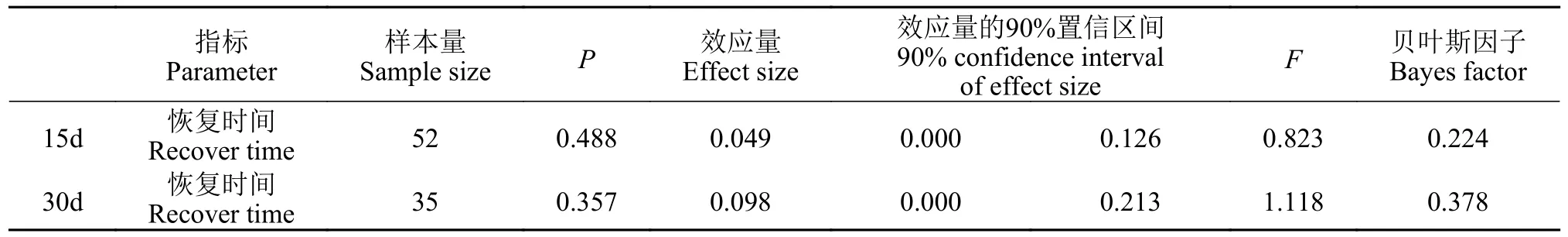
表5 压力应对方式相关数据分析结果Tab.5 Stress coping style test related data analysis results
回避测试结果表明,刺激15d和30d,各个刺激水平下的大黄鱼幼鱼回避率的统计学差异不显著(P>0.05;图 9)。

图9 刺激回避测试行为参数Fig.9 The behavioral parameters of the large yellow croaker in the avoidance test after chase treatment
2.3 模拟捕食者风险对大黄鱼幼鱼游泳能力的影响
随机选取各处理组样本进行游泳能力测试,数据分析结果列于表 6。刺激15d后,关于Ucrita(图 10),显著性检验(P=0.007)接受H1,多重比较结果显示:5.0和7.5min/(F·D)组的Ucrita显著低于(P<0.05)处理组及2.5min/(F·D)组,其他各组之间差异不显著(P>0.05);贝叶斯因子(BF10=8.083)以中等程度的证据支持 H1;效应量(η2=0.651)表明不同刺激水平对大黄鱼幼鱼Ucrita的影响很大。各组的Ucritr(图 10)显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=1.057)以较弱的证据支持H1;效应量(η2=0.377)表明不同刺激水平对大黄鱼幼鱼Ucritr的影响较大。
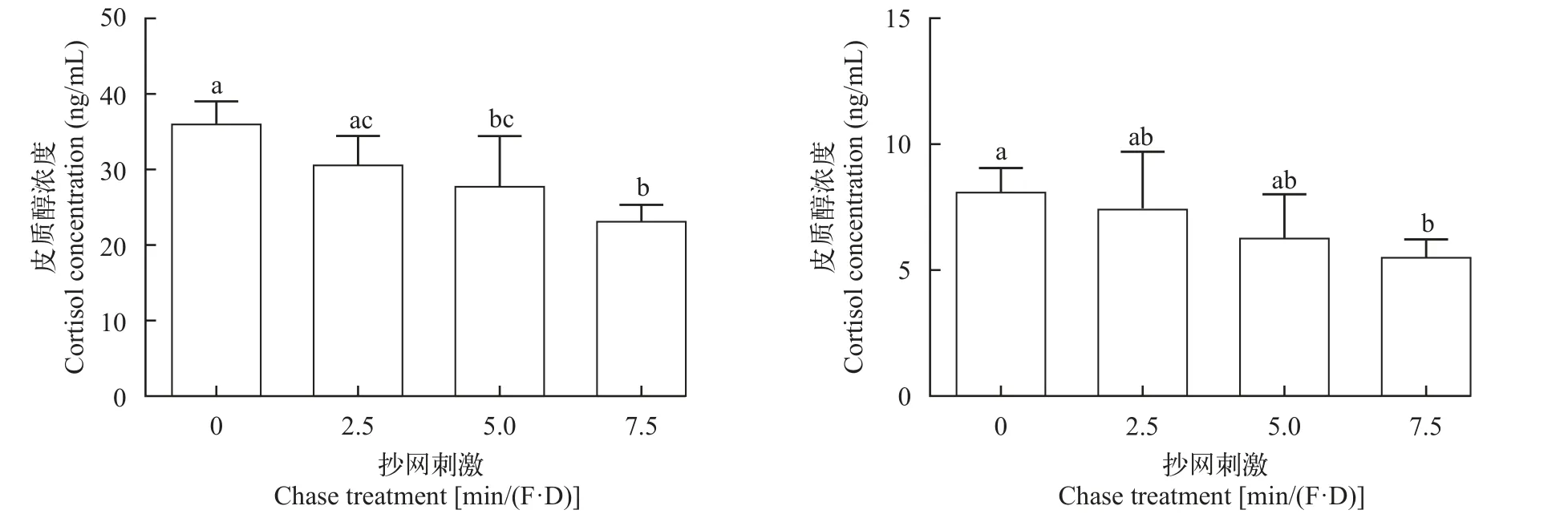
图10 刺激15d后所测得的绝对和相对临界游泳速度Fig.10 The absolute and relative critical swimming speed of the large yellow croaker after 15-day chase treatment
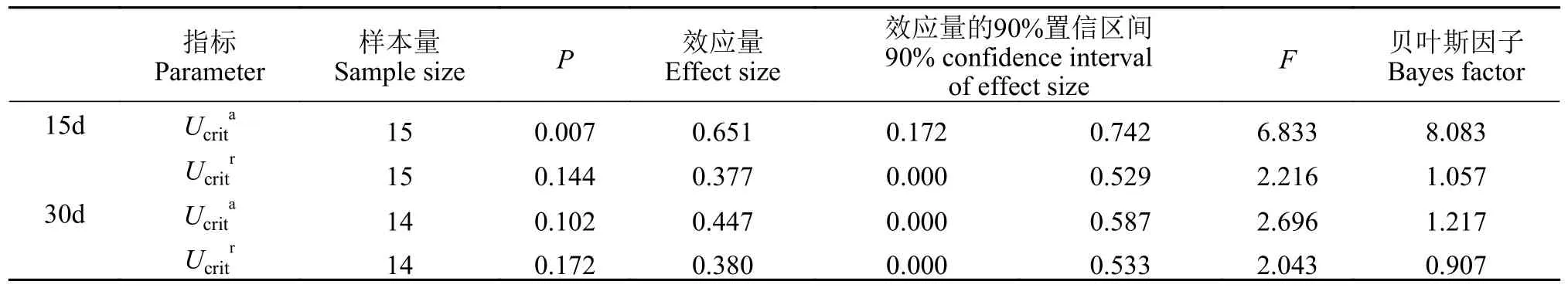
表6 游泳能力相关数据分析结果Tab.6 Swimming ability related data analysis results
刺激30 d后,不同刺激水平下的Ucrita差异不显著(图 11),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=1.217)以较弱的证据支持H1;效应量(η2=0.447)表明不同刺激水平对大黄鱼幼鱼Ucrita的影响较大。不同刺激水平下的Ucritr(图 11),显著性检验(P>0.05)接受H0;贝叶斯因子(BF10=0.907)以较弱的证据支持H0;效应量(η2=0.380)表明不同刺激水平对大黄鱼幼鱼Ucritr的影响较大。
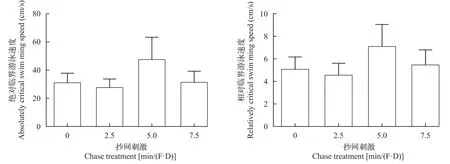
图11 刺激30d后所测得的绝对和相对临界游泳速度Fig.11 The absolute and relative critical swimming speed of the large yellow croaker after 30-day chase treatment
2.4 模拟捕食者风险对大黄鱼幼鱼应激水平的影响
皮质醇数据分析结果列于表 7。刺激15d后(图 12),皮质醇水平显著性检验(P=0.049)接受H1,多重比较结果显示:7.5min/(F·D)组的大黄鱼幼鱼皮质醇浓度显著(P<0.05)低于其他组;贝叶斯因子(BF10=2.101)以较弱的证据支持H1;效应量(η2=0.606)表明不同刺激水平对大黄鱼幼鱼皮质醇水平的影响很大。
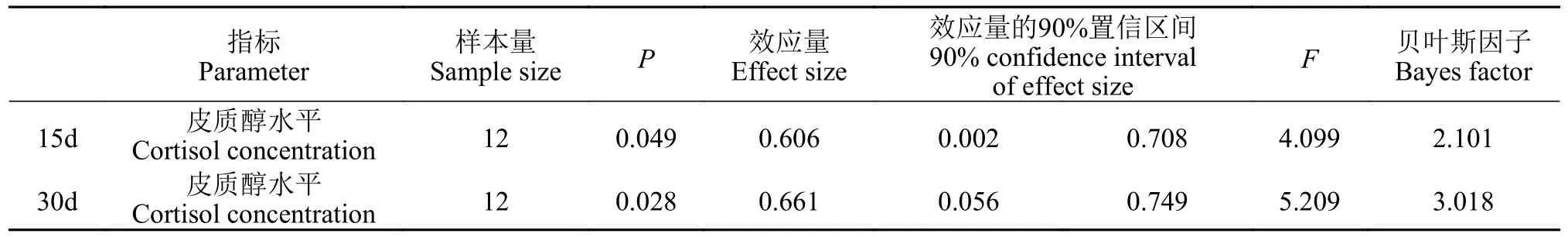
表7 皮质醇水平数据分析结果Tab.7 Cortisol concentration data analysis results
刺激30d后(图 12),皮质醇水平显著性检验(P=0.028)接受H1,多重比较结果显示:2.5min/(F·D)组的皮质醇水平显著(P<0.05)低于其他组;贝叶斯因子(BF10=3.018)以中等程度的证据支持H1;效应量(η2=0.661)表明不同刺激水平对大黄鱼幼鱼皮质醇水平的影响很大。
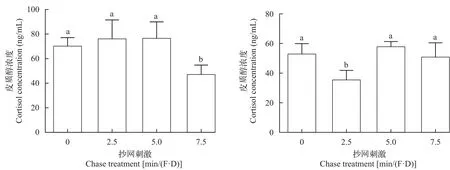
图12 刺激15d和30d后各组皮质醇浓度Fig.12 The cortisol concentration of the large yellow croaker after15-day and 30-day chase treatment
2.5 早期模拟捕食者风险对大黄鱼幼鱼后期应激水平的影响
停止刺激后第8天,再次给予刺激,皮质醇水平分析结果列于表 8。显著性检验接受H1(P=0.0004),多重比较结果显示各处理组皮质醇水平均显著低于对照组(图 13),除5.0和7.5min/(F·D)组之间差异不显著外,其余各组之间均存在显著差异;贝叶斯因子(BF10=59.843)以非常强的证据支持H1;效应量(η2=0.968)表明不同刺激水平对大黄鱼幼鱼二次应激反应的影响非常大。
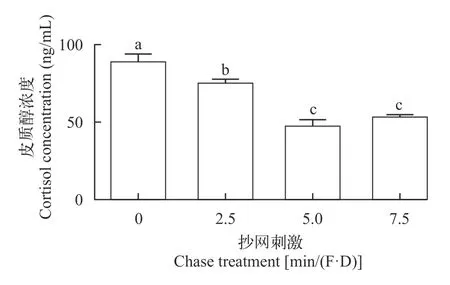
图13 再次刺激后皮质醇浓度Fig.13 The cortisol concentration of the large yellow croaker stimulated again at a 7-day interval after terminating the 30-day stimulation
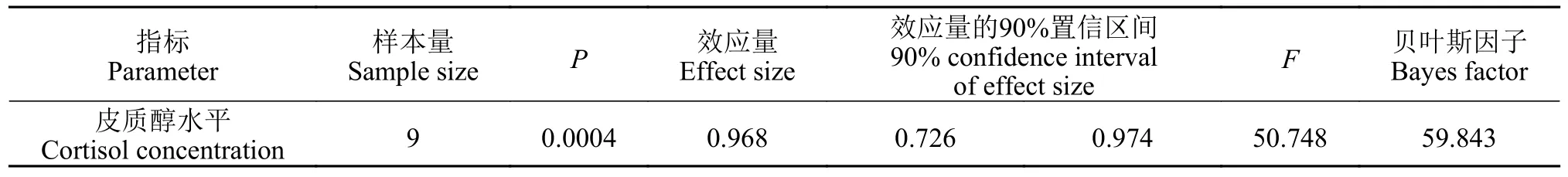
表8 二次刺激后皮质醇数据分析结果Tab.8 The cortisol concentration data analysis results of second stimulation
3 讨论
抄网追赶能够模拟捕食者风险,常用于增殖放流野化训练。大黄鱼是我国增殖放流的重要目标物种[1],现如今并未取得可观成效,主要原因可能是人工养殖的放流苗种在一些行为特征及运动能力上存在缺陷,使其成活率较低[26—28]。本实验通过不同水平抄网追赶模拟捕食者风险发现,大黄鱼幼鱼行为、游泳能力及应激反应均受到一定的影响。特别是停训后第8天再次接受刺激时,大黄鱼幼鱼的应激水平显著提高,为后续探究大黄鱼的行为以及放流前的驯化奠定了行为学研究的基础。
3.1 抄网追赶模拟捕食者风险对大黄鱼幼鱼生长的影响
有研究表明,养殖期间的一些胁迫会使鱼类产生应激反应,进而影响生长。例如,付成等[40]研究发现短期捕食胁迫会降低鲤(Cyprinus carpio)幼鱼的生长率;翁朝红等[41]研究发现操作胁迫会抑制大黄鱼幼鱼的生长。本研究发现(表 1),虽然显著性检验显示15d的抄网追赶训练未对大黄鱼幼鱼的体重及体长产生显著负面影响,但贝叶斯因子和效应量都显示30d刺激训练的影响已不容忽视。本研究的结果不甚显著,可能是刺激强度不够所致,也或者处于温和应激状态下的鱼,经历一段时间追赶刺激后,自身能够对外源刺激做出适应性调整[17]。虽然总体影响不显著,但有意思的是2.5min/(F·D)组的鱼生长最慢,7.5min/(F·D)组的鱼生长最快,这是否意味着大黄鱼对应激的适应力强,值得进一步研究。
3.2 抄网追赶模拟捕食者风险对大黄鱼幼鱼行为的影响
在自然环境中,鱼类经常面临着被捕食的风险,尤其是在幼鱼阶段,捕食胁迫常常会导致鱼类的大量死亡[42]。同样,捕食胁迫也是放流鱼进入野外环境后所面临的主要生存威胁之一,在众多影响放流鱼存活率的因素中,摄食-反捕食能力不足被认为是直接导致死亡率高的重要因素[27,44]。Brown等[13]指出持续的抄网追赶训练能够提高来自高捕食或者低捕食压力地区埃氏短棒鳉(Brachyrhaphis episcopi)后代的大胆性。Moscicki 等[45]也证明了网追赶处理能够增强黑带娇丽鱼(Amatitlania nigrofasciata)的大胆性,并诱导提高鱼的应激恢复能力。
经历了15d的追赶训练后(图 5),变换区域次数(A)、进入边区域的次数(B)、进入角区域的次数(C)、出适应区的次数(D)、在边区域待的时间(E)的数据分析结果支持H0,在角区域待的时间(F)接受H1;在角区域单次持续的最长时间(G),显著性检验接受H0,但效应量较大,从效应量角度考虑,抄网追赶训练能够在一定程度上影响大黄鱼幼鱼在角区域待的时间,整体水平上,5min/(F.D)组在角区域待的时间最长。综合分析,抄网追赶训练并没有对大黄鱼幼鱼对陌生环境探索性产生较大影响。追赶刺激30d(图 6)后的结果,可看出一定强度的刺激训练可以降低大黄鱼的冒险性。7.5min/(F·D)组的大黄鱼幼鱼在变换区域的次数、进入边区域的次数、进入角区域的次数都要显著高于2.5min/(F·D)。
恢复性测试中,追赶训练15d后(图 7A),显著性检验及效应量均以较强的证据支持抄网追赶模拟捕食者风险会对大黄鱼幼鱼首次回适应区的时间产生显著消极影响的结论。显著性检验显示首次出适应区的时间接受H0,但效应量较大,从效应量的角度分析,抄网追赶模拟捕食者风险会对大黄鱼幼鱼首次出适应区的时间产生较大影响。追赶训练30d后(图 7B),各刺激强度间无显著差异,可能与鱼已适应了刺激有关。该实验结果也从另一方面佐证了经过抄网刺激训练后的大黄鱼更加谨慎。
压力应对测试中,追赶训练15d或30d后(图 8),不管是显著性检验,还是效应量和贝叶斯因子,都显示各组之间的压力耐受水平无显著差异,唯一异常点是30d刺激后,5.0min/(F·D)组的压力耐受水平(和恢复时间成反比)反而降低了(图 8),可能是个体差异所致,30d刺激后的数据的标准差明显高。鱼对压力的耐受水平应该和受刺激鱼运动强度对鱼的呼吸(Excess post exercise oxygen consumption,EPOC,过量耗氧)能力影响有关。例如,力竭追赶训练对岩原鲤(Procypris rabaudi)幼鱼的 EPOC无显著性影响,但却显著提高了中华倒刺鲃(Spinibar-bus sinensis)幼鱼的EPOC和运动后恢复时间[45];持续4周的有氧运动训练使虹鳟(Oncorhynchus mykiss)的心脏搏动能力和心输出量显著提高[46];以1.5 BL/s的速度训练8个月,能使大鳞大马哈鱼(Oncorhynchus tshawytscha)的静止耗氧率提高50%[47]。本研究在刺激30d后,除了5.0min/(F·D)组略高于对照组外,2.5组和7.5min/(F·D)组的刺激后恢复时间均要低于对照组,这说明随着追赶训练的持续,大黄鱼幼鱼的有氧呼吸能力得到了锻炼,进而提高了其低氧耐受水平。回避性测试中,不管是15d还是30d (图 9)的追赶训练,都对其回避率无显著影响,说明该训练方式可能对大黄鱼幼鱼回避危险的能力影响不大。
3.3 抄网追赶模拟捕食者风险对大黄鱼幼鱼游泳速度的影响
游泳能力关乎鱼类的生存、避敌、捕食、栖息地的选择等[48—51]。因此,鱼类的游泳能力决定着其对自然环境的适应能力[50—53]。研究表明,追赶训练能够在一定程度上塑造鱼类的游泳能力,而临界游泳速度(Critical swimming speed,Ucrit)是评定鱼类游泳能力强弱极为重要的指标[36,53]。
本研究中,刺激15d后(图 10),显著性检验和效应量都以较强的证据支持H1,5.0和7.5min/(F·D)组大黄鱼幼鱼的Ucrita显著低于对照组,2.5min/(F·D)组显著高于7.5min/(F·D),虽然显著性检验显示各组的Ucritr不存在显著差异,但效应量较大,从效应量的角度来讲,抄网追赶模拟捕食者风险会对大黄鱼幼鱼的Ucritr产生较大影响。另外,Ucrita和Ucritr与刺激强度呈负相关性,这说明随着刺激强度的增大,大黄鱼幼鱼的Ucrit反而降低了,这与周龙艳等[54]对胭脂鱼进行的追赶训练得到的游泳速度结果一致。可能是大黄鱼生性敏感,应激反应强烈,从而导致应激反应所产生的负面影响抵消了追赶训练对Ucrit的正面效应。
刺激30d后(图 11),P表明各组的Ucrita和Ucritr均无显著差异,但从效应量角度来讲,抄网追赶模拟捕食者风险会对大黄鱼幼鱼的Ucrita和Ucritr产生较大影响。趋势上,除了2.5min/(F·D)组的Ucrita和Ucritr略低于对照组外,5.0和7.5min/(F·D)组的均高于对照组,并且5.0min/(F·D)组的Ucrita和Ucritr分别要比对照组高约52%和39%,7.5min/(F·D)组的Ucrita和Ucritr分别要比对照组高约13%和20%。类似的训练结果在前人的研究中已有出现,Farrel等[55]对虹鳟(Oncorhynchus mykiss)进行了为期28—52d的运动训练,发现经过运动训练的鱼游泳速度要比那些没有经过训练的鱼快12%。Li 等[56]以濒危鱼类厚颌鲂(Megalobrama pellegrini)为研究对象,每天进行一次为期5min的抄网追赶训练,持续5周,最终的游泳测试结果表明虽然力竭性追赶训练组和对照组鱼的游泳速度不存在显著差异,但力竭训练组的Ucrit值要比对照组高5%。本实验中,在进行15d的追赶训练后,训练组的Ucrit低于对照组,而在30d后,和对照组相比,Ucrit得到了不同程度的改善,说明15d的训练时间还没有达到提高大黄鱼幼鱼Ucrit的程度。追赶训练效果也因种而已,例如Liu等[57]对瓦氏黄颡鱼(Pelteobagrus vachelli)仅进行了为期14d的追赶训练,训练组鱼的Ucrit就显著高于对照组。这说明不同鱼的游泳能力可塑性也不同,要依具体的研究对象确定训练时间。
3.4 抄网追赶模拟捕食者风险对大黄鱼幼鱼应激水平的影响
在环境胁迫导致的应激状态下,鱼体血液指标会发生一系列变化,其中血液皮质醇水平的升高是鱼类应激反应的主要特征,通常用来评估应激反应的强度[58,18]。过多的皮质醇会造成生长停止,肌肉消退及脂肪合成减少,机体消瘦[60]。有研究表明,动物幼体长期暴露在高捕食压力下通常会导致更加积极的应对方式,表现为皮质醇水平的降低。Fischer 等[61]分别比较了来自高捕食压力和低捕食压力地区孔雀鱼(Poecilia reticulata)的皮质醇含量,表明高捕食压力地区的孔雀鱼皮质醇含量显著低于低捕食压力地区。但也有研究发现了相反的结果,例如Hope等[9]对黑带娇丽鱼(A.nigrofasciata)的追赶刺激实验中发现刺激组皮质醇水平要显著高于非处理组。在本研究中,刺激15d后(图 12),显著性检验以及效应量都以较强的证据支持H1,多重比较结果显示7.5min/(F·D)组的大黄鱼幼鱼皮质醇水平显著低于对照组及其他处理组,2.5和5.0min/(F·D)组和对照组无显著差异。刺激30d后(图 12),显著性检验以及效应量也都以较强的证据支持H1,多重比较结果显示2.5min/(F·D)组的大黄鱼幼鱼皮质醇水平显著低于对照组及其他处理组,5.0和7.5min/(F·D)组和对照组无显著差异。这说明在短期内,大黄鱼幼鱼对较强刺激适应能力强,而一旦适应后,长期的低水平刺激反而有利于降低皮质醇水平。出现这种现象的原因可能是在短期内,较高水平的刺激实际上是增加了大黄鱼幼鱼的训练时间,从而更早达到降低其应激水平的目的。而刺激30d后,较低水平的刺激也达到了能够降低其应激水平的目的,但较高水平的刺激可能略微超过了实验鱼的承受范围,反而使其皮质醇水平又恢复到了和对照组相近的水平,此现象有待未来进一步研究。
3.5 早期抄网追赶模拟捕食者风险对大黄鱼幼鱼后期应激水平的影响
目前经济水生生物的放流方式主要有海面直接放流和船载滑道放流。由于放流个体的游泳能力及规避风险能力较差,在放流过程中受到水面冲击、水流及捕食者等因素的影响[61],及放流过程中的运输、碰撞等物理刺激和进入一个完全陌生的环境中的不适应性[62,63]会使放流鱼产生一定的应激反应,这种应激反应进而会影响放流鱼的存活率,降低增殖放流的效果。在本实验中,当30d刺激结束后的第8天对大黄鱼幼鱼进行再次刺激时(图 13),显著性检验、效应量以及贝叶斯因子都以极强的证据支持H1,这说明网追赶个体对压力具有较高的容忍度,对于提高放流大黄鱼的适应性来说具有十分重要的意义。Takahashi 等[17]以真鲷(Pagrus major)幼鱼为研究对象探究了抄网追赶对其摄食行为的影响。结果表明,投喂饲料90min后,来自抄网追赶组的真鲷幼鱼摄取饲料的数量更多,进行摄食的鱼的数量也更多,这说明每天受到轻微压力胁迫的鱼类对环境变化引起的压力更具有抵抗力。此外,Archard等[64]也揭示了轻微的压力胁迫(转移到新环境)后暴露在高捕食者压力的埃氏短棒鳉(B.episcopi)要比来自低捕食者压力的鱼应激激素(皮质醇)的释放率低,和本研究的结果一致。说明用来模拟捕食者风险的抄网追赶训练能够降低大黄鱼幼鱼再次面对风险时的应激水平,这对于其快速适应放流后的自然环境来说具有重要意义。
综上所述,本研究进一步证明了模拟捕食者风险训练能够在一定程度上提高大黄鱼幼鱼对陌生环境的适应能力,同时在改善个体的游泳能力方面也发挥了一定的作用。此外,这种训练方式能够显著降低个体再次面对压力时的应激水平,对于提高增殖放流个体的适应性来说具有极为重要的意义。
