大黄素调控NLRP3/Caspase-1信号通路对实验性自身免疫性甲状腺炎大鼠的免疫调节作用*
2022-07-08南晓晶杨舒炜
南晓晶, 杨舒炜
浙江中医药大学附属第三医院 1检验科, 2内分泌科(浙江杭州 310009)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是器官特异性自身免疫疾病,在临床上较为常见,临床主要表现为咽部不适、吞咽困难、颈部压缩等症状,且甲状腺淋巴细胞的浸润程度不同可导致甲状腺功能丧失与萎缩,且该病的发病率受多种因素的影响逐年增加,故寻找该病有效的治疗方式相当重要[1-2]。实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)的动物模型病理基础与临床表现与人类AIT相同,主要用于AIT研究[3-4]。大黄素为蒽醌类衍生物,是中药大黄茎与干燥根中的有效成分,具有免疫抑制的作用。含有pyrin结构域的蛋白3(NLRP3)/半胱氨酸天冬氨酸蛋白酶1(Caspase-1)在疾病的发生中具有重要作用,NLRP3/Caspase-1可通过破坏环境刺激物、晶体物质与病原微生物所激活,参与AIT的发病机制与机体免疫,有研究显示,NLRP3通路的激活与AIT相关。基于上述背景,积极寻找此病的发生机制对临床上治疗的研究具有重要的意义。2020年6—12月,本研究分析大黄素调控NLRP3/Caspase-1通路对EAT大鼠的免疫调节作用,以明确大黄素与EAT大鼠的关系,为临床上AIT的诊治提供参考。
1 材料与方法
1.1 材料 选取SPF级6~8周龄SD大鼠60只,购自长沙市天勤生物技术有限公司,动物许可证号:SCXK(湘)2019-0014,体重(221.05±22.61)g,在相对湿度为29%~35%、温度为21~24℃下饲养1周,每天光照24 h,明暗周期为12 h。本实验操作均严格参照动物实验伦理要求相关规定进行,且获得我院医学伦理委员会审批同意(ZSLL-KY-2021-036-01)。
1.2 方法
1.2.1 分组与建模 60只中选取12只作为对照组,其余48只大鼠参照侯丽萍等[6]报道的EAT的建立方法构建模型,将10 mg pTG(美国Sigma公司)与5 mL PBS进行融合,并与5 mL CFA(美国Sigma公司)进行混合,乳化后制作抗原含量为1 g/L的pTG乳化剂,将乳化剂按照1 mL/kg体重注射于对48只大鼠足垫及背部皮下,每周注射1次,连续注射2周,此为初次免疫,2周后为加强免疫,将pTG与IFA(美国Sigma公司)混合、乳化制成乳化剂备用,按照1 mL/kg体重注射于大鼠皮下多点,每周注射1次,连续注射4周,大鼠造模期间注意避光,饮用0.05%碘化钾水。加强免疫后2周,取1只建模大鼠的眶静脉血,检测TPOAb水平,TPOAb滴度≥60 IU/mL为建模成功,建模成功后大鼠死亡8只,将剩余40只大鼠随机分为模型组、大黄素低剂量组、大黄素中剂量组、大黄素高剂量组各10只。
1.2.2 给药干预 建模成功后,开始给药。对照组模型组与给予5 mg/kg生理盐水进行灌胃,大黄素低剂量组给予生理盐水+15 mg/kg大黄素,大黄素中剂量组给予生理盐水+75 mg/kg大黄素,大黄素高剂量组给予生理盐水+150 mg/kg大黄素。连续灌胃4周。
1.3 指标观察
1.3.1 样本采集 采集大鼠眶静脉血4 mL,以离心半径5 cm、3 000 r/min离心处理10 min,分离上层血清,分离大鼠颈部皮肤及肌肉层,显露出甲状腺软骨侧后方两叶甲状腺,取出气管与甲状腺,使用冷生理盐水进行冲洗,并吸干。
1.3.2 病理组织学观察 获取大鼠甲状腺组织进行切片、脱蜡、脱水操作,并使用HE进行染色,使用光学显微镜观察其改变。
1.3.3 甲状腺球蛋白抗体(TgAb)、白细胞介素-4(IL-4)、γ干扰素(IFN-γ)检测 在用药结束后抽取眶静脉血4 mL,以离心半径5 cm、3 000 r/min离心处理10 min,分离上层血清,-80℃保存待检。采用酶联免疫吸附法(ELISA法)检测 TgAb、IL-4、IFN-γ水平,TgAb、IL-4、IFN-γELISA试剂盒由滁州仕诺达生物科技有限公司提供。货号为SND-R423。
1.3.4 外周血CD3+CD4+、CD3+CD8+检测 抽取各组大鼠眶静脉血4 mL,制作单细胞悬液,加入抗体与溶血素反应10 min,以离心半径5 cm、3 000 r/min离心处理10 min,分离上层血清,并加入PBS进行清洗,采用流式细胞仪检测CD3+CD4+、CD3+CD8+变化。
1.3.5 NLRP3/Caspase-1通路蛋白检测 采集大鼠甲状腺细胞,冰上溶解25 min,加入细胞裂解液提取总蛋白,使用BCA试剂盒检测NLRP3、ASC、Caspase-1等蛋白含量,提取等量蛋白质,然后100℃变性5 min,使用凝胶电泳分离,4℃条件下加入一抗孵育过夜,洗涤15 min×3次,加入稀释好的二抗,孵育2 h,洗涤15 min×3次,定量分析蛋白表达情况。以GAPDH作为内参。

2 结果
2.1 组织学观察 对照组甲状腺滤泡大小均匀一致,滤泡细胞呈单层立方形或高柱形。模型组甲状腺滤泡结构紊乱,上皮细胞变扁,间质减少,明显淋巴细胞浸润。大黄素组甲状腺滤泡大小不一,少量淋巴细胞浸润。见图1。

注:A:对照组; B:模型组; C:大黄素低剂量组; D:大黄素中剂量组; E:大黄素高剂量组
2.2 各组TgAb、IL-4、IFN-γ对比 与对照组相比,其他4组TgAb、IL-4、IFN-γ水平较高,差异有统计学意义(P<0.05);与模型组相比,大黄素低、中、高剂量组TgAb、IL-4、IFN-γ水平降低,差异有统计学意义(P<0.05);而大黄素中剂量组TgAb、IL-4、IFN-γ水平低于大黄素低、高剂量组,比较差异有统计学意义(P<0.05)。见表1。

表1 各组TgAb、IL-4、IFN-γ对比
2.3 各组外周血CD3+CD4+、CD3+CD8+对比 与对照组相比,其他4组CD3+CD4+、CD3+CD8+水平较高,差异有统计学意义(P<0.05);与模型组比较,大黄素低、中、高剂量组CD3+CD4+、CD3+CD8+水平降低,差异有统计学意义(P<0.05);而大黄素中剂量组CD3+CD4+、CD3+CD8+水平低于大黄素低、高剂量组,比较差异有统计学意义(P<0.05)。见表2。
2.4 各组NLRP3/Caspase-1信号通路蛋白表达量对比 与对照组相比,其他4组NLRP3、ASC、Caspase-1水平较高,差异有统计学意义(P<0.05);与模型组相比,大黄素低、中、高剂量组NLRP3、ASC、Caspase-1水平降低,差异有统计学意义(P<0.05);大黄素中剂量组NLRP3、ASC、Caspase-1水平低于大黄素低、高剂量组,差异有统计学意义(P<0.05)。见表3、图2。
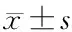
表2 外周血CD3+CD4+、CD3+CD8+对比

表3 各组NLRP3/Caspase-1信号通路蛋白表达量对比

图2 NLRP3/Caspase-1通路蛋白WB图
3 讨论
甲状腺由滤泡上皮细胞组成,为人体内分泌器官,可调节机体平衡与合成甲状腺激素[7-8]。AIT是由机体异常识别自身抗原使淋巴细胞侵入甲状腺组织,使其受损,AIT的发生多受环境与遗传影响,发病机制不明确,临床上AIT的治疗多使用中医药、局部免疫调节及硒,但其毒性、不良反应与复发可抑制AIT的治疗,故临床上寻找治疗此病的药物十分重要[9-10]。
大黄素又称朱砂莲甲素,从大黄根茎中提取[11]。研究显示[12-13],大黄素具有抗炎、抗肿瘤、抗氧化、降血脂与调节免疫的作用,其免疫保护作用通过调节T淋巴细胞之间的平衡发挥作用,大黄素通过抑制树突状细胞的成熟与淋巴结的活化调节免疫抑制。本研究显示,不同剂量大黄素可降低EAT大鼠中的表达水平,表明大黄素对EAT大鼠具有保护作用。
CD4+CD8+细胞为人体重要的免疫细胞,CD4+主要表达于辅助T细胞,是Th细胞TCR识别的抗原共同体,参与Th细胞TCR识别的信号转导[14]。CD8+表达于细胞毒性T细胞,通过表面的MHC Ⅰ类分子与其他免疫细胞MHC Ⅱ类分子相结合,识别其他免疫细胞抗原分子[15]。临床研究显示,机体的免疫保护作用主要通过大黄素调节T淋巴细胞之间的平衡、分化能力发挥,且大黄素可通过调节CD4+/CD8+之间平衡抑制Th1/Th2分化而维持细胞免疫与体液免疫的正常功能,Th1介导细胞免疫主要通过分泌IFN-γ等细胞因子进行[16]。临床研究表明[17-18],IFN-γ为促炎因子,可使B细胞进行分化,诱导其成熟,并促进B细胞记忆,且IFN-γ还可使甲状腺上皮细胞HLA-Ⅱ类抗原表达增强,激活大量单核细胞,使其进入甲状腺内,并使细胞毒性增强。Th2介导体液免疫通过分泌IL-4等抗炎细胞因子进行,可使机体的免疫应答受到抑制,且抗炎因子存在于甲状腺组织浸润的单核细胞中,其EAT免疫病情的进展可使抗炎因子表达降低[19]。本研究显示,EAT大鼠中IFN-γ、IL-4表达升高,大黄素可降低IFN-γ、IL-4在EAT大鼠的表达含量,且中剂量大黄素对IFN-γ、IL-4的降低水平高于低剂量与高剂量大黄素,表明大黄素可保护其EAT大鼠免疫功能,并使Th的细胞因子分泌及分化受到抑制,减轻EAT大鼠的炎症反应。
NLRP3为胞质内的模式识别受体,可与ASC形成炎性小体,使Caspase-1活化,NLRP3通过激活Caspase-1促使IL-1β形成活性细胞因子,此在先天免疫中起到关键作用,NLRP3炎性小体由NLRP3、ASC、Caspase-1组成,在AIT中发挥着重要作用[20]。研究表明[21],免疫细胞通过NLRP3/Caspase-1参加先天免疫应答,且NLRP3在AIM2介导的甲状腺滤泡细胞与AIT相关。在本研究中,NLRP3、ASC、Caspase-1在EAT大鼠中表达升高,对大鼠使用大黄素后NLRP3、ASC、Caspase-1表达降低,且中剂量大黄素对NLRP3、ASC、Caspase-1的降低水平更为显著,表明大黄素可通过调节NLRP3/Caspase-1通路改善EAT。
虽然本研究认为大黄素具有改善EAT的作用,作用机制可能与NLRP3/Caspase-1通路有关,但此仅为本研究初步结果,临床并未有研究分析其关系,因此本研究上述实验结果还需后续研究进一步探讨验证,为EAT的研究提供新的方向。
综上所述,本研究发现,在对EAT大鼠做大黄素干预后,病变明显被抑制,其作用机制可能与大鼠的NLRP3/Caspase-1失活相关。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:南晓晶、杨舒炜:设计研究方案,实施研究过程,论文撰写,提出研究思路,分析试验数据,论文审核;杨舒炜:资料搜集整理,论文修改,进行统计学分析。
