电针诱导沉默信息调节因子1依赖性自噬对小鼠脑卒中后中枢性痛的影响
2022-07-08陆大浩黄天丰王骁颖
陆大浩, 高 巨, 黄天丰, 张 扬, 王骁颖
(扬州大学附属苏北人民医院 麻醉科, 江苏 扬州, 225001)
脑卒中后中枢性痛(CPSP)是脑出血性或缺血性损伤后出现的神经性疼痛综合征[1], 主要表现为脑损伤区域相应躯体部位的持续性或间歇性疼痛。CPSP为脑卒中后常见并发症, 12%~18%的脑卒中患者会发生CPSP[2]。电针是将电学与针灸相结合的一种治疗方法,临床研究[3]发现电针可用于CPSP的治疗,但其机制尚未阐明。自噬是细胞通过溶酶体降解并回收细胞内细胞器或蛋白质的过程,相关研究[4-5]表明,提高自噬水平可改善多种脑卒中后并发症。沉默信息调节因子1(SIRT1)是烟酰胺腺嘌呤二核苷酸(NAD+)依赖的蛋白去乙酰化酶,其活性上调及表达增加可促进脑神经细胞自噬,在多种神经系统疾病中发挥保护作用[6]。本研究通过建立小鼠CPSP模型,探讨电针在CPSP中的作用及其与SIRT1、自噬的关系,以期为CPSP的临床治疗提供参考依据。
1 材料与方法
1.1 实验动物与分组
选取40只无特定病原体(SPF)级健康雄性ICR小鼠作为研究对象, 8周龄,体质量25~30 g, 购自扬州大学比较医学中心,许可证号为SYXK(苏)2017-0044。将小鼠分笼饲养于实验室环境中适应3 d, 随机分为假手术组(Sham组)、CPSP组、CPSP+电针组(EA组)和CPSP+电针+SIRT1抑制剂EX527组(EA+EX527组),每组10只。
1.2 仪器与试剂
华佗牌SDZ-Ⅱ型电针仪(苏州医疗用品厂有限公司),Ⅳ型胶原酶(北京索莱宝生物技术有限公司), von-Frey纤毛(美国Stoelting公司),热辐射测痛仪(美国IITC公司), SIRT1兔单克隆抗体(英国Abcam公司), Beclin-1兔单克隆抗体(英国Abcam公司), p62兔单克隆抗体(英国Abcam公司), GAPDH兔单克隆抗体(美国Santa Cruz公司),山羊抗兔免疫球蛋白G(IgG)二抗(美国Santa Cruz公司)。
1.3 CPSP模型建立
将小鼠分笼饲养于实验室环境中适应3 d, 参照文献[7]方法建立CPSP模型。腹腔注射10%水合氯醛麻醉小鼠并固定于脑立体定位仪上,剪去颅顶毛发,切开头皮暴露矢状缝及前囟。参考小鼠脑立体定位图谱,于小鼠右侧丘脑腹后外侧核(前囟后0.82~2.30 mm, 矢状缝右侧1.30~1.95 mm, 颅骨下3.01~4.25 mm)注射Ⅳ型胶原酶(Ⅳ型胶原酶0.01 U溶于10 nL生理盐水),随后缝合切口并消毒皮肤。Sham组则注入等量无菌生理盐水。
1.4 电针治疗
模型建立完成24 h后,采用固定器将EA组小鼠固定,参照《实验动物穴位图谱》取人中及双侧三阴交、内关穴,针刺深度2 mm, 将针柄与电针仪连接进行电针治疗(疏密波,频率2 Hz/15 Hz, 强度1 mA), 30 min/次, 1次/d, 持续14 d。EA+EX527组小鼠于每日电针治疗前30 min腹腔注射5 mg/kg EX527, 其他操作与EA组相同。CPSP组和Sham组小鼠每日仅固定30 min, 无其他处理。
1.5 疼痛行为学测定
于CPSP模型建立前1 d(T0)和模型建立后3 (T1)、7 (T2)、14 d(T3)分别测定各组小鼠的机械缩足频率(PWF)、热缩足潜伏期(TWL)和冷缩足潜伏期(CWL)。① PWF测定: 选择0.07 g规格的von-Frey纤毛进行实验,测定前将小鼠置入底部为金属网架的透明玻璃罩内适应30 min, 然后使用von-Frey纤毛垂直、缓慢地刺向小鼠左后爪的足底中央部位,每次刺激1~2 s, 相邻刺激时间间隔为10~15 s。若小鼠出现舔足或缩足反应则视为阳性,重复刺激小鼠左后爪10次,阳性反应次数占全部刺激次数的百分比即为PWF。② TWL测定: 采用热辐射测痛仪进行测定。将小鼠置入底部为透明玻璃板的透明玻璃罩内适应30 min, 使用热辐射测痛仪照射小鼠左后爪的足底中央部位,当小鼠出现舔足或缩足反应时立刻停止照射并记录相应时间,重复测定5次,每次间隔5 min, 计算5次时间的平均值即为TWL。③ CWL测定: 采用冷铝板进行测定。将铝板至于冰盒的冰面上,连续测定其温度。当铝板温度测定为0 ℃时,将小鼠置于板上。当小鼠左后足出现舔足或缩足时立刻记录时间,重复测定3次,每次间隔10 min, 计算3次时间的平均值即为CWL。
1.6 脑组织含水量测定
模型建立后第14天完成疼痛行为测试后,每组取5只小鼠,予3%戊巴比妥腹腔注射麻醉,迅速断头并将脑组织取出,去除脑干、小脑、嗅球及脑组织表面的脑膜和血块后,使用滤纸将表面水分吸干。取右侧大脑半球称得湿质量,然后置于80℃烘干箱内烘干72 h后称得干质量。脑组织含水量=(湿质量-干质量)/湿质量×100%。
1.7 蛋白质印迹法(Western blot)检测脑组织中
SIRT1、Beclin-1、p62蛋白表达水平疼痛行为学测试完成后,将每组另外5只小鼠麻醉并断头取出脑组织,取损伤脑组织前后各2 mm范围内的组织块,称重后加入组织裂解液及蛋白酶抑制剂并匀浆,静置于冰面30 min后移入离心管内,于4 ℃下以12 000转/min离心15 min, 离心半径8 cm, 弃沉淀取上清液,采用二喹啉甲酸(BCA)法检测蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将蛋白分离并电泳转移至聚偏二氟乙烯(PVDF)膜上。于室温下用5%脱脂牛奶封闭1.5 h后,用TBST缓冲液洗膜3次, 10 min/次。分别加入SIRT1兔单克隆抗体(1∶1 000)、Beclin-1兔单克隆抗体(1∶1 000)、p62兔单克隆抗体(1∶1 000)、GAPDH兔单克隆抗体(1∶5 000), 4 ℃过夜。用TBST缓冲液洗膜3次, 10 min/次,然后将PVDF膜分别放入相应的山羊抗兔IgG二抗(1∶3 000)室温下孵育2 h, 用TBST缓冲液洗膜3次, 8 min/次。电化学发光法(ECL)显影曝光后,通过Image J图像分析软件计算目标蛋白条带灰度值,并用其与GAPDH蛋白条带灰度值的比值表示目标蛋白的相对表达量。
1.8 统计学分析

2 结 果
2.1 各组小鼠PWF比较
T0时,各组小鼠PWF比较,差异无统计学意义(P>0.05); T1、T2、T3时, CPSP组、EA组和EA+EX527组小鼠PWF均高于Sham组,差异有统计学意义(P<0.05); EA组小鼠T1时PWF与CPSP组比较,差异无统计学意义(P>0.05),T2、T3时PWF低于CPSP组,差异有统计学意义(P<0.05); EA+EX527组小鼠T1时PWF与EA组比较,差异无统计学意义(P>0.05), T2、T3时PWF高于EA组,差异有统计学意义(P<0.05)。见表1。

表1 各组小鼠不同时点机械缩足频率比较 %
2.2 各组小鼠TWL比较
T0时,各组小鼠TWL比较,差异无统计学意义(P>0.05); T1、T2、T3时,CPSP组、EA组和EA+EX527组小鼠TWL均短于Sham组,差异有统计学意义(P<0.05); EA组小鼠T1时TWL与CPSP组比较,差异无统计学意义(P>0.05), T2、T3时TWL长于CPSP组,差异有统计学意义(P<0.05); EA+EX527组小鼠T1时TWL与EA组比较,差异无统计学意义(P>0.05), T2、T3时TWL短于EA组,差异有统计学意义(P<0.05)。见表2。

表2 各组小鼠不同时点热缩足潜伏期比较 s
2.3 各组小鼠CWL比较
T0时,各组小鼠CWL比较,差异无统计学意义(P>0.05); T1、T2、T3时, CPSP组、EA组和EA+EX527组小鼠CWL均短于Sham组,差异有统计学意义(P<0.05); EA组小鼠T1时CWL与CPSP组比较,差异无统计学意义(P>0.05), T2、T3时CWL长于CPSP组,差异有统计学意义(P<0.05); EA+EX527组小鼠T1时CWL与EA组比较,差异无统计学意义(P>0.05), T2、T3时CWL短于EA组,差异有统计学意义(P<0.05)。见表3。

表3 各组小鼠不同时点冷缩足潜伏期比较 s
2.4 各组小鼠脑组织含水量比较
CPSP组、EA组和EA+EX527组小鼠脑组织含水量均高于Sham组, EA组小鼠脑组织含水量低于CPSP组, EA+EX527组小鼠脑组织含水量高于EA组,差异有统计学意义(P<0.05), 见表4。

表4 各组小鼠脑组织含水量比较 %
2.5 各组小鼠脑组织SIRT1、Beclin-1、p62蛋白表达水平
与Sham组比较, CPSP组、EA组和EA+EX527组小鼠脑组织SIRT1、Beclin-1表达下调, p62表达上调,差异有统计学意义(P<0.05); 与CPSP组比较, EA组小鼠脑组织SIRT1、Beclin-1表达上调, p62表达下调,差异有统计学意义(P<0.05); 与EA组比较, EA+EX527组小鼠脑组织SIRT1、Beclin-1表达下调, p62表达上调,差异有统计学意义(P<0.05)。见表5、图1。

表5 各组小鼠脑组织SIRT1、Beclin-1和p62表达量比较
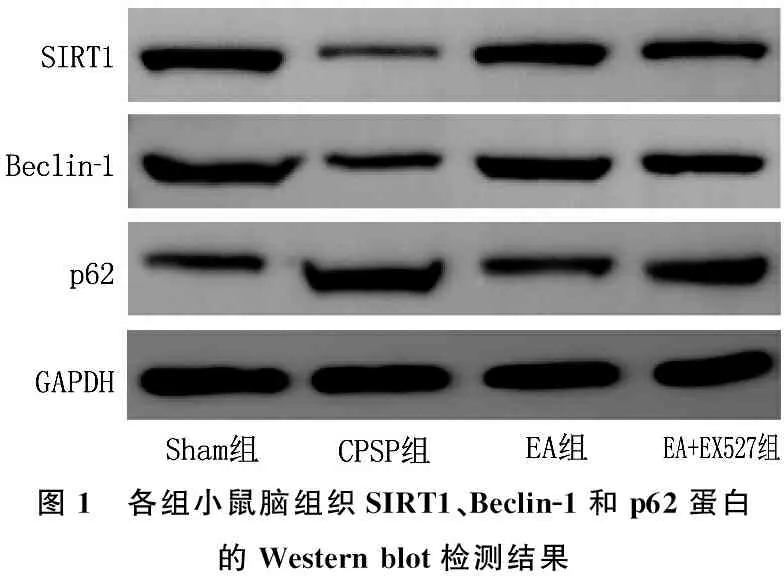
图1 各组小鼠脑组织SIRT1、Beclin-1和p62蛋白的Western blot检测结果
3 讨 论
CPSP为脑卒中后最常见的并发症之一,发生率可达30%左右[8]。由于发病机制尚未完全阐明, CPSP的靶向治疗发展缓慢。目前临床治疗CPSP仍以药物治疗方法为主[9], 但长期药物治疗易导致耐药及多种不良反应。电针具有操作方便、费用低、毒副作用小等优势,在脑卒中的治疗中越来越受到重视。研究[10]显示,电针治疗后,缺血性脑卒中大鼠脑组织中自噬水平升高,脑梗死体积缩小,神经功能缺损程度减轻。有研究[11]提出,在出血性脑卒中大鼠模型中,电针治疗同样可提升脑组织中自噬水平而发挥保护效应,且电针的保护作用可被自噬抑制剂逆转。然而,电针对CPSP的治疗作用是否与自噬相关及其调控机制目前尚无定论。鉴于此,本研究参照文献[7]建立小鼠CPSP模型,探讨电针是否通过调控SIRT1介导的自噬参与CPSP的发生发展,模型建立后, CPSP组小鼠痛阈值降低、脑组织含水量增加,表明造模成功。
自噬为真核细胞胞质内容物降解及再循环的主要方式,对于维持细胞的正常功能、生长发育具有重要意义[12]。Beclin-1是一种重要的自噬调控因子,可作为支架蛋白与Ⅲ型磷脂酰肌醇-3-激酶(PI3K)形成复合物,并促进自噬体形成,在自噬起始阶段发挥主导作用[13]。p62是一种多功能的胞质蛋白,为链接自噬机制与泛素化蛋白的关键调控因子[14]。细胞自噬被激活时, p62蛋白可被降解,水平降低。而自噬功能障碍时, p62蛋白则累积在细胞内,水平升高[15]。因此, p62可作为标记蛋白反映自噬活性。本研究中, CPSP组小鼠脑组织中Beclin-1表达下调、p62表达上调,表明CPSP时自噬水平降低; CPSP小鼠接受电针治疗后, Beclin-1表达上调、p62表达下调,自噬水平升高。由此提示,电针可能通过促进自噬活性减轻CPSP。
SIRT1是NAD+依赖的蛋白去乙酰化酶,在机体能量代谢、自噬及抗氧化应激等过程中均具有调节作用[16]。研究[17]显示, SIRT1可通过活化ULK1和AKT-mTOR等通路激活Beclin-1, 进而诱导自噬。还有研究[18]指出,增加SIRT1的表达可显著降低p62含量,并促进自噬的发生。本研究结果显示, CPSP组小鼠脑组织中SIRT1表达下调,自噬水平降低; EA组小鼠接受电针治疗后SIRT1表达上调,自噬水平升高; EA+EX527组小鼠经EX527处理后, SIRT1表达下调,自噬水平降低。由此推测,电针可能通过上调SIRT1表达增强自噬活性,进而减轻CPSP。
综上所述,电针可能通过激活SIRT1的表达促进自噬,从而减轻小鼠CPSP。
