高血压人群中阻塞性睡眠呼吸暂停及性别对肾小球滤过率的影响
2022-07-07姚晓光汪迎春李南方
王 瑛,洪 静,姚晓光,汪迎春,李南方
新疆维吾尔自治区人民医院高血压诊疗研究中心 新疆高血压研究所 国家卫生健康委高血压诊疗研究重点实验室,乌鲁木齐 830001
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)以睡眠打鼾伴呼吸暂停、间歇性低氧血症为主要特点,可导致或加重高血压、肾功能损害、心脑血管并发症,甚至出现夜间猝死或交通事故[1-2]。目前多项临床、流行病学和基础研究证实OSA与高血压的发生发展密切相关,是最常见的继发性高血压病因之一[3-4]。人群中OSA患病率男女比例在3∶1至5∶1之间,而在高血压人群中,男性OSA患病率高于绝经前女性,但绝经后女性的患病率较男性增长的更快[5-6]。此外,多项研究发现,OSA与慢性肾脏病(chronic kidney disease,CKD)之间存在关联,可引起患者的肾功能损害,OSA患者中CKD患病率已高达30.5%[7]。随着年龄增长,普通人群从 30~40 岁开始出现估算肾小球滤过率(estimated glomerular filtration rate,eGFR)的逐渐降低[8]。然而,高血压人群中合并OSA以及不同性别对eGFR的影响尚不完全清楚,并且高血压合并OSA后其与肾功能改变之间的关联与差异有待进一步探究。因此,本研究旨在探讨高血压合并OSA及在不同性别中的肾功能损害相关指标变化及其影响因素,为临床高血压合并OSA患者进展为CKD的防治提供依据。
资料和方法
资料来源2005年2月至2010年8月间在新疆维吾尔自治区人民医院高血压诊疗研究中心就诊的高血压患者2064例。所有受试者均进行多导睡眠监测(polysomnography,PSG)。纳入标准:(1)夜间打鼾;(2)呼吸暂停或憋醒、白天嗜睡;(3)晨起头痛;(4)血压控制不稳定;(5)肥胖;(6)不明原因口唇发绀等。排除标准:中枢性OSA;患有哮喘、急慢性阻塞性肺疾病、间质性肺疾病、肺结核等呼吸系统疾病;恶性肿瘤、急性感染及自身免疫性疾病;急性心脑血管疾病;1型糖尿病;近期服用类固醇、支气管扩张、抗组胺及抗炎类药物;甲状腺功能异常;胸部手术史;无法完成PSG;严重肾功能不全、肾脏疾病、急性肾损伤;肾性及肾血管性高血压、Cushing综合征等其他常见继发性高血压;精神疾病、长期失眠以及严重睡眠障碍等。本研究通过新疆维吾尔自治区人民医院伦理委员会审批(伦理审查编号:KY2019120621)。
诊断标准OSA诊断标准参考2015年《阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)》[9],睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5次/h即可诊断OSA。依据AHI分为非OSA(AHI<5次/h)和轻度(5次/h≤AHI<15次/h)、中度(15次/h≤AHI<30次/h)、重度(AHI≥30次/h)OSA。并根据AHI分为高血压合并OSA组与单纯高血压组,比较两组患者在不同性别中的临床特征及睡眠监测指标。使用研究对象的性别、年龄和测量的空腹血肌酐水平计算eGFR[10]。
数据收集收集患者的一般资料,包括性别、年龄、身高、血压、体重指数(body mass index,BMI)、腹围、月经史、是否打鼾、吸烟和饮酒情况,以及实验室检查指标如总胆固醇、高密度脂蛋白、低密度脂蛋白、甘油三酯、尿素氮、血肌酐、尿酸、eGFR等。
睡眠监测睡眠监测采用澳大利亚Compumedics公司生产的44导睡眠监测仪及ProFusion PSG分析软件,监测项目包括脑电图、颌下肌电图、眼动电图、口鼻气流、胸腹运动、血氧饱和度、心电图、腿动、体位,均完成夜间7 h以上的睡眠监测。监测前禁饮用茶、咖啡等饮料,避免使用镇静催眠药物。记录AHI、呼吸暂停指数(apnea index,AI)、低通气指数(hypopnea index,HI)、最低血氧饱和度(lowest oxygen saturation,LSaO2)、平均血氧饱和度(mean oxygen saturation,MSaO2)、氧减指数(oxygen desaturation index,ODI)3和4等指标。睡眠分期分为非快速眼动(non-rapid eye movement,NREM)睡眠1~3期和快速眼动(rapid eye movement,REM)睡眠期,总睡眠时间为各期睡眠时间的总和,各期睡眠时间百分比为各期睡眠时间占总睡眠时间的比例。所有分析结果由睡眠监测分析人员完成报告。
血压监测采用验证合格的欧姆龙 HBP-9021型电子血压计,按照《中国血压测量指南》[11]规定,受试者在测血压前30 min内不剧烈活动,心绪平稳,检查室的空间适当,温度适中,环境安静无嘈杂,静坐休息5~10 min后使用标准规格袖带固定于受试者右侧手肘上2.5 cm处,袖带位置与心脏水平一致,气囊至少应包裹80%上臂,连续测量3次,每次至少间隔1~2 min,取3次测量的平均值作为最终收缩压、舒张压。
统计学处理采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料以频数(百分比)表示,组间比较采用χ2检验。采用多因素Logistic回归进行影响因素的分析。P<0.05为差异有统计学意义。
结 果
一般资料2064例高血压患者中,男性1537例,中位年龄44(39.0,51.0)岁,女性527例,中位年龄50(43.0,56.0)岁,包括绝经女性262例(49.7%),未绝经女性265例(50.3%)。其中,男性OSA患者1221例(79.4%),女性OSA患者350例(66.4%)。不同性别组在年龄、打鼾、BMI、腹围、舒张压、高密度脂蛋白、甘油三酯、血肌酐、尿素氮、尿酸、eGFR方面差异均有统计学意义(P均<0.05),而在收缩压、总胆固醇、低密度脂蛋白方面差异无统计学意义(P均>0.05)(表1)。
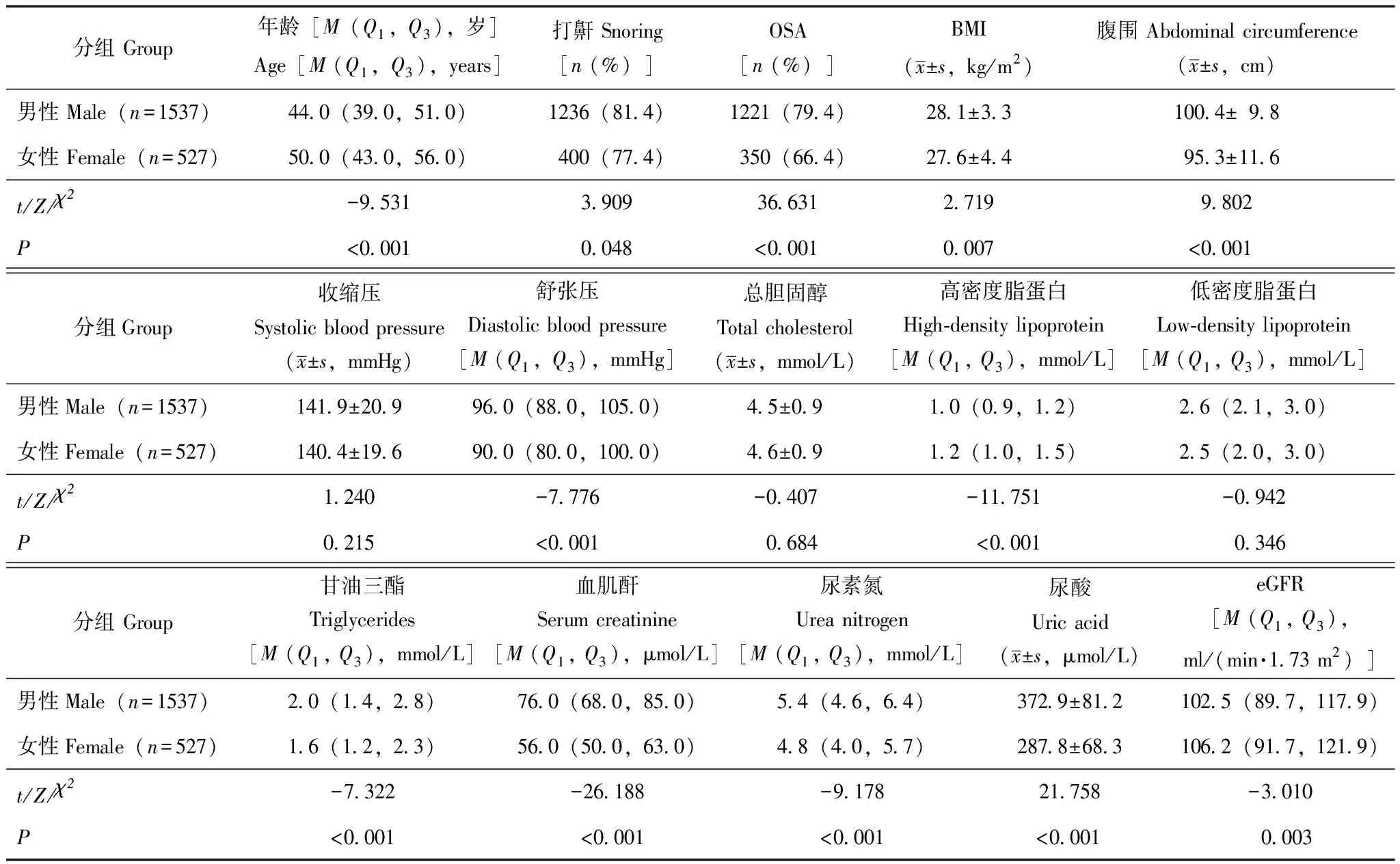
表1 不同性别高血压人群基线特征的比较
在男性患者中,单纯高血压314例,高血压合并OSA 1221例,与单纯高血压组相比,高血压合并OSA组患者的年龄[45(39.0,52.0)岁比42(37.0,47.0)岁;χ2=-6.012,P<0.001]、BMI[(28.5±3.3)kg/m2比(26.7±2.9)kg/m2;t=-8.639,P<0.001]、收缩压[(142.6±20.8)mmHg比(139.0±20.7)mmHg;t=-2.681,P=0.007](1 mmHg=0.133 kPa)、舒张压[98.0(90.0,105.0)mmHg比93.0(85.0,100.0)mmHg;Z=-3.110,P=0.002]均明显增加,而eGFR[101.7(89.2,116.5)ml/(min·1.73 m2)比105.3(92.6,120.5)ml/(min·1.73 m2);Z=-27.434,P<0.001]明显降低,差异有统计学意义。在女性患者中,单纯高血压177例,高血压合并OSA 350例,与单纯高血压组相比,高血压合并OSA组患者的年龄[51(45.0,59.0)岁比45(39.0,50.0)岁;Z=-7.527,P<0.001]、BMI[(28.5±4.5)kg/m2比(25.9±3.3)kg/m2;t=-6.712,P<0.001]、收缩压[(142.0±20.2)mmHg比(137.4±17.7)mmHg;t=-2.798,P=0.005]均明显增加,而eGFR[103.9(90.3,120.0)ml/(min·1.73 m2)比110.2(97.0,126.2)ml/(min·1.73 m2);Z=-18.762,P<0.001]明显降低,差异有统计学意义。
当eGFR≥90 ml/(min·1.73 m2)时,男性高血压患者年龄[44(38.0,49.0)岁比48(42.0,54.0)岁;Z=-8.049,P<0.001]、BMI[(28.1±3.3)kg/m2比(27.6±4.3)kg/m2;t=2.331,P=0.02]、舒张压[95.0(88.0,104.0)mmHg比90.0(80.0,100.0)mmHg;Z=-5.694,P<0.001]与女性相比差异有统计学意义;当eGFR<90 ml/(min·1.73 m2)时,男性高血压患者年龄[47(42.0,54.0)岁比55(47.0,64.0)岁;Z=-6.261,P<0.001]、舒张压[100.0(90.0,106.0)mmHg比90.0(80.0,98.0)mmHg;Z=-5.630,P<0.001]与女性相比差异有统计学意义。
睡眠参数比较2064例高血压患者中,男性AHI(Z=-8.727,P<0.001)、AI(Z=-9.252,P<0.001)、HI(Z=-4.868,P<0.001)均明显高于女性,并且男性中重度OSA比例也明显高于女性(χ2=69.09,P=<0.001)。在睡眠分期中,男性 NREM1、NREM2(浅睡眠)时期较女性明显增加(Z=-10.380,P<0.001;t=2.010,P=0.045),NREM3(深睡眠)时期较女性明显缩短(Z=-6.924,P<0.001)。LSaO2(t=-3.325,P=0.001)、MSaO2(t=-3.569,P<0.001)男性与女性相比明显降低,ODI3(Z=-8.083,P<0.001)、ODI4(Z=-7.554,P<0.001)男性与女性相比明显增加(表2)。
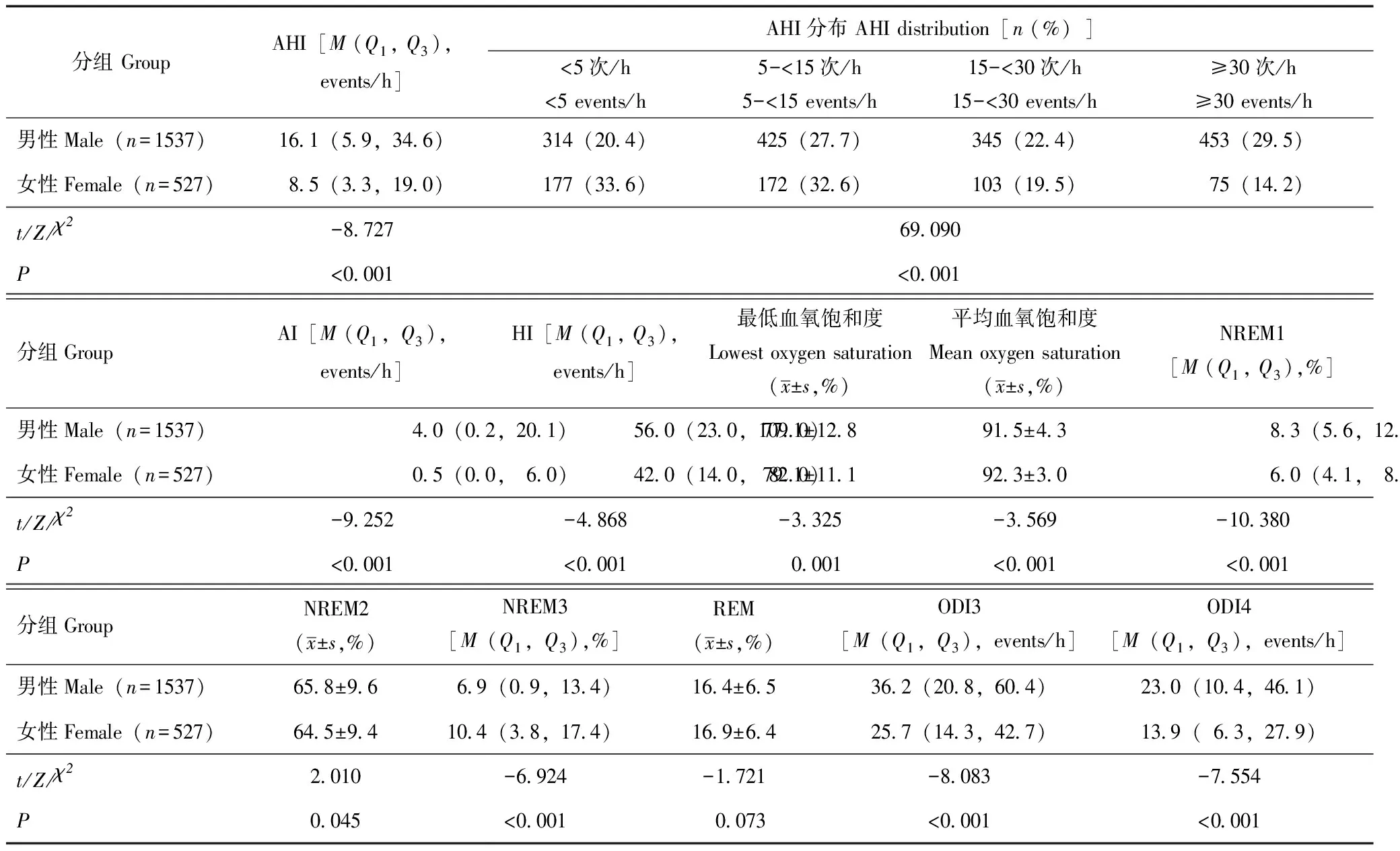
表2 不同性别高血压人群睡眠参数的比较
在男性患者中,高血压合并OSA和单纯高血压组的AHI分别为21.9(11.5,41.9)次/h、2.0(0.8,3.2)次/h,差异有统计学意义(Z=-2.352,P=0.019);LSaO2分别为(74.8±12.7)%、(86.8±5.7)%,差异有统计学意义(t=16.142,P<0.001)。在女性患者中,高血压合并OSA和单纯高血压组的AHI分别为15.2(8.8,26.3)次/h、1.5(0.6,3.3)次/h,差异有统计学意义(Z=-2.669,P=0.008);LSaO2分别为(75.6±10.5)%、(86.9±4.6)%,差异有统计学意义(t=13.222,P<0.001)。
当eGFR≥90 ml/(min·1.73 m2)时,男性高血压患者AHI[14.8(5.7,34.0)次/h比7.9(2.6,18.7)次/h;Z=-7.825,P<0.001]、ODI3[34.1(19.9,58.7)次/h比24.0(13.2,40.7)次/h;Z=-7.159,P<0.001]、ODI4[21.7(9.8,44.3)次/h比12.7(5.7,26.7)次/h;Z=-7.442,P<0.001]与女性相比明显增加,而LSaO2则明显降低[(77.4±12.6)%比(79.8±10.3)%;t=-2.997,P=0.003];当eGFR<90 ml/(min·1.73 m2)时,男性高血压患者AHI[19.4(7.0,38.3)次/h比11.2(3.8,21.9)次/h;Z=-3.807,P<0.001]、ODI3[40.4(23.2,63.2)次/h比32.4(20.0,51.8)次/h;Z=-2.387,P=0.017]、ODI4[25.9(12.1,49.0)次/h比20.3(8.8,32.1)次/h;Z=-3.041,P=0.002]与女性相比明显增加,而LSaO2[(76.6±12.6)%比(78.2±10.2)%;t=-1.373,P=0.170]差异无统计学意义。
eGFR与睡眠参数的相关性分析以eGFR为自变量,与AHI、AI、HI、NREM及REM等睡眠参数相关指标进行Spearman相关性分析,结果显示,在男性人群中,HI与eGFR呈负相关(r=-0.006,P=0.017),NREM3与eGFR呈正相关(r=0.103,P<0.001);在女性人群中,AHI、HI与eGFR呈负相关(r=-0.108,P=0.013;r=-0.094,P=0.032)。
影响eGFR的多因素Logistic回归分析以BMI、收缩压、舒张压、LSaO2、是否合并OSA等单因素分析有统计学意义的参数为自变量,以eGFR是否降低为因变量纳入模型进行多因素Logistic回归分析,结果显示,合并OSA是高血压患者eGFR降低的危险因素(OR=1.377,95%CI=1.045~1.816,P=0.023);分层分析显示,合并OSA是男性高血压患者eGFR降低的危险因素(OR=1.383,95%CI=1.010~1.905,P=0.045);ODI4是女性高血压患者eGFR降低的危险因素(OR=1.013,95%CI=1.002~1.024,P=0.021)(表3)。
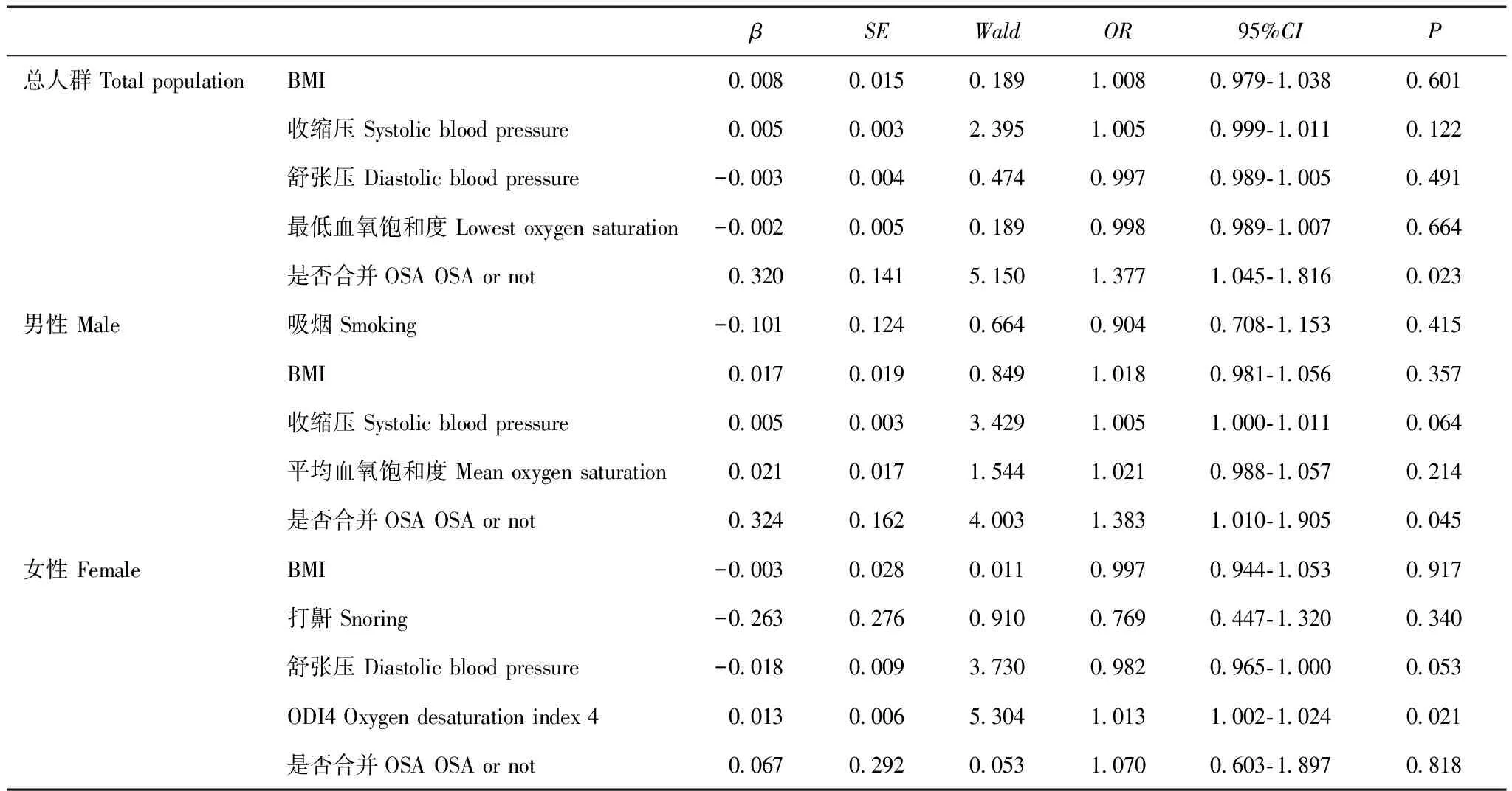
表3 高血压患者中估算肾小球滤过率降低的Logistic回归分析
讨 论
OSA是一种睡眠呼吸障碍,其特征在于夜间睡眠过程中反复发生上气道完全或部分阻塞,导致呼吸暂停及低通气,从而产生反复间歇性低氧等表现。有研究表明,肾脏功能异常的患者OSA的患病率较高[12]。OSA和肾脏功能异常都较易合并高血压、糖尿病、肥胖和心血管疾病等,越来越多的共识认为OSA可能是肾功能损害发生和发展的独立危险因素,目前认为OSA通过间歇性低氧血症、肾素-血管紧张素-醛固酮系统(rein angiotensin aldosterone system,RAAS)失调和代谢综合征等途径导致相关的肾功能改变[13-14]。
本研究中,相比于单纯高血压,高血压合并OSA患者的血压增加,eGFR明显降低。众所周知,OSA可诱导交感神经系统的激活,同时减少夜间血压的下降,这可能直接或间接导致血压的升高。此外,越来越多的证据表明,OSA可能与CKD的进展有关。eGFR作为评估肾功能变化的敏感指标,其降低与肾小球内皮细胞功能障碍密切相关[15]。研究发现在OSA动物模型中,每发生一次阻塞性呼吸事件,肾血流量平均下降 60%以上,临床研究也表明OSA患者经过持续气道正压(continuous positive airway pressure,CPAP)通气治疗后肾血流量明显增加[16]。然而目前与OSA相关的肾功能损害的潜在机制尚不完全清楚。有观点认为,OSA可能是通过影响血管功能障碍、炎症、氧化应激、缺氧、RAAS失调等导致肾功能恶化[19-21]。RAAS过度激活可引起肾小球滤过率增加和蛋白尿,加重肾功能损伤,同时OSA反复发生的间歇性低氧促进肾小管间质炎症的发生进而导致肾脏疾病[22]。此外,OSA还可以通过促进与肾功能恶化相关的危险因素(高血压、肥胖和糖尿病)间接影响肾功能[17-18]。反之,肾功能恶化也能促进OSA的进展[14]。因此,OSA与肾功能损害的发病机制之间存在相互依存的关系。本研究中反映OSA严重程度的HI、AHI与eGFR相关,这与先前的研究结果一致。
在进一步研究分析中发现,合并OSA是男性高血压患者eGFR降低的危险因素,ODI4是女性高血压患者eGFR降低的危险因素,这2个因素都是导致肾功能损害的重要决定因素。动物和临床研究均表明,OSA和肾功能恶化之间的关联可能是由夜间低氧血症介导的[23]。事实上,男性与女性相比,其肾功能损害速度更快,RAAS活性更强,且在慢性肾脏病中常合并OSA。持续OSA状态对血管损害作用因性别而异,并且CPAP治疗可减轻与OSA相关的肾小球高滤过[24]。OSA的临床表现和发病机制存在性别差异,女性常因OSA症状较轻或不明显而被误诊或诊断不足。因此,探讨不同性别在高血压人群中伴或不伴OSA对肾脏功能的影响存在一定意义。本研究在女性高血压人群中,AHI、HI与eGFR具有相关性,而在男性患者中HI、NREM3与eGFR具有相关性,这可能与上气道组织结构和呼吸模式变化有关。当夜间睡眠从快速呼吸变为深呼吸时,这种呼吸方式的变化可能对血氧饱和度和AHI均产生影响,尤其对低通气状态的影响更大。此外,激素水平对肾脏和醛固酮以及血管紧张素Ⅱ的影响存在差异。动物模型发现雌性大鼠的循环醛固酮水平、心肌损伤和蛋白尿均比雄性大鼠更显著。临床研究也证实女性OSA患者经CPAP治疗后雌激素水平显著升高[25]。而这种现象会影响盐皮质激素所调节的反馈系统并进一步导致肾上腺球状带细胞醛固酮分泌增加[26],而醛固酮过量被认为是导致OSA的原因之一,会增加水钠潴留促进颈部局部组织水肿,引起仰卧位气道阻塞和OSA综合征恶化。本研究发现女性eGFR降低与HI呈负相关,可能是与年龄相关的激素水平变化所引起的,也可能肾小球滤过率降低刺激缺氧诱导因子进而促进OSA的发生,具体机制有待进一步探究。
本研究为回顾性研究,一些可能影响eGFR的因素未能评估,例如炎性标志物或在疾病进展中残留的睡眠碎片。此外,本研究缺少与肾脏损害有关的其他指标(如蛋白尿)。因此,在今后的研究中,应进一步探索对肾功能有影响的新型标志物,并深入探讨其在疾病发生发展中的关键机制,以便更深入的了解高血压合并OSA与肾功能疾病进展之间的关联途径。
综上,本研究结果显示,高血压患者合并OSA后其eGFR降低,尤其在男性患者中更为显著。因此,在高血压的临床慢病管理中,应多注意合并睡眠呼吸障碍人群的肾功能指标的动态变化,从而制订出有针对性的干预措施,预防肾脏功能的恶化。
