葛渣水解残渣为拜氏梭菌ART25吸附载体发酵生产丁醇的研究
2022-07-07黄小倩金婷婷周智友经玉洁彭帅英李汉广
黄小倩,金婷婷,周智友,经玉洁,彭帅英,李汉广
(江西农业大学 生物科学与工程学院/应用微生物研究所,江西 南昌 330045)
【研究意义】化石能源作为当今世界的主要能源,在给人类经济发展带来无限动力的同时,也产生了如污染、温室效应等诸多环境问题。为克服这一不利局面,人类开始着手研究开发可持续绿色能源,在诸多可持续绿色能源中,生物丁醇作为一种多功能的四碳醇(C4H10O)与其它传统生物燃料的低级醇相比具有弱腐蚀性、低挥发性、强混合性及可在现有管道中进行运输等优点,被认为是最具潜力的第二代新型生物燃料[1]。因此,加强对丁醇发酵的研究具有重要的现实意义。【前人研究进展】大规模发酵法制备正丁醇可追溯到第一次世界大战期间,当时以玉米粉等粮食作物为底物的丁醇发酵飞速发展,一度成为仅次于酒精发酵的世界第二大发酵产业。上世纪50 年代,由于石油工业的快速发展,丙酮丁醇(丙酮Acetone、丁醇Butanol、乙醇Ethanol,ABE)发酵与石化工业相比成本较高而逐渐衰败。进入21 世纪,由于人们环保意识的不断提高,ABE 技术重新引起人们广泛关注[2]。为降低丁醇发酵生产成本,目前各国科学工作者大量研究了以木质纤维素和工农业残留物等废弃生物质为原料进行ABE 发酵,然而在这些生物质发酵过程中,往往会出现纤维水解产物中抑制物浓度过高、溶剂发酵产量偏低等问题,限制了其规模化生产及商业应用[3]。为顺利解决这一障碍,有研究表明固定化发酵可提高微生物的发酵性能,固定化发酵与自由悬浮培养相比具有许多优势:一是它能改善细胞生长环境,保持高活力的细胞密度,消除细胞滞后期,加快发酵速度,从而提高整体生产力[4];二是在发酵过程中可以减少细胞的损耗,避免了重复接种的需要,有利于连续发酵[5]。在固定化发酵过程中,选择优良的吸附载体是进行这一操作的首要任务,有研究表明木质纤维素水解残渣可作为吸附载体,其多孔表面结构提供了理想的表面积,使细胞很容易附着并生长在其多孔表面,为细胞提供良好生存环境,从而促进细胞的增殖和代谢产物的累积[6]。有研究表明玉米秸秆渣[7]、甘蔗渣[8]和甜高粱渣[9]等水解残渣已成功应用于ABE 发酵,如Chang 等[9]研究发现,以甜高粱渣为固定化吸附载体进行ABE 发酵效果甚佳,分批发酵中ABE 产率和得率分别为0.37 g(/L·h-1)和0.41 g/g,相较于游离发酵分别提高了68%和24%。
【本研究切入点】葛渣是葛根加工业中的副产物,其约含75%左右的纤维素和半纤维素,前期研究虽然证明了其水解液进行ABE 发酵的可行性,但同时发现在此ABE 发酵过程中存在着发酵周期长、丁醇产量低的问题[10]。另一方面,葛渣水解后的残渣表面粗糙而多褶皱,说明此水解残渣具备作为固定化吸附载体的基本条件,目前尚未有将其作为固定化吸附载体进行ABE 发酵的相关研究,因此,若能将其应用于葛渣水解液的ABE 固定化吸附发酵,对提高ABE 发酵强度与葛渣原料的利用率具有重要意义。【拟解决的关键问题】为探究利用葛渣水解残渣作为固定化吸附载体来提高ABE 发酵性能的可行性,本试验拟通过探究不同载体添加量对ABE 发酵的影响,以及吸附环境条件下细胞活性、氧化还原电位和丁醇代谢途径相关酶活的变化,以期阐明这一过程提高ABE 发酵性能的内在机理与拓宽ABE 固定化吸附载体谱系,为其它类似以木质纤维素水解液为原料的发酵工艺提供有益的理论指导。
1 试验材料与方法
1.1 试验材料
1.1.1 菌株 试验采用的菌种是由本试验室自行筛选培育的拜氏梭菌ART25(Clostridium beijerinckiiART25)。
1.1.2 培养基 (1)种子培养基:葡萄糖40.0 g/L,酵母粉2.0 g/L,胰蛋白胨6.0 g/L,乙酸胺3.0 g/L,KH2PO40.5 g/L,K2HPO40.5 g/L,FeSO4·7H2O 0.01 g/L,MgSO4·7H2O 0.2 g/L,琼脂20.0 g/L,pH 6.0,121 ℃灭菌20 min。
(2)发酵培养基:酵母粉3.0 g/L,KH2PO40.5 g/L,K2HPO40.5 g/L,对氨基甲苯0.001 g/L,维生素B10.001 g/L,生物素0.000 01 g/L,MgSO4·7H2O 0.2 g/L,FeSO4·7H2O 0.01 g/L,NaCl 0.01 g/L,CaCO34.0 g/L,pH 6.0,121 ℃灭菌20 min,以葛渣水解液作为碳源(最终还原糖浓度为56 g/L)。
1.2 试验方法
1.2.1 原料预处理及水解 本试验所用葛渣购于上饶市以琳生态农业有限公司,主要成分含纤维素34.8%、半纤维素40.6%、木质素6.20%、灰分3.53%以及少量脂质、蛋白质和钾、钙、锌、镁等金属离子,首先用小型粉碎机将葛渣打成细小粉末,然后装入锥形瓶中,按1∶8 的固液比加入1%的稀硫酸,在126 ℃条件下水解60 min。水解前先在超声设备中超声处理60 min。水解结束后用8 层纱布进行粗过滤去除残渣,用定性滤纸再次过滤得到水解液,过滤得到的葛渣水解残渣用蒸馏水冲洗至中性,并在85 ℃条件下烘干备用。
1.2.2 ABE 发酵 将发酵培养基分装于100 mL厌氧瓶中,每瓶装液量为60 mL,并添加不同量的葛渣水解残渣(5.0,7.5,10.0,12.5,15.0,17.5,20.0 g/L)作为固定化吸附载体,以不添加载体的试验组作为对照组。在无菌条件下将种子液按10%接种量接种至上述培养基中,将输液管针头一端穿过瓶口橡胶塞插入瓶内,另一端浸没在含1%的84消毒液的水中(以达到厌氧环境),37 ℃条件下厌氧静止培养。每隔6 h取样,将样品于10 000 r/min条件下离心5 min,取上清液测各项指标与参数。
1.2.3 测定方法 氧化还原电位(Oxidation-Reduction Potential,ORP)采用氧化还原电位计进行测定[11]。
还原糖浓度利用DNS 法进行测定[12]:向具塞试管中加入1 mL 稀释后的发酵上清液和1 mL DNS 溶液,沸水浴5 min,冷却后用蒸馏水定容至10 mL,测定波长为560 nm。
溶剂含量的测定:通过内标法(内标为异丁醇)测定上清液中的溶剂含量[13],气相色谱条件如下:使用配备有火焰离子检测器(FID)的气相色谱仪和毛细管柱(RB-5,30 mm×0.32 mm×0.25)来分析溶剂浓度,柱温、检测器和进样器温度分别为70 ℃、210 ℃和200 ℃,进样量1 uL。
细胞活性的测定:利用MTT法测定细胞活性[14],取500 μL菌液加入到1.5 mL离心管中,再加入100 μL MTT溶液(5 mg/mL),将离心管置于37 ℃培养箱中继续培养4 h,结束后加入500 μL 二甲基亚砜,充分振荡10 min,在490 nm 波长处检测OD值。
丁醇代谢途径关键酶酶活测定[15-16]:
(1)样品处理:取5 mL 不同时期发酵液在8 000 r/min 条件下离心5 min,用等体积PBS 缓冲液(pH 7.0)对沉淀重复清洗3次。
(2)粗酶液提取:向上述沉淀中加入5 mL PBS,25 μL DNA酶(2.5 mg/mL)及300 μL溶菌酶(25 mg/mL),在30 ℃水浴锅中充分振荡30 min 进行酶解反应,待酶解结束后于4 ℃8 000 r/min 条件下离心20 min,弃去沉淀,上清液即为粗酶液。
(3)乙酸激酶、丁酸激酶测定:反应体系为1 mL,内含28%盐酸羟胺、1 mol/L Tris-HCl(pH 7.5)、1 mol/L MgCl2、4 mol/L KOH、3.2 mol/L 乙酸钾(丁酸钾)、0.1 mol/L ATP、1.25% FeCl3和10%三氯乙酸。反应以ATP为起始剂,在29 ℃下反应5 min后,随后加入1 mL 10%三氯乙酸终止反应,测定波长为540 nm。
(4)乙醇脱氢酶、丁醇脱氢酶测定:反应体系为3 mL,内含0.01 mol/L Tris-HCL 缓冲液(pH 6.0)、2 mmol/L 乙醛(丁醛)和0.5 mmol/L NADH。加入乙醛(丁醛)之前,含有酶液的反应体系先于35 ℃条件下水浴平衡30 min,然后补加适量的NADH,再加入底物乙醛(丁醛),35 ℃件下反应15 min 后,迅速置于冰浴中5 min终止反应,测定波长为340 nm。
2 结果与分析
2.1 葛渣水解残渣最佳添加量的确定
由图1可知,当载体添加量较少(小于10.0 g/L)时,丁醇与总溶剂的产量与对照组(未添加载体)相比无明显变化,而当载体添加量超过10.0 g/L 时,丁醇及总溶剂产量随添加量的增加而降低。当添加量为10.0 g/L 时,丁醇和总溶剂产量最高,分别达到(9.92±0.05)g/L 和(15.79±0.12)g/L。因此从试验结果可知,水解残渣的最佳添加量为10.0 g/L。
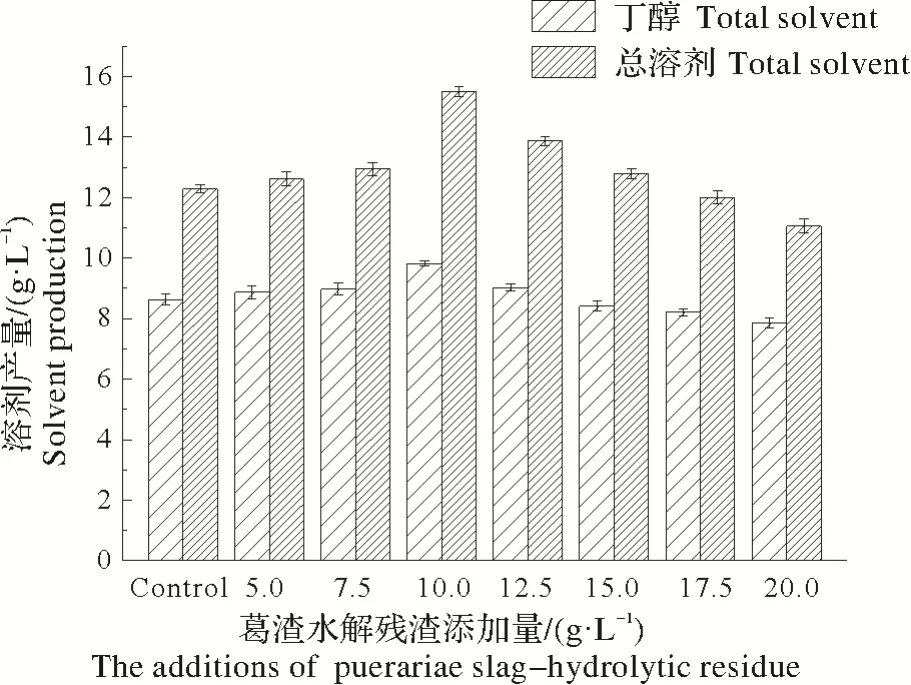
图1 葛渣水解残渣添加量对ABE发酵的影响Fig.1 Effect of the addition of Puerariae Slag-hydrolytic residue on acetone-butanol-ethanol fermentation by Clostridium beijerinckii ART25
2.2 游离发酵和吸附培养过程性能比较
为进一步探究固定化吸附环境对ABE 发酵的影响,试验对最佳载体添加量条件下的吸附环境培养和游离发酵进行了比较,试验结果如图2所示。

图2 葛渣水解残渣为载体对ABE发酵的影响Fig.2 Effect of Puerariae Slag-hydrolytic residue as a carrier on acetone-butanol-ehtnaol fermentation by Clostridium beijerinckii ART25
由图2 试验结果可知,在发酵培养基中添加葛渣水解残渣后,发酵液中丁醇和总溶剂产量也随之变化。在发酵30 h后,对照组与吸附环境下丁醇的产率分别为0.22 g(/L·h-1)和0.25 g(/L·h-1),结果表明吸附培养条件相较于对照组高了13.64%;发酵结束时,对照组的丁醇和总溶剂的产率分别为0.15 g(/L·h-1)和0.21 g(/L·h-1),而吸附环境下的丁醇和总溶剂的产率为0.17 g(/L·h-1)和0.26 g(/L·h-1),与对照组相比分别提高了13.33%和23.81%。此外,吸附环境下的丁醇得率为0.19 g/g,总溶剂得率为0.31 g/g,与对照组相比分别提高了10.00%和19.27%。
2.3 载体吸附培养模式对细胞活性的影响
由图3可知,在整个发酵过程中,吸附培养过程中细胞活性均要高于对照组,在18 h前吸附环境发酵液的OD 值大幅度增加,发酵到30 h 时吸附环境条件和对照组的OD 值达到最大值,分别为14.99 和14.01,30 h之后,两者的OD值逐渐降低,到发酵结束时吸附环境组和对照组的OD值分别为3.87和3.22。
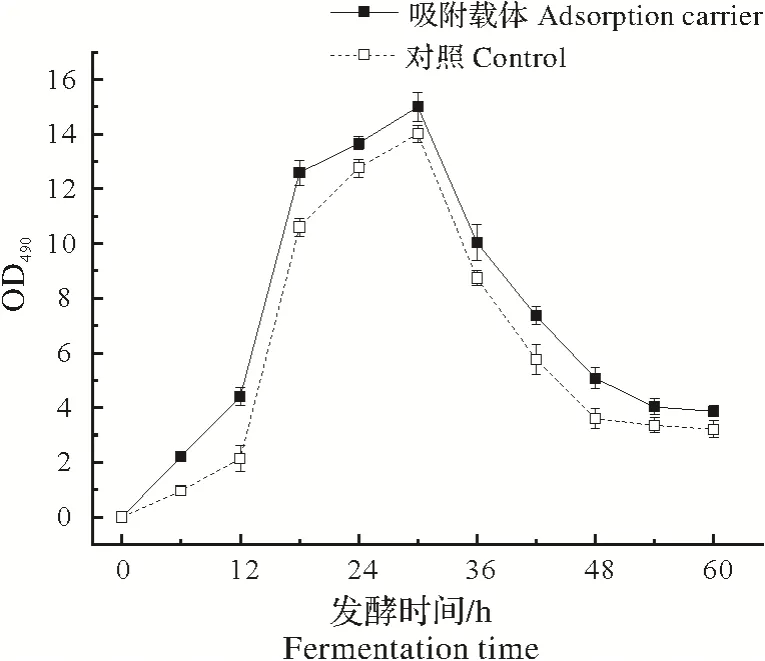
图3 游离发酵与吸附环境下细胞活性随时间变化曲线Fig.3 Curves of cellular activity with time for free fermentation and adsorption environment
2.4 吸附环境条件对氧化还原电位的影响
为更好了解吸附环境条件下ORP 的动态变化,本试验对吸附环境过程与游离发酵过程的ORP 进行测定,其结果如图4所示。

图4 游离发酵与吸附环境条件下氧化还原电位的变化Fig.4 The change curve of ORP for free fermentation and adsorption environment
由图4 可知,对照组和最优载体吸附环境条件下的初始ORP 分别为-46.4 mV 和-53.3 mV。发酵前12 h,两种条件下的ORP 值均迅速下降,吸附环境条件下在12 h达到最低水平,且在这之后略有所回升,在18~30 h基本不变,维持在-360 mV 左右;而对照组在18 h达到最低值,并在此之后开始逐渐上升。直至发酵结束,吸附环境组与对照组相比的还原性一直处在较低水平,这与较高的丁醇合成能力相对应。
2.5 吸附环境条件对丁醇代谢途径相关酶活的影响
由图5可以看出,吸附培养环境过程中乙酸激酶、丁酸激酶、乙醇脱氢酶和丁醇脱氢酶的活性相较于对照组均有所提高。通过研究吸附环境条件下丁醇产量的变化可以看出,在发酵前12 h内,发酵处于产酸阶段,丁醇产量增长较为平缓,吸附环境的乙酸激酶和丁酸激酶活性在发酵12 h 后达到最大值,分别为(0.79±0.05)U(/mL·min)和(0.93±0.05)U(/mL·min),与对照组相比分别提高了33.90%和27.40%。当发酵至24 h,吸附培养条件下的乙醇脱氢酶和丁醇脱氢酶的活性达到最大值,分别为(232.50±4.95)U/mL和(519.50±17.78)U/mL,与对照组相比分别提高了14.53%和38.53%。

图5 添加吸附载体对关键代谢酶活的影响Fig.5 Effect of adding adsorption carriers on key metabolic enzyme activity
3 结论与讨论
利用廉价易得的木质纤维废弃物作为ABE发酵原料及通过各种发酵调控技术提高发酵产物的产量及产率是降低生物丁醇生产成本的两个关键手段。由于固定化发酵过程可保持较高的活细胞密度,消除细胞滞后期,加速发酵速率,从而提高整体生产强度,以及这一发酵过程中可能会增强细胞对不利环境的耐受性,而受到广泛的关注。作为微生物载体的材料应为微生物生长提供良好的支持,具有高表面积,对微生物没有毒害作用,本身具备物理和生物稳定性。本试验所采用的葛渣水解残渣由于经过预处理其表面粗糙多孔,具有均匀合理的孔隙结构,可为微生物的生长提供理想的吸附环境[4],将其作为吸附载体可实现葛渣未水解部分的重新利用,在葛渣水解液为原料的吸附发酵过程中,吸附载体添加量的多少对微生物的发酵性能有显著的影响,当载体添加过多时,会填满整个发酵空间,往往不利于物质的传递,从而影响细胞的吸附固定及对营养物质的吸收;而当载体添加量过少时,又不能为细胞提供足够的吸附比表面积,从而影响载体对细胞的吸附作用和保护作用[17]。由本试验可知当水解残渣的添加量为10.0 g/L 发酵效果最好。在游离发酵和吸附培养过程性能比较中发现发酵前6 h,吸附环境下的还原糖消耗速率与游离细胞发酵的还原糖消耗速率基本相同,这可能的原因是细胞并未完全吸附在载体表面,然而在6 h之后,吸附条件下的还原糖消耗速率明显增加,这可能是因为载体富集了细胞,为细胞提供了合适的生存环境,从而加速细胞的生长与繁殖。同时发酵结束时吸附环境下的丁醇产量与生产强度分别(9.92±0.05)g/L 和(0.17±0.05)g(/L·h-1),与对照组相比分别提高了13.29%和13.33%。Chinwatpaiboon等[18]研究了以纳皮尔草为固定化吸附载体、以葡萄糖为原料的ABE发酵过程,最优固定化发酵条件丁醇的浓度为8.99 g/L,相较于游离发酵丁醇浓度提高了25.60%,在最优固定化条件下丁醇产率为0.07 g(/L·h-1),因此本试验相较于Chinwatpaiboon 等[18]研究结果,丁醇的浓度及产率分别提高了10.34%和142.86%。另一方面,本研究是以葛渣水解液为培养原料,这一策略符合国家所提倡的不以粮食作物作为大宗发酵原料这一建议,能使工农业废弃物得以资源化利用,同时本研究以葛渣水解后的残渣为固定化吸附载体,最大可能的使资源得以充分利用。
为进一步了解葛渣水解残渣作为固定化吸附载体提高ABE 发酵性能的生理机制,本试验比较了吸附环境下和游离细胞发酵过程中细胞活性、氧化还原电位及丁醇代谢途径关键酶活的动态变化。结果表明,在ABE 发酵前18 h 细胞活性的快速提高与同时间段的糖消耗速率曲线相符合,这主要是因为发酵过程中菌体快速生长增加了对还原糖的利用;细胞活性在30 h 时达到最大值然后逐渐下降,可能是随着发酵的进行丁醇浓度逐渐上升,此时部分细胞开始自溶、裂解,从而使整体细胞活性降低,这一结果也表明丁醇的累积对细胞产生了一定的抑制作用,这与Zhou 等[19]的研究结果相一致;并且整个试验过程吸附环境条件细胞活性始终高于对照组,说明葛渣水解残渣作为固定化吸附载体可提高细胞活性,从而有利于溶剂产量的提升。另一方面,吸附培养过程中产物代谢的氧化还原电位较早的回升在一定程度上反映了ABE 发酵过程开始提前进入产溶剂阶段,且在最佳固定化吸附载体添加条件下ORP 处于较低水平的维持时间长于对照组,说明其更有利于菌株的生长和代谢产物的积累,进而提高溶剂产量。有研究表明,梭菌发酵过程中NADH 作为主要还原力被迅速消耗,以合成丁醇和氢气,而细胞氧化还原电位水平的改变直接影响了丁醇的合成[20-21]。ABE 发酵过程通常由产酸期和产溶剂期两个阶段组成,产酸期菌体快速生长,消耗底物并产生大量有机酸(乙酸和丁酸),产溶剂期菌体重新吸收细胞外有机酸并在丁醇脱氢酶等酶的作用下将其转化为丙酮、丁醇和乙醇[22-23]。乙酸激酶和丁酸激酶是产酸期的关键酶,通过底物磷酸化能产生对应的酸并释放大量能量,乙醇脱氢酶和丁醇脱氢酶是产溶剂期的关键酶,这两种酶的活性与乙醇、丁醇的产量具有密切关系[24]。本试验研究表明与丁醇代谢相关的乙酸激酶、丁酸激酶、乙醇脱氢酶和丁醇脱氢酶的活性增加,相较于对照组分别提高了33.90%、27.40%、14.53%和38.53%。在ABE 发酵过程中,乙酸和丁酸是合成乙醇和丁醇的重要中间产物,有机酸(主要是乙酸和丁酸)含量的适当提高可以促进丁醇的生成[25]。由本试验结果并结合溶剂产量和糖消耗速度可推测,固定化载体吸附条件下乙酸激酶和丁酸激酶含量的提高可使生产菌更快速利用还原糖而促进有机酸的生成,使发酵提前进入产酸期,同时,乙醇脱氢酶和丁醇脱氢酶酶活的提高使得乙酸和丁酸被有效重新利用合成更多的乙醇和丁醇,使之未发生酸崩现象。由此可看出,在ABE 发酵过程中,采用葛渣水解后的固体残渣为固定化吸附载体,可通过提高发酵过程关键酶活来以提高ABE 发酵性能,以提高溶剂产量。由此可得载体吸附环境中丁醇产量的提高是多个代谢途径共同作用的结果,而乙酸激酶、丁酸激酶、乙醇脱氢酶及丁醇脱氢酶等酶活的提高是吸附环境条件下丁醇产量及产率高于游离细胞发酵的主要原因。
综上所述,添加适量葛渣水解残渣作为固定化吸附载体,对丁醇和总溶剂的产量有较大促进作用,在阐明吸附环境下提高溶剂产量的生理机制时,发现添加葛渣水解残渣的吸附环境可使细胞长时间处于有利产物代谢产物积累的氧化还原电位及较高的丁醇代谢相关酶酶活水平。通过本试验的开展,验证了以葛渣水解残渣为固定化吸附载体提高丁醇产量的可行性,为优化以葛渣为原料的丁醇生产提供了一定的理论指导。
致谢:江西省研究生创新专项资金项目(YC2021-S350)同时对本研究给予了资助,谨致谢意!
