香蕉PRMT家族全基因组鉴定及PRMT5进化分析
2022-07-07范正阳吴秋桢张春渝许小琼刘生财陈裕坤林玉玲赖钟雄
范正阳,吴秋桢,张春渝,许小琼,李 丹,孙 莹,刘生财,陈裕坤,林玉玲,赖钟雄
(福建农林大学 园艺植物生物工程研究所,福建 福州 350002)
【研究意义】PRMT(protein arginine methyltransferases)是蛋白质中的精氨酸甲基转移酶,该转移酶可将甲基和精氨酸侧链紧密连接,促进精氨酸N 端残基甲基化的反应过程[1],在DNA 损伤修复、RNA 拼接、细胞信号传导、免疫反应和基因转录等过程发挥重要作用[2]。精氨酸甲基化已被公认为是一种具有多效性的翻译后修饰反应[3],可激活或抑制生物体内基因表达,进而影响生物的生命发育活动和遗传信息的传递。【前人研究进展】PRMT 存在于多个物种中,目前已知,在人类基因组中已确定了9 个PRMT,即PRMT1 至PRMT9,根据最终生成的甲基精氨酸产物,将PRMT 分为3 种类型:I 型PRMT 包括催化MMA(单甲基精氨酸)和aDMA(不对称二甲基精氨酸)形成的PRMT1、2、3、4、6和8;II型PRMT包括催化MMA和sDMA(对称二甲基精氨酸)形成的PRMT5 和PRMT9;III 型PRMT 包括催化MMA10 形成的PRMT7[4]。在植物中,PRMT家族可调节植物生长发育的过程并影响植物体的基本特征,包括植株生长、开花时间、光周期循环以及对不同盐度和ABA的胁迫响应[5]。在其他生物中,病毒所含蛋白在侵染宿主细胞的过程中被甲基化,PRMT参与病毒的生命周期的循环过程[6]。拟南芥中发现II型AtPRMT5,该精氨酸甲基转移酶基因位点的突变会导致拟南芥出现叶片卷曲、生长迟缓、开花延迟等多重发育缺陷症状[7],Niu等[8]从花椰菜中纯化出植物蛋白精氨酸甲基转移酶PHRMT10和PHRMT5,其中PHRMT5是拟南芥中AtPRMT5的同源物,AtPRMT5在促进幼苗生长和从营养生长到生殖生长的过渡中起着重要作用,该研究为支持II型PRMT参与调节植物营养生长和调控拟南芥成花机制提供了重要证据。铁皮石斛中发现6个PRMT基因家族成员,可能参与调控金钗石斛光周期的表达,且PRMT各成员的表达在根、茎、叶中具有组织特异性[9]。【本研究切入点】PRMT 在高等植物中参与多种生理反应,但在香蕉中的研究较少[10],香蕉(Musa nanaLour)是芭蕉科芭蕉属植物,在全球热带和亚热带地区广泛栽培,被世界粮农组织定为第四大粮食作物[11]。【拟解决的关键问题】香蕉适宜在高温高湿的环境下生长,对低温非常敏感,气温低于15 ℃时生长受到抑制[12],由于生产栽培的多倍体香蕉具有高度不育性,传统技术手段难以揭示香蕉对低温等非生物胁迫的响应机制,因此利用生物信息学和现代分子生物学技术从基因层面揭示香蕉的抗逆机理对科研和实际生产具有重要意义。
1 材料与方法
1.1 材料
从香蕉基因组数据库(https://banana-genome-hub.southgreen.fr/content/download)下载香蕉A[13]、香蕉B[14]和阿宽蕉[15]的全基因组序列、氨基酸序列和基因注释文件,从TAIR 数据库(https://www.arabidopsis.org/index.jsp)下载拟南芥(Arabidopsis thaliana)PRMT家族成员的氨基酸序列;从国家水稻数据中心(https://ricedata.cn/)下载水稻PRMT家族成员的氨基酸序列。
1.2 方法
1.2.1 香蕉A、B和阿宽蕉PRMT基因家族成员的筛选与鉴定 以拟南芥中的PRMT蛋白为探针,通过本地BLAST,获取香蕉A、香蕉B 和阿宽蕉潜在的PRMT 蛋白候选序列,并使用CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)、Pfam(http://pfam.xfam.org/)和SMART(http://smart.embl-heidelberg.de/)数据库,基于PRMT和PrmA 结构域(PF05185、PF06325),剔除结构不完整、不包含PRMT相关的结构域,对候选序列进行鉴定和验证,最终将鉴定出的PRMT家族成员用于后续分析。
1.2.2 香蕉PRMT 蛋白理化性质预测分析 使用ExPAsy(https://web.expasy.org/protparam/)预测香蕉PRMT蛋白成员的氨基酸数(number of amino acids)、分子量(Mw)、等电点(pI)、不稳定指数(instability index)、脂肪系数(aliphatic index)和总平均亲水性(GRAVY);使用WOLF PSORT 在线软件(https://wolfpsort.hgc.jp/)预测分析亚细胞定位;使用SignalP-4.1 在线网站(http://www.cbs.dtu.dk/services/SignalP-4.1/)进行信号肽预测。
1.2.3 系统进化树分析 使用MEGA-X 软件,采用邻接法(Neighbor-joining Method)构建香蕉A、香蕉B、阿宽蕉、拟南芥和水稻的系统进化树,Bootstrap 值设置为1 000,其余参数默认,最后用iTOL(https://itol.embl.de/)美化。
1.2.4 保守基序和蛋白结构域分析 使用在线软件MEME(https://meme-suite.org/meme/tools/meme),分析香蕉PRMT 蛋白的保守基序,基序基数设置为10,其余参数默认,获取MEME.XML 文件。使用和NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)获取香蕉目标PRMT 蛋白的结构域信息文件,最后使用Tbtools[16](软件版本号:1.098652)将MEME.XML和结构域信息文件可视化。
1.2.5 启动子响应元件预测和蛋白互作分析 从香蕉基因组中提取PRMT上游的2 000 bp 序列用于启动子预测分析,通过Plant CARE 在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子元件,用Excel 2016筛选处理Plant CARE 预测结果并保留响应类元件后,用Tbtools进行展示。使用STRING数据库(https://string-db.org/),上传3种香蕉的PRMT氨基酸序列,以拟南芥数据库为依据,构建蛋白互作网络图。
1.2.6 转录组表达量分析 从香蕉A、香蕉B 和阿宽蕉的低温转录组[17]中提取PRMT基因家族数据,将0,4,13,28 ℃的FPKM值转换为log2(FPKM),对数据进行标准化处理后,用Tbtools进行展示。
1.2.7 香蕉共线性分析及染色体定位 基于香蕉基因组中基因的位置和基因注释文件(gff/gff3),利用Tbtools 的One Step MCScanX-Super Fast 进行物种内共线性分析,然后用Advance Circos 功能添加香蕉A、B 的染色体和阿宽蕉的scaffold 基因密度,标注出目标基因后进行可视化分析。阿宽蕉scaffold按长度排序,选取前15 条scaffold 和PRMT所在的8 个scaffold,用于可视化分析,由于scaffold148 在二者之间重叠,因此共展示22 条scaffold。使用One Step MCScanX-Super Fast 功能,将拟南芥、香蕉A、香蕉B 和阿宽蕉的基因组序列两两比对,合并比对结果文件后,用Tbtools 的Multiple Synteny Plot 功能进行展示。
1.2.8 植物PRMT5基因进化分析 低温转录组热图中发现MiPRMT7在13℃时的相对表达量最高,与拟南芥PRMT 蛋白比对后发现其为PRMT5 蛋白,因此从http://plants.ensembl.org/index.html 下载猕猴桃(Actinidia chinensis,AcPRMT5,PSR91898)、节节麦(Aegilops tauschii,AetPRMT5,AET6Gv2028330 0.1)、拟南芥(Arabidopsis thaliana,AtPRMT5,AT4G31120.1)、甜菜(Beta vulgaris,BvPRMT5,KMT17602)、二穗短柄草(Brachypodium distachyon,BdPRMT5,KQJ93267)、欧洲油菜(Brassica napus,BnPRMT5,CDX68722)、野甘蓝(Brassica oleracea,BoPRMT5,Bo7g114970.1)、芜青(Brassica rapa,BrPRMT5,Bra010256.1-P)、黄麻(Corchorus capsularis,CcPRMT5,OMO61939)、黄瓜(Cucumis sativus,CsPRMT5,KGN60149)、野胡萝卜(Daucus carota,DcPRMT5,KZN08629)、弯叶画眉草(Eragrostis curvula,EcPRMT5,TVU33485)、大麦(Hordeum vulgare,HvPRMT5,HORVU6Hr1G019540.1)、木薯(Manihot esculenta,MePRMT5,OAY35258)、香蕉(Musa acuminata,MaPRMT5,Ma10_g02940.1)、烟草(Nicotiana attenuata,NaPRMT5,A4A49_03162)、光稃稻(Oryza glaberrima,OgPRMT5,ORGLA02G0030400.1)、水稻(Oryza sativa Indica Group,OsPRMT5,BGIOSGA007160-TA)、菜豆(Phaseolus vulgaris,PvPRMT5,ESW09099)、小立碗藓(Physcomitrella patens,PhpPRMT5,Pp3c1_39750V3.1)、桃(Prunus persica,PpPRMT5,ONI34114)、月季(Rosa chinensis,RcPRMT5,PRQ28102)、江南卷柏(Selaginella moellendorffii,SmPRMT5,EFJ08472)、粟(Setaria italica,SiPRMT5,KQL28795)、番茄(Solanum lycopersicum,Sl-PRMT5,Solyc08g005970.3)、高粱(Sorghum bicolor,SbPRMT5,EES06257)、红车轴草(Trifolium pratense,TpPRMT5,Tp57577_TGAC)、小麦(Triticum aestivum,TaPRMT5,TraesCS6B02G137700.1)、赤豆(Vigna angularis,VaPRMT5,KOM41912)和玉米(Zea mays,ZmPRMT5,Zm00001eb086470)这30 个 物种的PRMT5基因CDS 序列用于分析。使用MEGA-X 构建30 个PRMT5氨基酸序列的系统进化树(邻接法,Neighbor-joining Method),采用本地blast 计算香蕉PRMT5氨基酸序列与其余29 个物种之间的相似度,最后通过Excel 365 将相似度数据可视化。
2 结果分析
2.1 PRMT基因家族成员鉴定结果及基本理化性质分析
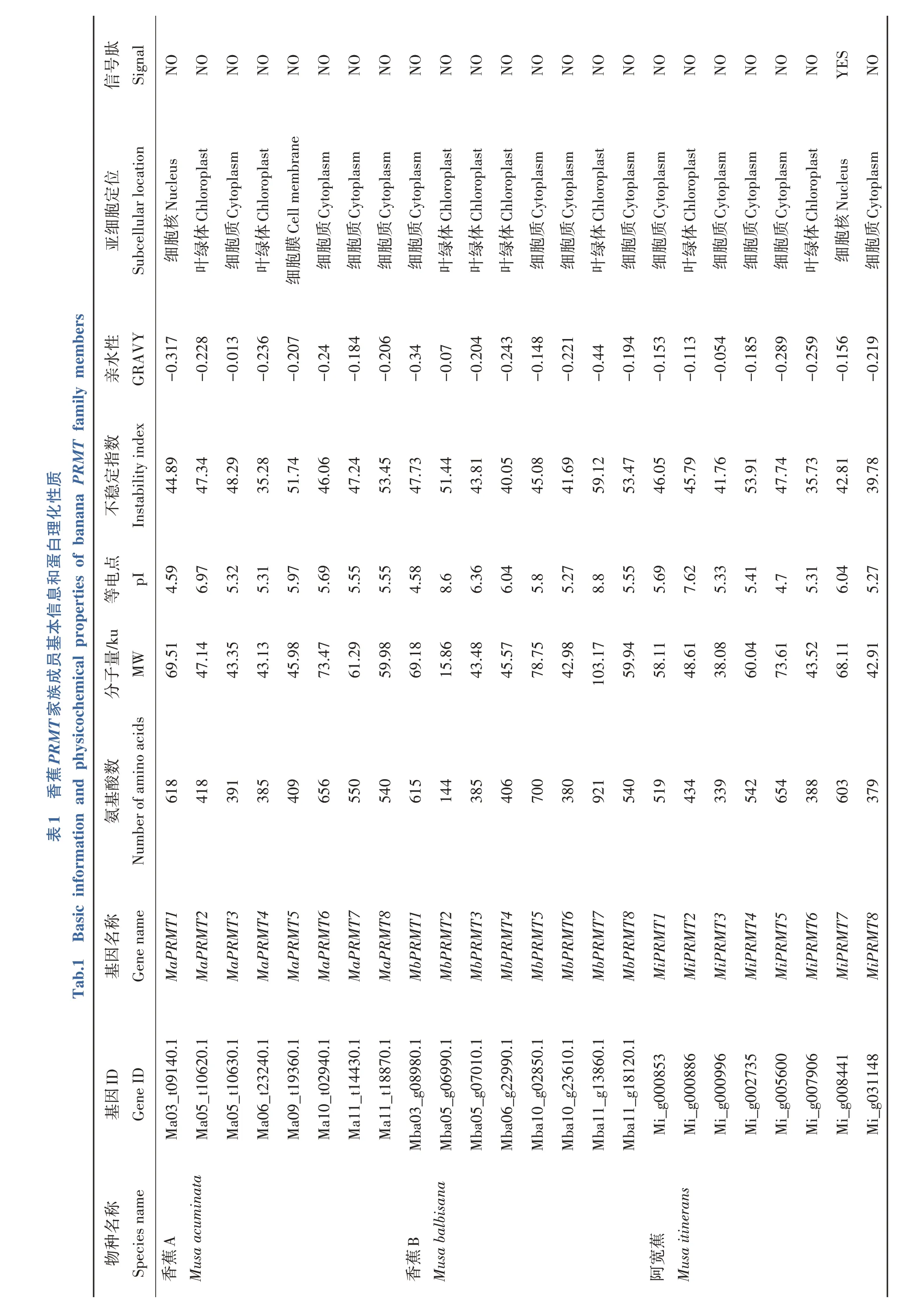
基于香蕉A、香蕉B和阿宽蕉基因数据库,结合家族成员之间的聚类进化关系,在上述3个品种香蕉中各鉴定出8 条成员(表1),根据PRMT家族成员的基因ID 顺序,分别命名为MaPRMT1-8(Musa acuminataprotein arginine methyltransferases 1-8)、MbPRMT1-8(Musa balbisanaprotein arginine methyltransferases 1-8)和MiPRMT1-8(Musa itineransprotein arginine methyltransferases 1-8)。
对3 种香蕉PRMT 蛋白进行基本理化性质分析,结果见表1。香蕉PRMT 蛋白长度、分子量、理论等电点和不稳定系数分别介于144~921、15.86~103.17 ku、4.58~8.80 和35.28~59.12,总平均亲水系数小于0,均为亲水蛋白,亚细胞定位在细胞膜、细胞核、叶绿体和细胞质的比例为4.17%、8.33%、33.33%和54.17%,信号肽预测分析发现,MiPRMT7 蛋白包含信号肽,属于分泌蛋白,其余均为非分泌蛋白。
2.2 PRMT基因家族进化树分析
使用MEGA-X对3种香蕉、拟南芥和水稻的PRMT家族成员蛋白进行分析,并构建系统进化树(图1)。结果显示,香蕉PRMT基因家族成员可分为5 个亚族,亚族1(Group1)包含6 个成员:MbPRMT4、MiPRMT6、MaPRMT4、MiPRMT5、MbPRMT1和MaPRMT1。亚族2(Group2)包含3 个成员:MbPRMT5、MiPRMT7和MaPRMT6。亚族3(Group3)有6 个成员:MiPRMT4、MbPRMT8、MaPRMT8、MbPRMT7、MiPRMT1和MaPRMT7。亚族4(Group4)仅包含2 个成员:MbPRMT6和MiPRMT8。亚族5(Group5)成员数量最多,有7 个,分比为:MiPRMT3、MaPRMT5、MaPRMT3、MbPRMT2、MaPRMT2、MbPRMT3和MiPRMT2。结合PRMT家族成员鉴定结果,证明成员之间亲缘关系较近。
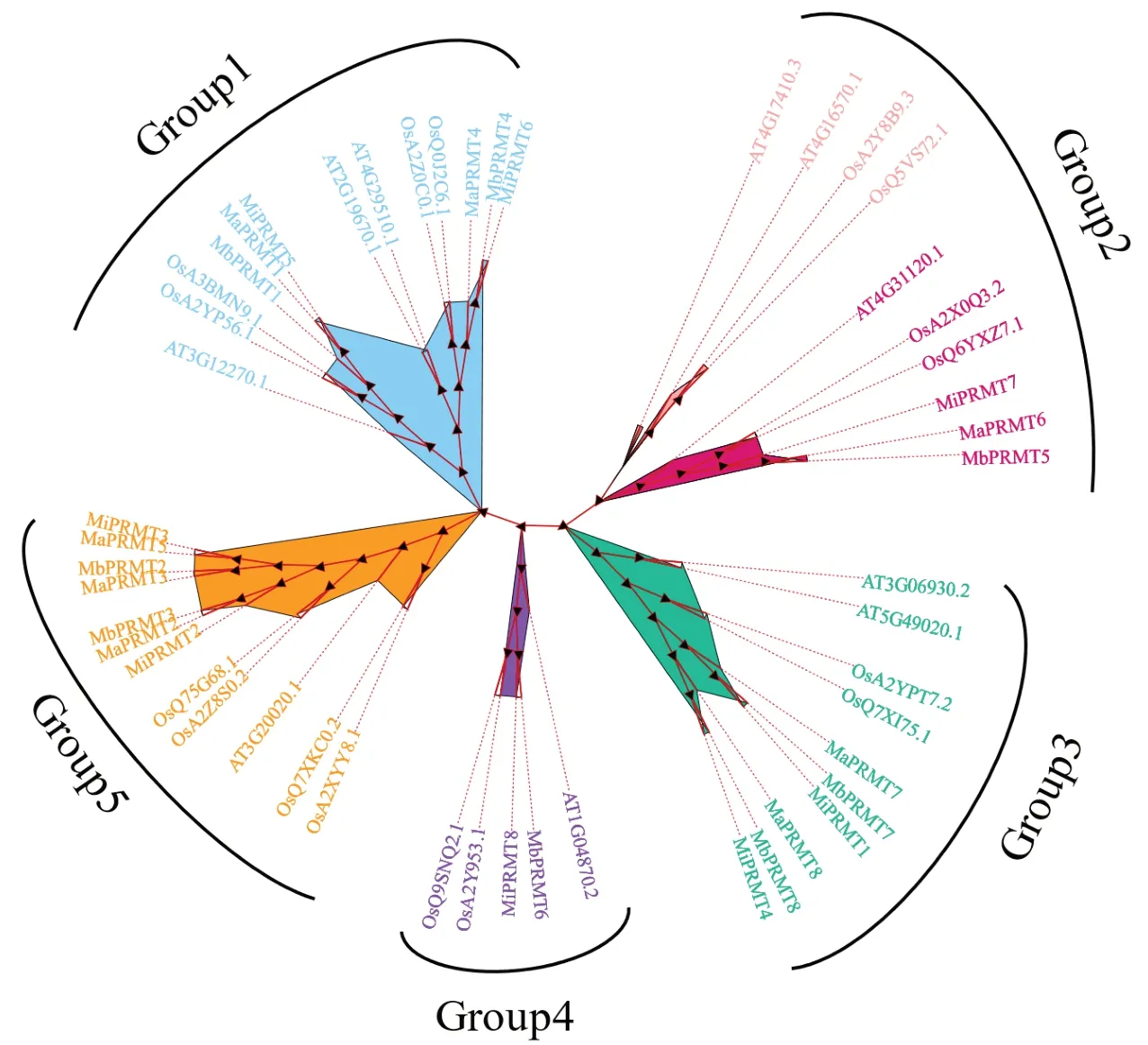
图1 香蕉PRMT家族成员系统进化树分析Fig.1 Phylogenetic tree analysis of banana PRMT family members
2.3 香蕉PRMT蛋白保守基序和结构域分析
使用MEME 在线软件对香蕉A、香蕉B 和阿宽蕉进行保守基序分析,结果(图2a)表明,MaPRMT7、MaPRMT8、MbPRMT7、MbPRMT8、MiPRMT1 和MiPRMT4 这6 条蛋白保守基序数量最多,包含10 个保守基序,且保守基序排列相似度和长度也较接近,推测上述基因之间具有高度同源性;MbPRMT2保守基序数量最少,仅有2 个。24 条蛋白均含有Motif1 和Motif7,该基序可能与PRMT 和PrmA 域相关性较强。除MbPRMT2蛋白外,其余23条PRMT 蛋白均含有Motif2、Motif3、Motif4和Motif6这4个保守基序,说明香蕉中PRMT 蛋白保守性较强,但基序位置有所差异。可视化香蕉PRMT 蛋白结构域后结果(图2b)表明,蛋白结构域的类聚情况与保守基序分布较为一致。9条PRMT蛋白含有AdoMet_Mtases超家族,另有9条含有AdoMet_Mtases,MiPRMT7、MaPRMT6 和MbPRMT5 分别含有PRMT5 和PRMT5_C 和PRMT5_TIM 结构域,此外,MbPRMT7还含有RRM结构域。
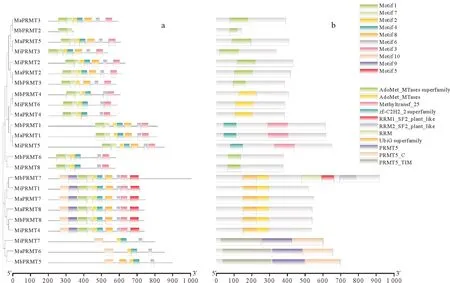
图2 香蕉PRMT家族成员保守基序(a)和蛋白结构域(b)分析Fig.2 Analysis of conserved motifs(a)and conserved domains(b)of banana PRMT
2.4 启动子顺式作用元件预测分析
对PRMT基因家族进行顺式作用元件分析(图3),提取PRMT基因上游2 000 bp 的序列,使用plant-CARE在线网站进行预测。结果表明,香蕉A、香蕉B和阿宽蕉24个PRMT基因启动子中响应元件主要分为3类:光响应、逆境胁迫响应和植物激素响应元件。24个成员均含有光响应元件,22个成员含有茉莉酸甲酯响应元件,17个成员含有脱落酸响应元件,15个成员含有低温响应元件,14个成员含有赤霉素响应元件,11个成员含有生长素和防御应激响应元件,9个成员含有水杨酸响应元件,7个成员含有干旱诱导性元件,6个成员含有厌氧诱导元件,3个成员含有昼夜节律控制元件,1个成员含有胚乳表达元件。

图3 PRMT基因家族启动子响应元件Fig.3 PRMT gene family promoter response elements
2.5 香蕉PRMT蛋白互作预测
以拟南芥蛋白为基础数据,使用STRING 数据库,构建香蕉A、香蕉B 和阿宽蕉PRMT 蛋白互作网络(图4),用以分析PRMT 蛋白的功能关系。结果表明,该蛋白互作网络由PRMT1A、PRMT3、PRMT4B、PRMT6、PRMT10、PRMT7 和PRMT11 这7 个核心蛋白构成,PRMT 蛋白成员之间相互作用较强,除此之外,PRMT 蛋白主要与FIB2、AT1G31660、PWP2、SKB1、AT1G07840、AT1G10490、AT1G06720 和RAP74 发生强相互作用,和其余蛋白之间相互作用较弱。
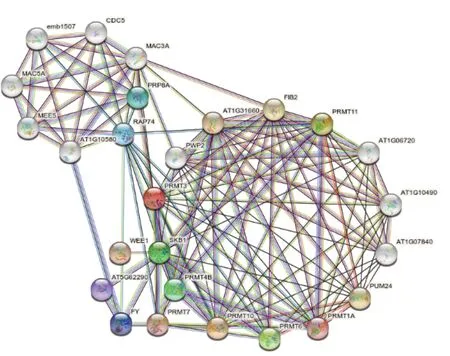
图4 香蕉PRMT蛋白互作网络Fig.4 Protein-protein interaction network of bananas
2.6 香蕉PRMT在不同低温下表达量分析
为了解3种香蕉PRMT家族成员在不同低温下的表达情况,从香蕉低温转录组数据中提取PRMT基因的FPKM 值。结果(图5)表明,家族成员聚类为两大类:第Ⅰ类中MbPRMT3、MiPRMT4、MiPRMT1、MaPRMT7和MiPRMT2在0 ℃时表达上调,4℃时表达下调,表达量最低;MbPRMT5、MbPRMT7和MiPRMT6在4 ℃时表达量较高,0 ℃和13 ℃时表达量较低;MaPRMT1、MaPRMT8和MbPRMT4在0 ℃和13 ℃时下调表达,4 ℃和28 ℃上调表达;MaPRMT4、MbPRMT1和MbPRMT2在28 ℃表达量最高,在其他温度下表达量较低或不表达。在第Ⅱ类中,MaPRMT6、MbPRMT6、MbPRMT8、MaPRMT3和MaPRMT5均不表达;MiPRMT5、MiPRMT7、MiPRMT3、MiPRMT8和MaPRMT2在13 ℃时表达量最高,其余温度下表达量较低或不表达。
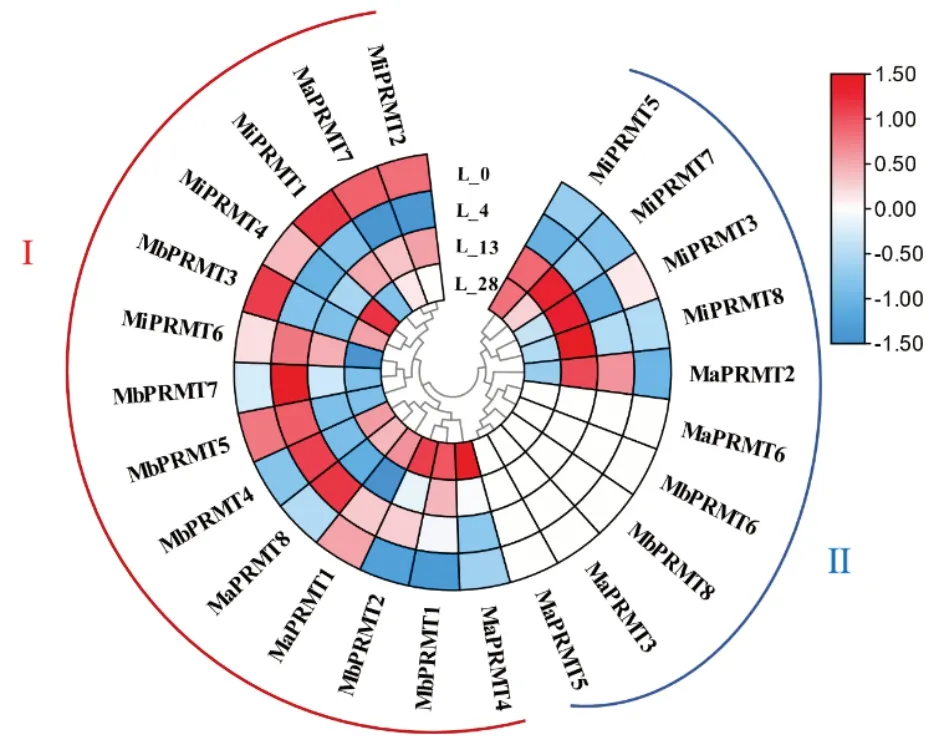
图5 香蕉PRMT在不同低温下表达量分析Fig.5 Expression analysis of banana PRMT at different low temperatures
2.7 香蕉物种内共线性、染色体定位和基因密度分析
为了解香蕉PRMT家族的基因扩增机制,结合染色体或scaffold 的基因密度,对3 种香蕉的全基因组进行共线性分析。香蕉A(图6a)MaPRMT7和MaPRMT8与香蕉B(图6b)MbPRMT7和MbPRMT8参与基因复制事件,且两对基因均位于相对应品种的第11 条染色体上基因密度较高的区域,此外,Mb-PRMT7还参与了香蕉B 第8 条染色体上某个基因片段复制事件。阿宽蕉(图6c)的PRMT基因之间没有发生基因复制事件,且PRMT基因片段所在的scaffold 长度相对较短,与其余scaffold 之间无共线性。特别地,香蕉B 的PRMT有2 个串联重复基因,位于Bchr05(MbPRMT2和MbPRMT3)上,这些串联重复基因可能参与PRMT的功能分化和家族数量扩增[18],为PRMT家族成员的进化过程和扩增机制提供一定的理论依据。
香蕉A 的PRMT基因分别定位在第3、5、6、9、10 和11 这6 条染色体上(图6a),MaPRMT2和MaPRMT3位于第5 条染色体上,二者在染色体上的分布位置较近,MaPRMT7和MaPRMT8分布在第11 条染色体上;其余4 条染色体均只有1 个PRMT基因存在。香蕉B 的PRMT基因定位在第3、5、6、10、11 这5 条染色体上(图6b),MbPRMT2和MbPRMT3均位于第5 条染色体上,MbPRMT7和Mb-PRMT8分布在第11 条染色体,香蕉A 和香蕉B 第3 和11 条染色体PRMT基因的分布位置和起始位点都极其相似,说明两个品种的香蕉在进化过程中,依然保持较近的亲缘关系。阿宽蕉的PRMT基因分别位于scaffold1047、scaffold1048、scaffold1059、scaffold1225、scaffold148、scaffold173、scaffold1802 和scaffold877,8 个PRMT基因分布在不同的scaffold 上(图6c)。基因密度分析结果表明,香蕉A 和B 的第10 条染色体前端的基因密度低,后端基因密度高;其余染色体前端和后端基因密度高,中部基因密度低(图5a 和图5b);香蕉A 和B 分别有50%、62.5%的PRMT分布在高基因密度区,阿宽蕉的PRMT均位于低基因密度区。
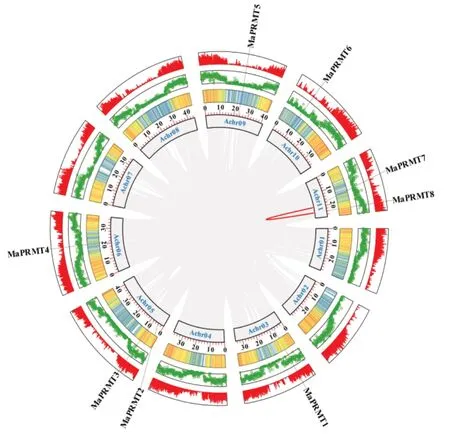
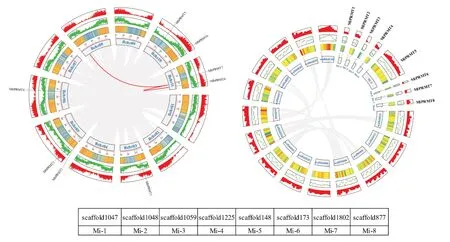
图6 香蕉物种内共线性分析Fig.6 Collinearity analysis within banana species
2.8 香蕉与拟南芥物种间共线性分析
为研究3 种香蕉PRMT基因之间的进化关系,使用3 种香蕉的基因组与拟南芥基因组进行物种间共线性分析。结果(图7)显示,拟南芥有2 个PRMT基因与香蕉A 关联性较强,分别是 ATchr3-Achr11 和 ATchr4-Achr10;香蕉A 与香蕉B 之间的共线性关系最为密切,PRMT基因在染色体上的位置也极为相似,除Achr08-Bchr11,其余均基因所在的染色体编号相一致,说明二者在进化过程中的基因相似度高。香蕉B 与阿宽蕉之间有5 个基因关联性强,且该5 个基因均位于长度较长的scaffold 片段,Mi-3、Mi-5 和Mi-7 与其他物种无关联性。拟南芥和香蕉具有明显的共线性关系,推测这些基因可能是从同一个祖先的基因组中进化而来。
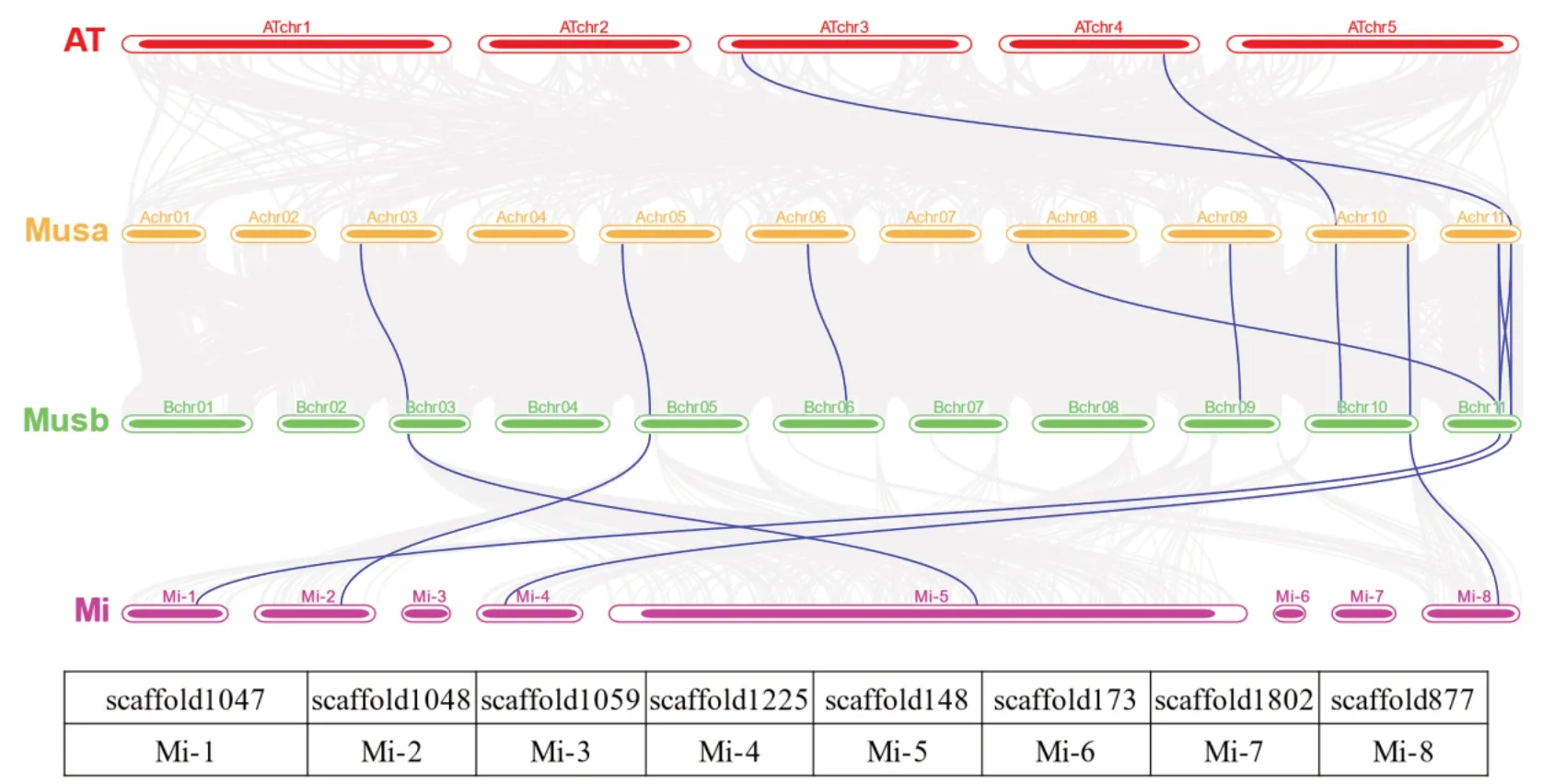
图7 香蕉与拟南芥物种间共线性分析Fig.7 Collinearity analysis between different species of banana and Arabidopsis thaliana
2.9 植物PRMT5进化关系分析
为探究PRMT5在不同植物中的进化关系,使用MEGA-X 构建系统进化树。结果(图8)表明,PRMT5主要聚类为两大类,除玉米(ZmPRMT5)外,其余禾本科植物PRMT5之间亲缘关系较近,同源性和相似度高,说明禾本科植物PRMT5在进化过程中相对保守,经过漫长的进化依然高度同源。此外,同一物种间(如水稻OsPRMT5和光稃稻OgPRMT5,小麦TaPRMT5、大麦HvPRMT5和节节麦AetPRMT5)同源性最高,位于同一进化分支。同科植物(如烟草NaPRMT5和番茄SlPRMT5)之间亲缘关系较近,但与黄瓜CsPRMT5亲缘关系较远;与茄科植物不同的是,豆科植物(赤豆VaPRMT5、菜豆PvPRMT5和红车轴草TpPRMT5)聚类在同一进化分支,推测同科植物在进化过程中基因功能多样化表达,既出现显著性的功能分化,又存在保守性。
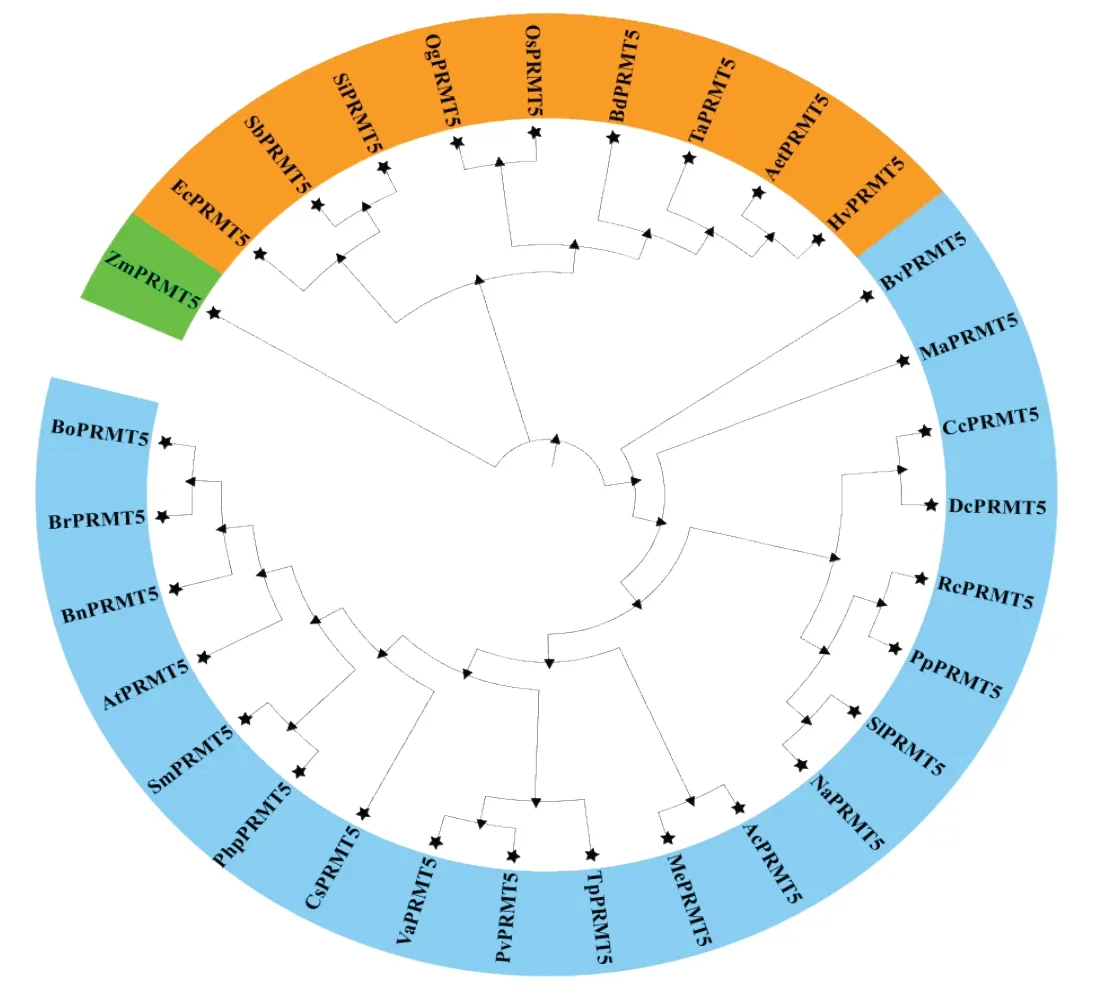
图8 植物PRMT5基因进化关系分析Fig.8 Analysis of evolutionary relationship of PRMT5 in plants
2.10 植物与香蕉PRMT5氨基酸序列相似度比对
为进一步探究PRMT5的进化关系,将29 个物种的PRMT5 氨基酸序列与香蕉做比对,结果(图9)表明,氨基酸序列相似度在70%左右波动,同一科属植物之间序列相似度较高。其中,欧洲油菜(Bn-PRMT5)与香蕉PRMT5相似度最高,达79.19%,最低的是江南卷柏(SmPRMT5),仅64.59%。
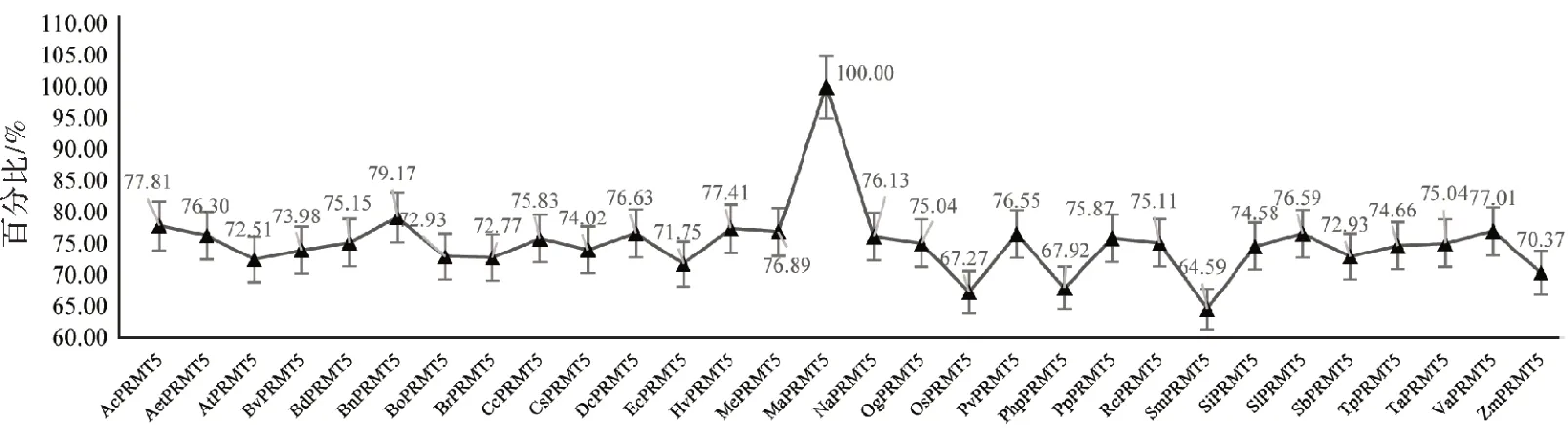
图9 植物与香蕉PRMT5氨基酸序列相似率Fig.9 Amino acid sequence similarity of PRMT5 between plant and banana
3 讨论
3.1 香蕉PRMT参与精氨酸甲基化和DNA损伤修复过程
PRMT在动物中研究较多,且大多与癌症等疾病[19-22]或病毒[23]相关,在植物中的研究相对较少。本研究在香蕉A、香蕉B 和阿宽蕉均鉴定出8 个PRMT成员,经前人发现,植物中PRMT基因家族成员在拟南芥中有9 个[24],水稻[5]、玉米[25]和海滨雀稗[26]中均有8 个,桉树[27]中有7 个,金钗石斛中有6 个[9],从家族成员数量来看,3种香蕉与模式植物(拟南芥和水稻)以及非模式植物(苹果、海滨雀稗、桉树等)大致相等。
香蕉PRMT蛋白结构域中,有18 个成员保守结构域与AdoMet_Mtases 相关,3 个成员包含Methyltransf_25。腺苷蛋氨酸(AdoMet)是甲基转移酶(Mtase)催化的多种生物甲基化反应中普遍存在的甲基供体[28-30],AdoMet 类似物是炔基链取代磺基结合而成的甲基,可以作为许多DNA 和RNA 甲基转移酶的替代辅助因子,使这些线性链能够共价沉积到DNA 或RNA 中的同源靶点[28],腺苷蛋氨酸依赖的甲基转移酶的催化,这种翻译后修饰具有多种细胞功能,此外,一些甲基转移酶表现出广泛的底物特异性[31],需要全面的靶向分析方法进一步研究。部分成员含有RRM1(核糖核苷酸还原酶大亚基)、RRM2(核糖核苷酸还原酶调节亚基M2)和RRM 结构域。高阳[32]研究证实,靶向RRM1 可以增加辐射诱导的DNA 双链断裂损伤和凋亡信号;申慧敏[33]证实,RRM2表达上调可促进癌细胞的转移和增殖,抑制细胞凋亡,RRM2表达下调则与之相反,RRM 类的结构域说明PRMT与DNA 的损伤、修复和细胞凋亡相关。MiPRMT7、MaPRMT6和MbPRMT5含有PRMT5、PRMT5_C和PRMT5_TIM 结构域,PRMT5是负责细胞内对称精氨酸甲基化主要的催化反应酶[34],PRMT5通过催化精氨酸391(R391)上AKT1的对称二甲基,促进AKT活化,进而参与细胞的凋亡、增殖与分化[35]。Ezeka等[36]证明,PRMT5与甲基小体蛋白50(MEP50)辅因子协同作用,催化组蛋白中关键精氨酸的对称二甲基化,改变染色质环境,可影响基因表达。结合蛋白互作结果,PWP2 参与90S 前核糖体的组装过程[37],SKB1 维持根部干细胞的表达以应对DNA 损伤[38],RAP74 可调控RNA 聚合酶II 终端领域特有的磷酸盐,参与磷酸活化[39],推测香蕉中PRMT 蛋白可能也具有上述特异性功能。综上所述,初步证明香蕉PRMT兼具保守性和功能特异性,3 种香蕉的PRMT与精氨酸甲基化相关,且RRM系列结构域还参与DNA损伤修复。
3.2 香蕉PRMT可能参与激素代谢通路并抵御逆境胁迫
启动子顺式元件预测发现香蕉PRMT启动子中含有大量非生物胁迫和植物激素响应元件,表明其可能参与相关代谢途径影响香蕉生长发育。研究证实,茉莉酸甲酯(MeJA)在逆境胁迫相关代谢方面被广泛研究[40-41],可缓解盐胁迫和抗氧化作用[42],结合EBR(24-油菜素内酯)增强油橄榄叶片抗冻性[43]。脱落酸(ABA)在干旱胁迫、气孔开闭等生理过程密切相关,在抗逆反应中发挥重要作用[44],ABA 在重度干旱条件下可调控净光合速率和水分利用率[45],达到抗旱效果[46]。水杨酸(SA)是普遍存在于植物中的酚类化合物,是激活植物抗逆反应和逆境胁迫的信号分子[47],外源SA 可提高叶绿素和总酚含量,并提高细胞渗透压,缓解盐胁迫作用[48],Yang等[49]发现SA通过激活抗氧化防御系统、调节离子平衡和细胞超微结构,Souana等[50]研究表明外源SA可提高抗氧化能力和光合作用速率,缓解盐胁迫作用。
综上,24 个PRMT家族成员中,91.67%、70.83%、58.33%、45.83%、37.50%的成员含有MeJA、ABA、GA、Aux和SA响应元件,表明PRMT可能与香蕉的激素代谢和调节过程密切相关,MeJA、ABA和SA在多种植物中都据有抗逆作用,推测上述物质在香蕉A、香蕉B 和阿宽蕉中可能发挥相似的胁迫防御或应激反应,除与植物激素相关的抗逆代谢通路外,启动子顺式元件中还包含干旱、低温、厌氧诱导和昼夜节律调控元件,但在香蕉中的具体代谢途径和作用机理,还需进一步研究。
结合香蕉0,4,13,28 ℃的低温转录组数据,发现低温在24 个PRMT成员中呈现出两大类不同的表达模式。第Ⅰ类大致在0 ℃和4 ℃时表达量高,说明低温促进第Ⅰ类基因表达,13 ℃或28 ℃的温度抑制其表达,推测PRMT家族成员中发挥抗寒功能的基因主要来自第Ⅰ类。第Ⅱ类中MiPRMT5、MiPRMT7、MiPRMT3、MiPRMT8 和MaPRMT2在13 ℃时表达量最高,这5 个基因对13 ℃最敏感,该温度非常接近抑制香蕉生长的临界温度,推测香蕉在面对不同梯度的低温条件时,会调控不同的相关抗寒基因表达。
3.3 香蕉PRMT5进化过程相对独立
香蕉PRMT5位于禾本科以外的进化大类中,但独立出现在一个进化分枝,与其他物种之间亲缘关系相对较远,基因进化过程与其余物种出现较大的分化。值得注意的是,禾本科植物(除玉米外)PRMT5均能聚类到同一进化分枝中,说明禾本科植物PRMT5可能是同源的,基因序列之间的差异性则意味着禾本科植物种属间由于进化发育,进而产生不同的族群。禾本科的氨基酸序列相似率较接近,进一步说明禾本科之间亲缘关系相近。重复是基因组和遗传系统演化中的重要表现形式之一[51],物种经历全基因组加倍事件后,基因数量和功能可能发生改变[52],但在植物中PRMT家族成员数目普遍小于10,且PRMT5未出现大规模扩增事件。玉米(ZmPRMT5)独自位于一个进化分枝中,可能是由于玉米基因组经历某次特异性扩增[53],使ZmPRMT5功能特异性表达,与其余植物的亲缘关系出现远离。综上,初步说明PRMT5在多种植物中均有稳定遗传表达,不同物种间的PRMT5存在一定的亲缘关系,其中禾本科植物之间的同源性和相似性最高,且香蕉中PRMT5的进化过程相对独立。但PRMT5的起源、复制、分化和进化机理等问题,还需进一步深入探究。
4 结论
研究基于香蕉A、香蕉B和阿宽蕉的基因组数据,在3种香蕉中均筛选并鉴定出8个PRMT基因家族成员,利用生物信息学技术,对其蛋白质理化性质、系统进化树、保守基序、蛋白结构域、启动子响应元件预测、蛋白互作、低温转录组表达模式和共线性进行系统分析,并研究植物PRMT5基因的进化关系。进一步讨论结果表明,3 种香蕉PRMT的保守结构域均与精氨酸甲基化相关;启动子元件中均包含光响应元件,并含有大量植物激素和非生物胁迫响应元件;结合低温转录组发现,香蕉在其抗寒代谢过程中会依据不同梯度的低温调控不同的基因进行表达,以达到适应环境的效果;且香蕉PRMT5进化过程相对独立。本研究为进一步探究香蕉PRMT家族成员的基因信息和生物学功能奠定基础。
致谢:福建农林大学科技创新专项基金项目(CXZX2020027A)和福建省高原学科建设经费(102/71201801101)同时对本研究给予了资助,谨致谢意!
