草鱼Pim-1基因克隆、组织表达及多克隆抗体的制备
2022-07-07阮记明梁惜梅隗黎丽
王 辉,刘 林,阮记明,梁惜梅,隗黎丽
(江西农业大学 动物科学技术学院,江西 南昌 330045)
【研究意义】蛋白激酶(protein kinase)是生物体内普遍存在的一类酶,这类酶可定向结合ATP 或GTP,催化ATP 或GTP γ-磷酸基团转移到受体蛋白(丝氨酸、苏氨酸或酪氨酸)中,通过催化蛋白质磷酸来调控蛋白质的活性、定位及功能,进而参与机体内生长、代谢及信号转导等多种生物学过程[1-2],但蛋白激酶的功能等在鱼类中的研究比较少。【前人研究进展】蛋白激酶的种类十分丰富,研究发现自然界中至少存在1 000 种蛋白激酶,由此将其统称为蛋白激酶超家族[3]。莫洛尼鼠白血病病毒前病毒整合基因1(Proviral integration of moloney murineleukemia virus 1,Pim-1)是一个原癌基因[4],而Pim1 激酶是由Pim-1基因编码的一种丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinases,STPK)[5]。Pim-1 激酶最初在小鼠白血病病毒诱导的淋巴瘤中被发现的,因此也被称为莫洛尼鼠白血病激酶[6]。Pim-1 激酶是一种具有组成性活性的蛋白激酶,可在无配体结合的情况下自发产生生理活性。已有不少研究表明Pim-1 激酶可通过磷酸化多种细胞底物来介导生理功能。研究指出Pim-1 激酶可磷酸化G1 期细胞周期调节因子(cylin-depndent kinase inhbitor 1 A,CDKN1A),使其重新定位到细胞质中,进而下调另一细胞周期调节因子(cylin-depndent kinase inhbitor 1 B,CDKN1B)的表达水平,促进细胞周期进展和肿瘤发生[7-8]。亦有研究指出Pim-1 激酶可磷酸化促凋亡蛋白B 细胞淋巴瘤/白血病基因2 细胞死亡拮抗因子(B-cell lymphoma/Leukemia 2 antagonist of cell death,BAD),诱导抗凋亡蛋白B 细胞淋巴瘤/白血病基因(B-cell lymphoma/Leukemia,Bcl)的释放,以此来抑制线粒体凋亡途径[9-10]。而Zhu等[11]曾提出Pim-1在小核仁RNA宿主基因15(small nuclear RNA host gene 16,SNHG16)对人弥漫大B 淋巴瘤(diffuse large B cell lymphoma)细胞增殖、G0/G1 期阻滞及细胞凋亡的影响中意义重大。这些研究表明Pim-1 激酶在机体内细胞周期、增殖及凋亡等生理过程中具有重要作用。而在鱼类中,有研究表明斑马鱼基因组中有300 多个Pim 激酶,这些激酶与人类Pim 激酶序列相比具有较高的保守性,对斑马鱼(Danio rerio)细胞周期调控同样具有重要意义[12-13]。近几年来,已有不少研究对Pim-1基因在人或哺乳动物中的生理作用进行了探索。然而,有关Pim-1基因在鱼类中的研究却十分匮乏,在草鱼(Ctenopharygodon idella)中则未见报道。【本研究切入点】本实验室采用微囊藻毒素诱导草鱼后,经肝脏转录组测序发现Pim-1基因为差异表达基因。【拟解决的关键问题】因此,本研究根据转录组测序获得的部分序列采用RACE 法克隆获得草鱼Pim-1(CiPim-1)基因的全长cDNA 序列,采用qRT-PCR 检测CiPim-1在草鱼组织中的表达情况,同时构建pGEX-4T-1-Pim1 原核表达体系及制备草鱼Pim-1多克隆抗体,为进一步研究Pim-1在草鱼细胞增殖及凋亡中的功能及调控机制奠定基础。
1 材料与方法
1.1 材料与试剂
实验草鱼体质量约为22.13 g,购买于南昌市神龙渔业养殖基地;麻醉剂间氨基苯甲酸乙酯甲磺酸盐(3-Aminobenzoic acid ethyl ester methanesulfonate)为Sigma 公司产品;TRIzol reagent 为Invitrogen 公司产品;SYBR Green Real-time PCR Master Mix 和Revert AidTMFirst Strand cDNA Synthesis Kit 为Promega 公司产品,Super SMART®PCR cDNA Synthesis Kit 为Clontech 公司产品。pMD18-T 载体、T4 DNA 连接酶和DL2000 DNA Marker 购自TaKaRa 公司;大肠杆菌E.coliRosetta、原核表达载体pGEX-4T-1 和辣根过氧化物酶(Horseradish peroxidase,HRP)标记的山羊抗兔IgG 购自武汉爱博泰克生物科技有限公司;Glutathione Sepharose 4B 亲和层析柱购自GE 公司;SDS-PAGE 蛋白电泳marker(14.4~116 ku)购自赛默飞世尔科技(中国)有限公司;双色预染marker(10~250 ku)购于上海雅酶生物医药科技有限公司;试验中所用引物由上海生工生物工程有限公司合成;其他化学试剂均为分析纯。
1.2 Total RNA的提取及cDNA的合成
采用间氨基苯甲酸乙酯甲磺酸盐(100 mg/L)对草鱼进行麻醉,然后迅速分离肝脏组织置于液氮中快速冷冻保存。取出液氮保存的肝脏样品,加入TRIzol reagent 研磨并提取草鱼肝脏组织总RNA;检测RNA浓度并使用Super SMART®PCR cDNA Synthesis Kit试剂盒20 μL反转录合成cDNA作为RACE-PCR的模板;采用Revert AidTMFirst Strand cDNA Synthesis Kit 试剂盒合成用于检测草鱼Pim1基因不同组织相对表达量的cDNA,合成的cDNA样品置于-80 ℃冰箱保存。
1.3 CiPim-1 cDNA全长的克隆
Pim-1基因的序列片段来源于本实验室草鱼RNA-seq 数据[14],根据该片段序列,采用Primer premier 5.0 软件设计简并引物(Pim1-MF:5′-TATCAGGTCGGCTCTGTG-3′,Pim1-MR:5′-AGAACCTGGCGGAAAAAG-3′),随后进行PCR扩增并测序验证该EST序列的正确性。
根据已获得的CiPim-1基因EST 序列设计特异性引物(RC3-1:5′-CGCCCGTCTTTCGAGGACATCATC-3′;RC3-2:5′-CCCCTACAGACAACATCAGGCTTC-3′)进行CiPim-13′端序列克隆。第一轮PCR扩增,使用RC3-1和3′RACE接头引物进行PCR扩增(94 ℃3 min,94 ℃30 s,58 ℃30 s,72 ℃90 s,30 cycles,72 ℃10 min),接着将第一轮PCR 扩增产物稀释后,再用RC3-2 和3′RACE 接头引物做第二轮巢式PCR扩增,最后筛选阳性克隆进行测序,获得3′-末端序列。最后,设计5′-末端扩增的3条特异性引物(RC5-1:5′-TCACACGATCTTTTGC-3′;RC5-2:5′-AGCCATCAGCGATCCTT-3′;RC5-3:5′-GCTTGATGGCAACCGGC-3′)进行槽式PCR 扩增,获得5′-末端序列,接着进行序列拼接和比对获得CiPim-1基因cDNA 全长,全长克隆的具体方法参考本实验室发表的文献[15]。
1.4 生物信息学分析
利用生物信息学在线软件对CiPim-1基因进行分析,采用ExPASy(http://www.expasy.org)中的Translate和ProtParam 程序分别进行氨基酸序列推导和蛋白理化性质分析,根据所推导的氨基酸序列利用SignalP4.0 软件(http://www.cbs.dtu.dk/services/SignalP)分析蛋白的信号肽,蛋白跨膜区预测与结构域分析则分别采用在线软件TMpred(https://embnet.vital-it.ch/software/TMPRED_form.html)与在线软件InterPro-Scan(http://www.ebi.ac.uk/interpro/search/sequence-search)。采用软件ClustalW1.81 进行氨基酸序列比对分析,并通过软件Mega7.0中的邻接法(Neignbor-Joining,N-J)构建系统进化树。
1.5 荧光定量PCR
取3 尾健康草鱼,使用间氨基苯甲酸乙酯甲磺酸盐进行麻醉处理,先进行尾静脉取血100 μL,随后快速分离其肝脏、肾脏、头肾、脾脏、肠、心脏、鳃、皮肤和肌肉组织各约100 mg 提取RNA 并反转录为cDNA。采用美国Bio-rad荧光定量PCR 仪(CFX96 TouchTM Real-Time PCR Detection System)检测CiPim-1在草鱼各组织中的相对表达量,并以草鱼β-actin作为内参基因进行校正[16]。使用2-ΔΔCt法计算CiPim-1基因在草鱼各组织的相对表达量。
1.6 原核表达及蛋白纯化
根据原核表达质粒pGEX-4T-1的多酶切位点及CiPim-1基因核苷酸序列特征进行分析,在246~318 aa这段序列内设计并合成表达引物F:5′-CGGTAGCCACGAGGACAGGTGCTGTT-3(′下划线示BamHⅠ酶切位点)及5′-ACGCGTCGACTTTGCACACAGTGACTGC-3′(下划线示SalI酶切位点),进行PCR 扩增并将获得的反应产物进行SDS-PAGE 凝胶电泳检测并将DNA 回收,将质粒pGEX-4T-1 与回收的DNA 进行BamHⅠ和SalI双酶切。回收双酶切片段,采用T4 DNA连接酶过夜连接,构建重组表达质粒pGEX-4T-1-Pim1。将pGEX-4T-1-Pim1 转入大肠杆菌E.coliRosetta 中,并将大肠杆菌E.coliRosetta 接种于含有100 μg/mL氨苄的LB固体培养基37 ℃恒温培养,挑阳性单克隆送至上海生工生物工程有限公司测序。
将测序后鉴定正确的阳性菌种接种于含有100 μg/mL氨苄LB液体培养基中培养(37 ℃、180 r/min),当菌液生长至OD600nm为0.5~0.6 左右时,加入终浓度为0.8 mmol/mL 的IPTG 37 ℃诱导4 h,同时以不加诱导剂的菌液作为对照组。然后超声破碎诱导表达后的菌体,在4 ℃下10 000 r/min 离心20 min,分别取上清液和沉淀(沉淀分别使用2 mol/L 和8 mol/L 的尿素溶解)进行SDS-PAGE 电泳,确定重组蛋白以包涵体的形式表达。将沉淀用8 mol/L 的尿素溶解并离心收集上清,再次用缓冲液(8 mol/L 尿素、0.1%TritonX-100、2 mmol/L DTT、50 mmol/L Tris、300 mmol/L 氯化钠、1 mmol/L EDTA,pH 8.0)重悬混匀,4 ℃轻摇30 min,并装入Glutathione Sepharose 4B 亲和层析柱。接着用1×PBS 洗去杂蛋白,最后用缓冲液(50 mmol/L Tris-HCl,10 mmol/L 还原型谷胱甘肽,pH 8.0)洗脱,收集目的蛋白用于SDS-PAGE 鉴定分析纯化的融合蛋白。
1.7 多克隆抗体制备
以纯化后的融合蛋白pGEX-4T-1-Pim1作为免疫原,免疫对象为新西兰大白兔(购自爱博泰克生物科技有限公司,武汉),将其随机分为免疫组与对照组。将弗氏佐剂与pGEX-4T-1-Pim1 纯化蛋白的乳化剂同时对免疫组新西兰大白兔在背部皮下多点注射,对照组的新西兰大白兔则注射弗氏佐剂和PBS(0.01 mol/L,pH 7.2~7.4),分别在第1、12、26、40天再次免疫,共免疫4次。之后在第59天进行静脉采血,获取血清,同时获取对照组阴性血清,并通过ELISA测定血清对抗原蛋白的效价[17]。
1.8 Western Blotting分析
将pGEX-4T-Pim1 融合蛋白作为抗原对抗血清进行亲和纯化,得到浓缩后的CiPim-1多克隆抗体。对不同浓度菌体蛋白进行SDS-PAGE 凝胶电泳,把大小在25~40 ku 左右的蛋白转移至PVDF 膜上,用5%脱脂奶粉室温封闭2 h,随后使用制备的CiPim-1多克隆抗体(1∶1 000)作为一抗,室温孵育2 h,然后用含3%脱脂奶粉的TBST 缓冲液洗膜6 次,每次10 min。使用辣根过氧化物酶标记的山羊抗兔IgG(1∶10 000)作为二抗,室温孵育1 h,再用TBST 洗涤3 次,每次洗涤10 min。使用ECL 发光试剂盒进行显色反应并采用GE化学发光凝胶成像系统对PVDF膜进行图像采集和密度扫描分析[18]。
1.9 数据分析
CiPim-1在不同组织中的相对表达平均值±标准差表示,并采用SPSS 25.0 one-way ANOVA 进行统计分析,P<0.05表示差异显著。
2 结果与分析
2.1 CiPim-1基因全长cDNA序列特征分析
根据草鱼转录组测序结果得到的EST 序列,通过RACE 法扩增CiPim-1基因的3′及5′末端序列,再根据RACE 产物的测序结果设计特异性引物克隆获得了CiPim-1cDNA 全长序列(登录号:MG797688)。该基因序列全长1 082 bp,包括5′非编码区9 bp、3′非编码区116 bp 及开放阅读框957 bp,共编码318 个氨基酸,蛋白质分子量为36.14 ku,理论等电点为6.14,没有信号肽和跨膜结构。结构域分析表明CiPim-1包含1 个蛋白激酶样结构域超家族(Protein kinase-like domain superfamily)(35-294 aa),这其中包含1 个蛋白激酶结构域(Protein kinase domain)(35~287 aa)。
2.2 CiPim-1氨基酸序列同源性及系统进化分析
利用CiPim-1氨基酸序列进行BLAST 分析,获得了鱇浪白鱼(Anabarilius grahami)、斑马鱼(D.rerio)、尖吻鲈(Lates calcarifer)、黄鳝(Monopterus albus)、大菱鲆(Scophthalmus maximus)、斑马拟丽鱼(Maylandia zebra)、小鼠(Mus musculus)、非洲象(Loxodonta africana)、灰熊(Ursus arctos horribilis)、阿马逊花鳉(Poecilia formosa)及人(Homo sapiens)的氨基酸序列,CiPim-1氨基酸序列与其它鱼类及哺乳类Pim-1都具有较高的相似性(88%~99%)和一致性(75%~97%)。其中CiPim-1氨基酸序列与鱇浪白鱼Pim-1相似性达99%,与斑马鱼Pim-1的相似性达98%。系统进化树结果显示,CiPim-1与斑马鱼首先聚为一小支,亲缘关系最近。然后与鱇浪白鱼聚为一支,再与其它鱼类聚为一支。然后与哺乳类聚为一支,两栖类则位于另一支(图1)。

图1 草鱼Pim-1基因的系统进化树Fig.1 Phylogenetic tree of Pim-1 gene in grass carp
2.3 CiPim-1基因组织分布特征分析
通过qRT-PCR 检测了CiPim-1在头肾、脾脏、肾脏、皮肤、肌肉、肝脏、肠、血液、心脏及鳃中的表达。结果显示,CiPim-1在血液和不同组织中均有表达,在心脏组织中的表达最为丰富,其次为血液、肌肉和皮肤,在肝脏组织中的表达量相对较低(图2)。以相对表达量最低的肝脏作为参照进行one-way ANOVA分析,心脏、血液和肌肉中CiPim-1的表达量均显著高于肝脏表达量(P<0.05),头肾、脾脏、肾脏、皮肤、肠道和鳃相对于肝脏的表达没有显著差异(P>0.05)。
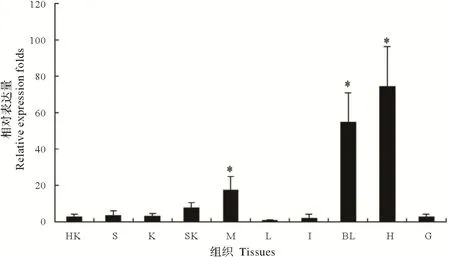
图2 CiPim-1的组织特异性表达分析Fig.2 Tissue-specific expression of CiPim-1
2.4 CiPim-1基因的原核表达、蛋白纯化及多克隆抗体制备
构建pGEX-4T-1-Pim1 重组表达载体,将重组表达载体转化到大肠杆菌中,采用IPTG 诱导后,经SDS-PAGE 电泳分析,发现重组蛋白pGEX-4T-1-Pim1 主要以包涵体的形式表达在沉淀中,上清中不含有目的蛋白,且空载体对照组没有出现相应的条带(图3A),表明本研究成功诱导表达了重组蛋白pGEX-4T-1-Pim1。将包涵体稀释不同倍数后溶解,结果显示,采用8M 尿素溶解20 倍稀释后的包涵体时,融合蛋白浓度和纯度较高(图3B),可达到免疫要求。新西兰大白兔免疫59 d 后获得抗血清,经ELISA检测效价可达到1∶512 000。大量诱导pGEX-4T-1-Pim1重组蛋白后经Glutathione Sepharose 4B亲和层析柱纯化,得到浓度为3 mg/mL 的融合蛋白(图3C),与破菌纯化后的浓度和纯度差异不大,可进行抗原亲和纯化。
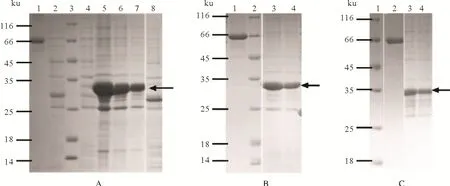
图3 CiPim-1原核表达及蛋白纯化Fig.3 Prokaryotic expression and protein purification of CiPim-1
2.5 CiPim-1多克隆抗体特异性检测
抗血清用pGEX-4T-Pim1蛋白作抗原亲和纯化后,得到浓缩后的抗体,将抗体1∶1 000稀释后,进行Western Blotting 检测。结果如图4 所示,在1∶1 000 稀释的抗体条件下,抗体检测抗原条带大小在35 ku左右。抗体1∶1 000 稀释可检测到500 pg 抗原,表明抗体浓度正常。以上结果证明CiPim-1多克隆抗体能够特异性识别CiPim-1重组蛋白。

图4 Pim-1蛋白的WB检测Fig.4 Western Blotting of Pim-1 protein
3 讨论
3.1 CiPim-1基因cDNA全长的克隆及其生物信息学分析
本研究成功克隆了CiPim-1基因的全长cDNA 序列,其包含957 bp 的开放阅读框,编码318 个氨基酸。CiPim-1含有1个蛋白激酶样结构域超家族,蛋白激酶结构域位于蛋白激酶样结构域超家族中。在人[19]、牛[20]和小鼠[21]的Pim-1序列中也发现了蛋白激酶结构域,斑马鱼Pim-1中同样存在这一结构域[22]。CiPim-1蛋白激酶结构域的N 端末端存在一段含有甘氨酸的残基(GXGXXG,其中X 代表任何氨基酸,37-42 aa),该残基在人[23]、小鼠[21]和斑马鱼[22]Pim-1中同样存在。同时,CiPim-1蛋白激酶结构域的中心部分还存在一段保守的蛋白序列(HRDIKDENIL,165~174 aa),在人和小鼠Pim-1中也发现了这段区域[24]。蛋白激酶结构域普遍存在于丝氨酸/苏氨酸蛋白激酶和酪氨酸蛋白激酶中,该结构域包含了多个结构保守且具有催化活性的功能残基,这些残基与蛋白激酶结合ATP 并催化氨基酸残基的磷酸化作用密切相关[3,25-26]。由以上分析可推测CiPim-1可能同样具有催化蛋白质磷酸化的作用,可结合ATP使其转移到底物相应的氨基酸残基中,从而改变蛋白功能构象,最终参与到机体细胞周期调控、增殖、分化及凋亡等生理过程中[1-2]。通过氨基酸同源性比对分析进一步发现,CiPim-1与已报道的物种的氨基酸序列具有较高的相似性和一致性,其中与鱇浪白鱼Pim-1氨基酸序列相似性达99%。由此可知,CiPim-1氨基酸序列和结构与其它鱼类及哺乳类均具有较高的相似性,表明Pim-1在鱼类和哺乳动物之间均具有高度的保守性。
3.2 CiPim-1基因在不同组织中的表达分析
在本研究中,CiPim-1在草鱼头肾、脾脏、肾脏、皮肤、肌肉、肝脏、肠、血液、心脏及鳃10中均有表达,在心脏、血液及肌肉中的表达较为丰富,这一结果与哺乳动物中Pim-1的研究类似。Pim-1在哺乳动物心肌、平滑肌和内皮细胞中也有较高的表达量,在这些细胞的分化中也发挥了关键作用[27-28]。在人类心脏细胞中,Pim-1的高表达量有助于抑制细胞凋亡,稳定线粒体膜的通透性和细胞器的形态,从而达到促进细胞增殖和抗凋亡的作用[29]。亦有研究表明Pim-1在人胸腺、脾脏、骨髓等造血组织中的表达量丰富,对造血细胞的增殖和分化具有重要意义[30]。除此之外,Eichmann 等[31]曾提出Pim-1在小鼠中枢神经系统中多个区域均有高表达也预示了其在造血系统外发挥了一定作用。大量报道也表明Pim-1可被生物体内多种细胞因子、信号因子或有丝分裂原诱导表达,它在不同组织或细胞中的表达水平与其发挥的作用密切相关[32]。Mondello等[33]研究指出在肿瘤中过表达Pim-1可抑制细胞凋亡,促进细胞增殖、分化和成熟,从而参与肿瘤形成并促进肿瘤生长。而Hu 等[34]则提出,在人心脏细胞中,Pim-1可通过抑制促凋亡因子cyc和caspase-3 的表达及调节Bcl-2、Bcl-XL和Bad等抗凋亡因子的表达,从而提高细胞的存活率。同时,Pim-1在大鼠视网膜色素上皮细胞和视网膜神经节细胞层中均有分布,提示其可能参与大鼠神经和视网膜结构的发育[35]。但目前为止,有关Pim-1在鱼类组织中的表达相关研究十分匮乏。CiPim-1在草鱼组织中的广泛分布也预示了其可能在鱼类生长发育中发挥了重要作用。
3.3 CiPim-1多克隆抗体的制备
建立体外高效表达蛋白纯化方法,获得具有一定生物活性的高纯度蛋白有助于从生物学、化学等多方面探究蛋白的结构及其功能特性。Pim激酶具有组成性活性,且蛋白半衰期非常短,调控蛋白稳定性对其细胞功能和活性至关重要[36]。已有研究利用原核表达载体与树脂纯化技术获得了人Pim-1重组蛋白,并对其结构和功能进行了分析[37]。为进一步探究CiPim-1基因的功能,选取pGEX-4T-1原核表达载体构建CiPim-1蛋白表达体系,并采用大肠杆菌作为外源蛋白重组表达的宿主微生物。这一宿主是基因工程表达系统的首选,具有低成本、易培养且表达水平高等优点。成功构建pGEX-4T-1-Pim1重组表达载体后,在E.coliRosetta 菌体中进行扩增。最终在37 ℃下0.8 mmol/L IPTG 诱导下重组蛋白成功表达,且主要形成包涵体。蛋白产率常受蛋白合成速度、糖基化修饰和培养基条件等因素影响,当重组蛋白表达量较高时,容易形成不可溶且无生物活性的包涵体[38]。本研究通过稀释和溶解包涵体获得了表达水平较高且纯度较优的目的蛋白,为后续抗体制备奠定了基础。为进一步研究CiPim-1蛋白的功能,本研究采用新西兰大白兔为免疫动物,成功制备了CiPim-1多克隆抗体。最后,通过ELISA 和Western Blotting检测证明兔抗CiPim-1多克隆抗体效价较高,且具备良好的特异性。
4 结论
本研究成功克隆了CiPim-1基因全长及构建了pGEX-4T-1-Pim1原核表达载体,并利用纯化的重组蛋白制备了兔抗CiPim-1多克隆抗体,该抗体具有高效价且能特异性识别重组蛋白,为后期深入研究鱼类Pim-1的生物学功能等方面奠定了基础。
