猪ISG15基因表达、多态性及其与繁殖性状的关联分析
2022-07-07周泉勇刘晨龙季华员万明春黄美峰黄江南
周泉勇,刘晨龙,季华员,万明春,黄美峰,黄江南*
(1.江西省农业科学院 畜牧兽医研究所,江西 南昌 330200;2.江西省赣州市畜牧业发展和动物疫病防控中心,江西赣州 341001)
【研究意义】产仔数性状严重影响着养猪业的生产效率及经济效益,提高母猪产仔数一直是猪遗传育种的研究重点。产仔数是一个低遗传力性状(h2=0.1)。利用性能测定、遗传评估等常规育种技术短时间内较难取得明显进展,通过筛选获得影响母猪产仔数性状的遗传标记,从而利用分子标记进行辅助选育无疑是更为理想的手段[1-2]。【前人研究进展】产仔数的高低取决于妊娠期间胎儿的存活率[3]。已有研究表明,Ⅰ型干扰素通过建立免疫耐受、识别妊娠信号、促进血管发育等多种途径在妊娠建立过程中起着极为关键作用[4-5]。干扰素刺激基因15(Interferon-stimulated gene 15,ISG15)属类泛素蛋白家族成员,是Ⅰ型干扰素作用于机体后上调表达的典型基因[6]。目前,在人[7]、鼠[8]、狒狒[9]、牛[10]、羊[11]和马[12]等众多哺乳动物中均已检测发现ISG15在妊娠早期子宫内膜中被诱导表达。这一保守基因的子宫反应,暗示着该基因在妊娠建立过程中起着重要作用。妊娠的建立依赖于母体对胚胎抗原的免疫耐受。此过程中,母体子宫内膜中免疫基因的表达模式决定了母体胎儿的免疫特征[12]。ISG15是免疫通路中重要的调节因子[13]。研究显示,在原代牛子宫内膜腔上皮细胞中,ISG15参与上调MHC 分子表达从而维持妊娠早期的免疫耐受环境,促进胚胎成功黏附[14]。体外细胞试验发现,牛病毒性腹泻病毒可通过抑制子宫内膜中ISG15 蛋白的表达,从而降低子宫免疫功能和破坏妊娠识别信号导致早期胚胎死亡[15-16]。在ISG15基因敲除小鼠中,ISG15基因缺失会导致子宫内膜中黏附和细胞存活功能相关基因的表达水平发生改变,从而致使交配后50%的胚胎死亡于妊娠7.5~12.5 d[17-18]。显然,妊娠期子宫内膜中ISG15表达水平的变化与胚胎存活密切相关。此外,在牛中,ISG15已被作为早期妊娠诊断的生物标志物。ISG15的高表达,可有效促进牛胚胎的发育,而敲除ISG15后,囊胚的孵化率将显著性降低[19]。这些结果提示,妊娠过程中,ISG15可能通过表达丰度的改变参与调控胚胎的存活率从而影响产仔数性能的发挥。【本研究切入点】目前,关于ISG15在繁殖功能方面的研究主要集中在牛和鼠中,在猪中的报道尚少,且其与产仔数性状之间的相关性还需进一步研究来阐述。【拟解决的关键问题】基于此,本实验利用荧光定量PCR 方法检测ISG15在猪妊娠早中期子宫内膜和绒毛膜中的表达水平变化,并通过测序筛选ISG15的多态位点,分析其在中外猪群中的遗传多样性及与产仔数的关联性,拟为研究ISG15在猪繁殖功能中发挥的作用提供重要数据。
1 材料与方法
1.1 试验材料
用于基因表达分析的样本来源于9 头体况相近的大白后备母猪,配种后同等条件饲养至妊娠15,26,50 d 进行屠宰取样。其中妊娠15 d 仅采集子宫内膜,妊娠26,50 d 分别采集绒毛膜和附植点子宫内膜。每头母猪按胎儿附植情况采集样本5 份以上,采集后于液氮中保存。用于遗传多样性分析和关联性分析的DNA 样本均取自华中农业大学农业动物遗传育种与繁殖教育部重点实验室样本库。其中遗传多样性分析样本共180个,包括大白猪30个,梅山猪38个,清平猪29个,通城猪49个,大花白猪34个,分别来源于昆山市梅山猪原种场、当阳市清平猪原种场、通城县种畜场和新丰县板岭原种猪场,且品种个体间3 代以内无血缘关系。关联性分析样本为大白母猪个体365 个,来源于广东华农温氏畜牧股份有限公司水台猪场同一批次产5 胎以上生产母猪,收集的性状数据为胎次、总产仔数、产活仔数和初生重。RNA 提取试剂盒购自Tiangen Biochemical Technology 公司,反转录试剂盒购自Promega 公司,PCR 纯化试剂盒购自Beijing Baitek Biotechnology 公司,内切酶HindⅢ购自MBI 公司,荧光定量试剂盒购自TOYOBO 公司。
1.2 引物设计
从NCBI 网站中调取猪ISG15基因mRNA 序列(NM_001128469.3),应用Primer 5.0 软件设计相关检测引物(表1),并委托生工生物工程(上海)有限公司进行合成。
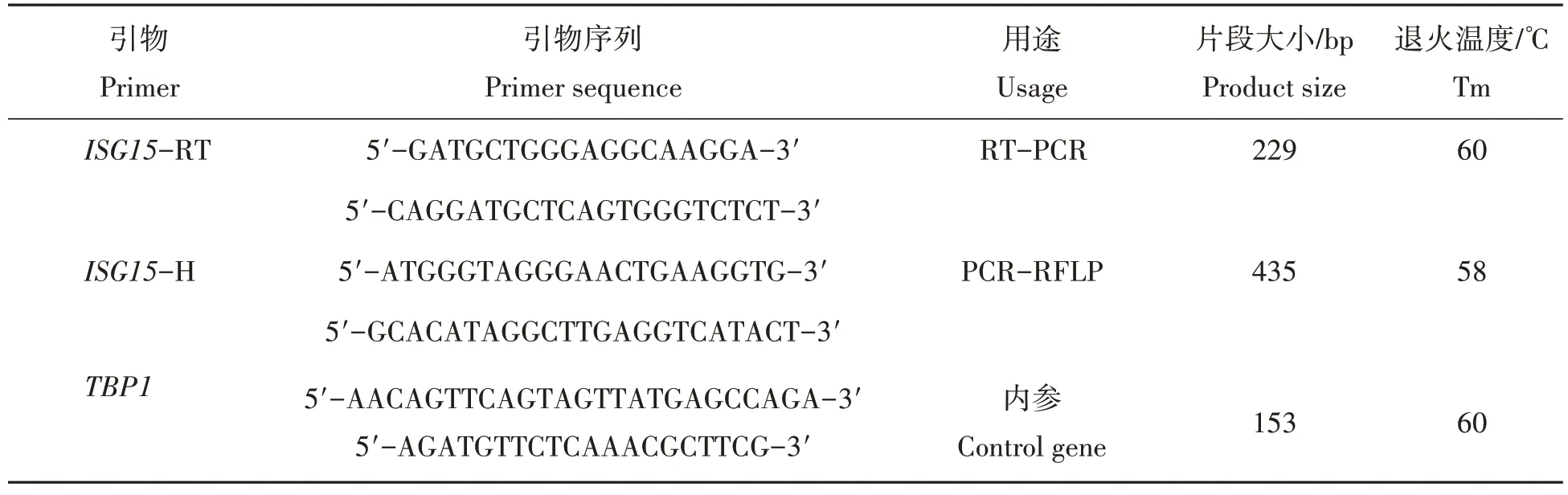
表1 引物信息Tab.1 The information of primer sequences
1.3 ISG15基因表达水平分析
样本RNA 的提取和cDNA 的制备按相关试剂盒说明书进行操作。随后以TBP1基因为内参进行荧光定量分析,相关扩增反应体系和反应程序参考周泉勇等[20]文章中方法进行。相对表达量计算采用2-ΔΔCt方法。
1.4 ISG15基因多态位点筛选及分型
分别以大白猪和梅山猪子宫内膜组织cDNA 为模板进行PCR 扩增,产物检测合格后,琼脂糖凝胶电泳回收并测序。测序结果应用DNAstar软件进行比对,筛选获得多态位点。以用于遗传多样性分析和关联性分析的DNA样本为模板,PCR扩增多态位点所在DNA序列,产物扩增检测合格后,65 ℃酶切消化过夜。酶切体系为10 μL,其中DNA 2.5 μL,HindⅢ1.0 μL,无核酸水6.5 μL。酶切产物经2%琼脂糖凝胶电泳后统计基因型。
1.5 数据统计分析
应用Excel 2016软件进行遗传多样性分析,分别计算5个品种的基因型频率、等位基因频率、群体平均杂合度、多态信息含量及Hardy-Weinberg 平衡卡方值。应用SPSS 19.0 软件进行关联性分析,采用双因素方差分析比较不同基因型母猪在繁殖性状方面的差异显著水平,其一般线性模型为:yi=μ+αi+pk+ei,其中yi为性状值,μ为总体平均数,αi为基因型效应值(i=GG,TG,TT),pk为胎次效应(按初产和经产划分),ei为随机误差。然后采用最小显著性差异法进行多重比较。
2 结果与分析
2.1 妊娠早中期子宫内膜和绒毛膜中ISG15基因表达水平分析
利用荧光定量PCR 方法检测妊娠早中期大白猪子宫内膜和绒毛膜组织中ISG15的表达水平,结果如图1 所示,子宫内膜中,ISG15在妊娠26 d 表达水平显著高于妊娠15 d 和50 d(P<0.01),在绒毛膜中,ISG15在妊娠26 d表达水平显著高于妊娠50 d(P<0.01)。
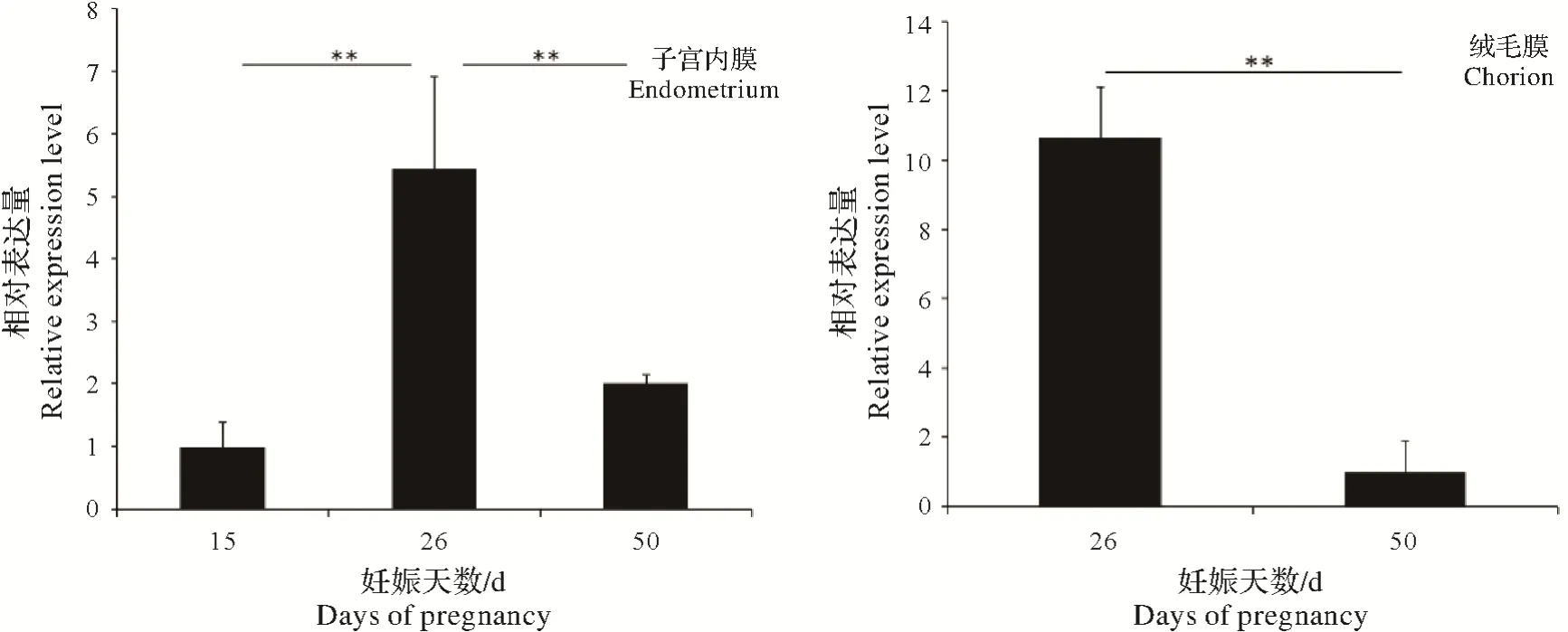
图1 不同妊娠时期子宫内膜和绒毛膜中ISG15基因的表达水平变化Fig.1 Expression of variation of ISG15 gene in endometrium and chorion at different pregnant stages
2.2 ISG15基因SNP位点筛选验证
对猪ISG15基因测序结果进行比对分析,结果如图2 所示,ISG15基因第二外显子中存在一个NM_001128469.3:c.301A>G 同义突变位点,该位点可被内切酶HindⅢ识别。进一步利用PCR-RFLP方法进行分型验证,结果如图3 所示,GG 基因型时酶切产物大小为435 bp,AA 基因型时酶切产物大小为225 bp+210 bp。

图2 猪ISG15基因c.301A>G位点测序结果(反义链)Fig.2 c.301A>G mutation in sequences of ISG15 gene(antisense)
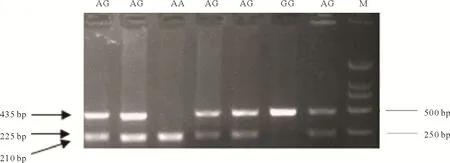
图3 猪ISG15基因c.301A>G多态位点酶切图Fig.3 c.301A>G mutation of ISG15 gene after digestion by HindⅢenzyme
2.3 ISG15基因c.301A>G位点遗传多样性分析
利用PCR-RFLP方法检测ISG15基因c.301A>G位点在5个猪群中基因型并进行统计分析,结果如表2所示,在大白猪、梅山猪、清平猪和通城猪群体中,c.301A>G 位点均处于Hardy-Weinberg 平衡状态。但在地方猪群体中,c.301A>G 位点以AA 基因型为主,A 等位基因为优势等位基因,且PIC 分别为0.09、0.09和0.26,多表现为低度多态。而在大白群体中,c.301A>G 位点以AG 基因型为主,等位基因A与G的基因频率无明显区别,且PIC为0.37,表现为中度多态。
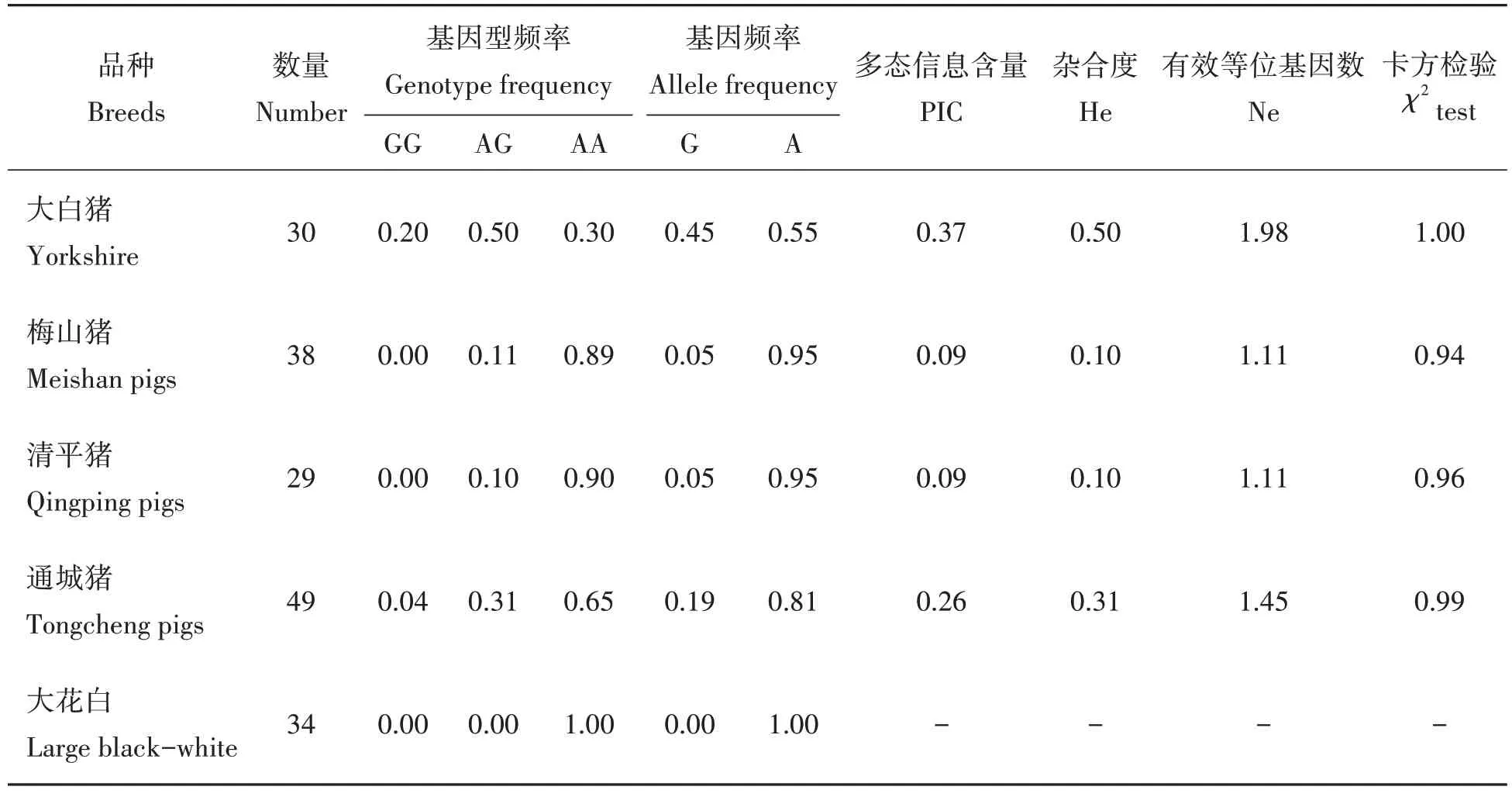
表2 ISG15基因c.301A>G位点在5个猪种中遗传多样性分析Tab.2 Genetic diversity analysis of c.301A>G mutation of ISG15 gene in five different pig breeds
2.4 ISG15基因c.301A>G位点与繁殖性状关联分析
利用PCR-RFLP 方法检测ISG15基因c.301A>G 位点在大白母猪群体中基因型并进行关联性分析,结果如表3 所示,初产大白母猪群体中,c.301A>G 位点GG、AG、AA 基因型母猪在产活仔数、总产仔数和初生窝重等性状中差异不显著(P>0.05)。而在经产大白母猪群体中,c.301A>G 位点3 种基因型对总产仔数和产活仔数性状影响显著(P<0.05),其中,AA 基因型母猪产活仔数和总产仔数最多,AG 基因型母猪产活仔数和总产仔数最少。

表3 c.301A>G位点基因型与繁殖性状关联分析Tab.3 Association analyses of c.301A>G polymorphism with reproduction traits
3 讨论
ISG15是一个经典的Ⅰ型干扰素刺激基因。研究显示,ISG15在人、鼠、牛、羊等多种哺乳动物妊娠早期子宫内膜中被诱导表达[21]。试验利用荧光定量PCR 方法检测ISG15在猪妊娠早期子宫内膜中表达水平,发现ISG15在妊娠26 d 中表达量显著高于妊娠15 d。显然,在猪妊娠早期,同样存在子宫内膜中ISG15诱导表达这一妊娠反应。Austin 等[22]研究发现,在牛子宫内膜中,细胞内ISG15出现于妊娠17 d,至妊娠23 d 表达达到高峰,随后至妊娠50 d 基本不表达。在羊中,同样发现ISG15在妊娠15~25 d 子宫内膜中高水平表达,随后表达水平急剧下降[23]。试验中,检测发现ISG15在猪妊娠26~50 d 子宫内膜中表达水平显著降低。这一结果与牛和羊中研究结果类似。妊娠早期子宫内膜中ISG15被诱导表达,暗示着ISG15在早期妊娠建立过程中发挥重要功能。在妊娠早期,胚胎和子宫互作并建立生理联系对妊娠建立至关重要[24]。此过程中,母胎界面表达一系列调控因子并相互作用,从而建立对话并传递信号是母胎互作的关键环节[25]。Passaro 等[26]通过构建胚胎与子宫内膜外植体共培养体系发现,囊胚期胚胎可有效刺激子宫内膜中ISG15的表达。Forde 等[27]研究表明,ISG15在妊娠期子宫内膜中的表达差异随着胚胎附植的发生而呈现。这些研究提示,ISG15可能是一个重要的胚胎-母体通讯基因。绒毛膜是母胎界面的重要组成部分。试验进一步检测ISG15在妊娠早中期绒毛膜中表达变化,发现其表达趋势与子宫内膜中表达趋势相同,均表现为妊娠26 d 高水平表达,而至妊娠50 d 低水平表达。ISG15在母胎界面中表达水平的动态性及一致性,说明ISG15的表达调控是母胎界面微环境中的一个重要组成部分,且可能在母胎互作中发挥着重要功能。
母猪产仔数的高低取决于妊娠期间胎儿的存活率[3]。已有研究表明,子宫内膜中ISG15基因表达丰度的改变参与调控妊娠早期胚胎的存活率[17-18]。相比于大白猪,中国地方猪普遍具有较高的窝产仔数。试验中,通过对ISG15基因c.301A>G 位点在中外猪种中遗传多样性分析发现,该位点A 基因频率在地方猪种中明显高于大白,且在地方猪种中以AA 基因型分布为主,而在大白中以AG 基因型分布为主。中外猪种中c.301A>G 位点多态性的差异分布初步表明ISG15可能是影响母猪产仔数性状的候选基因。在ISG15基因多态性研究方面,Huang 等[28]通过对ISG15基因c.347T>C 位点与长白猪初生重和血液免疫指标进行关联性分析发现,该位点多态性与初生重性状显著相关。试验中,在c.301A>G 位点,同样检测发现AA 基因型母猪所产仔猪的平均初生重均低于GG 基因型和AG 基因型母猪。以往研究显示,当初生重逐渐降低,母猪产活仔数呈上升趋势,且母猪产活仔数与初生重呈极强负相关[29]。研究进一步对c.301A>G 位点与大白猪群产仔数性状进行关联分析,结果显示,在初产和经产母猪中,c.301A>G 位点的AA 基因型母猪在产活仔数、总产仔数方面均高于GG 基因型和AG 基因型。虽然在初产母猪中差异不显著,这可能与初产母猪平均产仔数较低有关,但在经产母猪中,c.301A>G 位点与产活仔数、总产仔数存在显著关联(P<0.05)。该结果表明,在大白母猪群体中,AA 基因型母猪在产仔数性能发挥方面更具有优势。这也与c.301A>G 位点在中外猪种中遗传多样性分析相符合。ISG15基因可作为猪产仔数性状早期筛选的候选基因。
4 结论
ISG15基因在妊娠早期子宫内膜和绒毛膜中特异性高表达,暗示ISG15基因的表达水平变化是母胎界面微环境中的一个重要组成部分。ISG15基因c.301A>G 位点在中外猪种中的基因型差异分布及与产仔数性状的显著关联,表明ISG15对猪产仔数性状的早期选育具有一定参考意义。
致谢:江西省生猪产业技术体系(JXARS-01)和华中农业大学农业动物遗传育种与繁殖教育部重点实验室同时对本研究给予了资助,谨致谢意!
