两株不同J亚群禽白血病毒株诱发组织增生病变和细胞因子表达的比较
2022-07-07刘俊宏李宏梅王沫宇成子强邱建华侯秋玲郭慧君
刘俊宏,赵 月,李宏梅,王 莹,王沫宇,成子强,邱建华,侯秋玲,郭慧君
(山东省动物生物工程与疾病防治重点实验室 山东省畜禽疫病防治工程技术研究中心 山东农业大学动物科技学院,泰安 271018)
J亚群禽白血病病毒(ALV-J)为致病性较强的外源性禽白血病病毒亚群。该亚群毒株最早发现于20世纪 八十年代末肉种鸡骨髓瘤组织中,后被广泛报道于世界各地。我国最早在1999年从肉种鸡中分离检出ALV-J,其后在蛋鸡和地方品系鸡中也检测到ALV-J,由于其传播性、致病性、变异性较强,而被广泛关注。流行病学调查显示,该亚群毒株在中国地方鸡品系中感染率能达到60%,是所有ALV亚群中感染率最高的,每年给养鸡业带来严重的经济损失,是目前养鸡生产中最主要的防控对象。
早期发现ALV-J毒株主要诱发感染鸡只骨髓组织增生、免疫抑制等,如2001年从我国宁夏回族自治区分离到的ALV-J-NX0101毒株,无论是对SPF鸡还是商品肉鸡或蛋鸡均造成骨髓瘤、免疫抑制和生产性能下降等。但随后分离的毒株发现其组织嗜性增强,可造成更广泛的组织增生,2010年在我国山东杂交817肉鸡中分离到1株新型J亚群ALV毒株(ALV-J-SD1005),研究显示,在感染后10~14 d可诱发鸡只明显的纤维肉瘤。从早期骨髓瘤到快速纤维肉瘤,J亚群禽白血病病毒这种致病性变化一方面与病毒致病基因变异有密切关系,另一方面也与鸡体组织免疫因子、肿瘤生成因子表达差异密切相关,但该亚群毒株感染所造成鸡体组织细胞相关因子表达差异至今尚未见报道。
本研究利用ALV-J-NX0101毒株和ALV-J-SD1005毒株人工感染1日龄雏鸡,探究它们在诱发组织肿瘤和细胞因子表达方面存在的明显差异,这不仅能对两株病毒的致病特点有进一步的了解,也对病毒感染和肿瘤的早期诊断提供重要帮助。
1 材料与方法
1.1 毒株、细胞、试验动物和试剂
ALV-J NX0101毒株,山东农业大学崔治中教授馈赠;ALV-J SD1005毒株,山东农业大学孙淑红教授馈赠;DF-1细胞,购自北京IDEXX公司,用于病毒增殖。
ALV P27 抗原ELISA试剂盒和ALV-J抗体ELISA试剂盒购自北京IDEXX生物有限公司;超纯RNA提取试剂盒和FastQuant cDNA第一链合成试剂盒购自北京天根生化科技有限公司;UItraSYBR Mixture购自北京康为世纪生物科技有限公司;ALV-J特异性单抗由本实验室制备;FITC标记的羊抗鼠荧光二抗,购自SIGMA公司。
1日龄海兰褐鸡,购自泰安市海蓝种禽有限公司,经ALV抗原抗体ELISA试剂盒检测血清均为阴性者,用于动物试验病毒接种。
1.2 所用基因引物
根据已发表的基因序列,利用PrimerPremier5.0软件和基于GenBank序列的Oligo7.0软件设计引物用于鉴定ALV-J病毒和检测细胞因子的表达水平。本研究所用的引物序列均由山东瑞博生物技术公司合成。
1.3 动物试验
将75只血清P27抗原检测呈阴性的1日龄海兰褐鸡随机均分成3组:SD1005、NX0101和Control组,分别在每只鸡颈部皮下接种10TCID50的ALV-J-SD1005病毒液、10TCID50的ALV-J-NX0101病毒液和等量的无菌PBS盐水。对每只鸡进行编号,用金属腿标固定。全部试验鸡在干净、通风良好的标准试验环境条件下饲养,鸡只自由采食和饮水,饲料为泰安东岳种禽场的海兰褐蛋用雏鸡饲料。感染后7、14、21 d随机每组取6只鸡的翅静脉外周血,用于检测血液中病毒含量;剖杀后取颈部皮下组织用于检测病毒含量;取肝组织用于检测细胞因子的表达。试验过程中观察有无鸡只出现异常表现和死亡,对死亡鸡只进行病因分析和病原分离鉴定。该试验由山东农业大学动物福利与伦理学会批准(批准号:SDAU-2019-33),鸡只饲养和试验处理严格按照指定的要求规范操作。
1.4 肿瘤病变检测
感染后7、14、21 d统计SD1005感染组、NX0101感染组和Control组鸡纤维肉瘤和骨髓瘤发生情况和病变大小。计算肿瘤指数,肿瘤指数=(肿瘤重量/体重)*100%。
1.5 血液中病毒含量检测
翅静脉采集血液,收集血清,根据国家禽白血病检测标准(GB/T 36873—2018)用北京IDEXX 公司的ALV P27 抗原ELISA试剂盒检测病毒含量。操作步骤参照试剂盒说明书,简述如下:每孔加入100 μL待检血清样本,同时设置阴阳性对照,于37 ℃恒温箱中反应1 h后,用1×PBS液洗涤4次;每孔加入酶标抗体100 μL,37 ℃恒温孵育1 h,孵育完毕后用1×PBS液洗涤4次;每孔加入预混的显色物100 μL,37 ℃恒温孵育15 min,孵育完毕后,每孔加入终止液50 μL,并于OD波长检测其吸光度值,计算病毒含量,即: (样品OD值-阴性对照OD值)/(阳性对照OD值-阴性对照OD值)。
1.6 荧光定量RT-qPCR检测组织中病毒含量
采集鸡颈部皮下纤维组织,应用超纯RNA提取试剂盒提取细胞RNA后,用核酸分析仪测定提取细胞RNA的OD/OD及其质量浓度,并将提取的RNA稀释至工作质量浓度。再应用FastQuant cDNA第一链合成试剂盒将细胞RNA反转录为cDNA,反转录条件为:45 ℃ 15 min;72 ℃ 3 min终止反应,获得的cDNA保存于-20 ℃。以细胞cDNA为模板,利用表1中对应ALV-J毒株基因引物进行RT-qPCR检测病毒mRNA含量。使用SYBRPrimeScriptRT-PCR试剂盒(TaKaRa,中国大连),按照其说明书进行,反应体系为:含有2×UltraSYBR混合物, 100 nmol·L上游引物, 100 nmol·L下游引物和1 μL cDNA。反应条件为:预变性95 ℃ 10 min,延伸95 ℃ 15 s 和 60 ℃ 60 s循环40次,熔解95 ℃ 15 s, 60 ℃ 60 s,95 ℃ 15 s。
1.7 相关细胞因子mRNA的RT-qPCR分析
通过RT-qPCR检测细胞因子mRNA的表达。qPCR分析采用LightCycler96(德国罗氏诊断有限公司),使用SYBRPrimeScriptRT-PCR试剂盒(中国大连TaKaRa)并按照其说明书进行操作,以鸡甘油醛-3-磷酸脱氢酶()基因作为内参,检测鸡5、7、-、-、1、25、14-3-3、53的转录本水平。各基因引物参照表1列出的对应引物,反应体系为:含有2×UltraSYBR混合物,100 nmol·L上游引物, 100 nmol·L下游引物和1 μL cDNA。反应条件为:预变性95 ℃ 10 min,延伸95 ℃ 15 s和60 ℃ 60 s循环40次,熔解95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s。
1.8 数据统计分析
所有数据均以“平均值±标准差”表示,组间差异用ANOVA软件进行分析,然后进行多重比较的Student-Newman-Keuls检验。<0.05为差异显著;<0.01为差异极显著;>0.05为差异不显著。

表1 本试验中所用引物及其基因序列登录号
2 结 果
2.1 两株ALV-J毒株致肿瘤病变发生明显不同
为对比ALV-J急性致纤维肉瘤毒株与慢性致骨髓瘤毒株在感染过程中的差异,相同剂量的ALV-J-SD1005毒株和ALV-J-NX0101毒株分别人工感染雏鸡,感染后7、14、21 d统计体重、死亡率及肿瘤发生等病变情况,结果见表2。感染两株ALV-J病毒后,雏鸡生长速度减缓,机体出现消瘦,感染后21 d,ALV-J-SD1005组鸡体重较对照组下降18.13 %,ALV-J-NX0101组下降6.96 %,表明急性致纤维肉瘤毒株较慢性致骨髓瘤株毒株导致更严重的生长性能下降。
统计肿瘤病变发现,ALV-J-SD1005组肿瘤最早出现于感染后第10天,第14天全部鸡只出现肿瘤,经病理组织学检测均为纤维肉瘤(结果未显示),所产生的肿瘤随感染时间增加肿瘤重量和指数逐渐增大(图1和表2)。到21 d,肿瘤重量和肿瘤指数平均值分别达到74.5 g和34.4%,并且有58.3%(7/12)鸡只出现死亡;而对ALV-J-NX0101组感染鸡只剖检和病理组织检测未出现组织增生等病变(图1、表2),表明两株病毒的致肿瘤病变有明显不同。
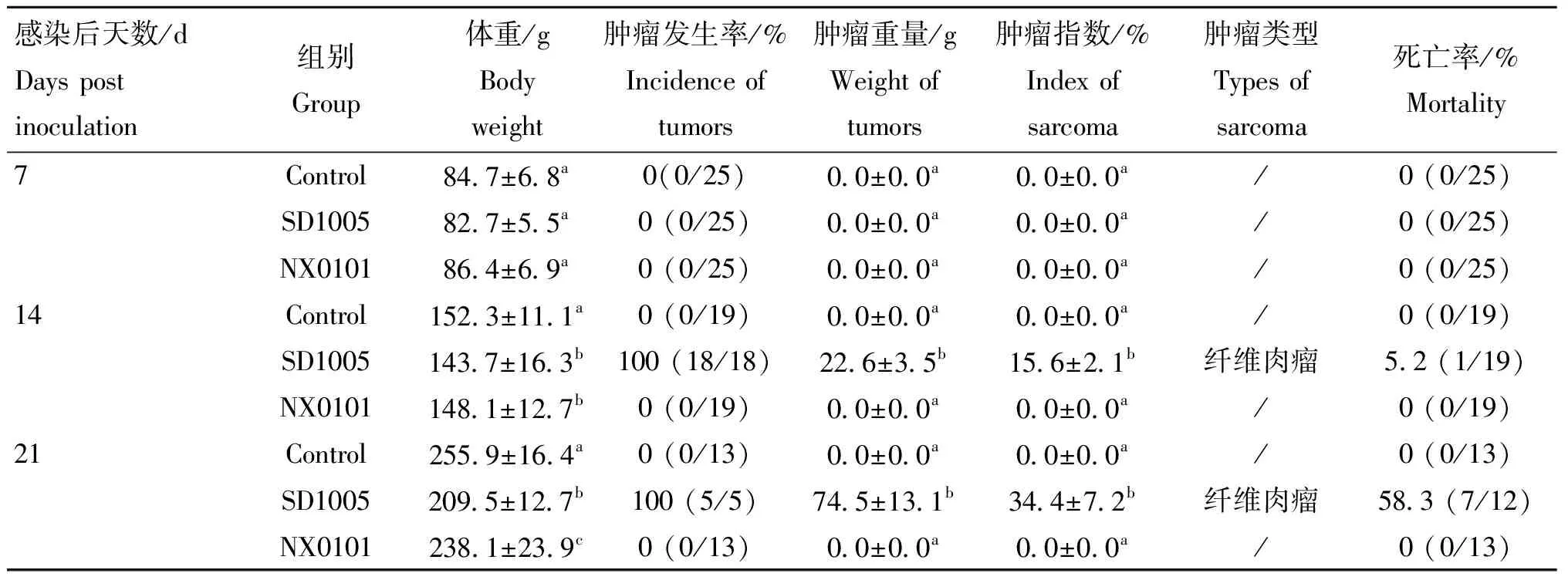
表2 两株ALV-J毒株感染雏鸡后不同时间病变比较
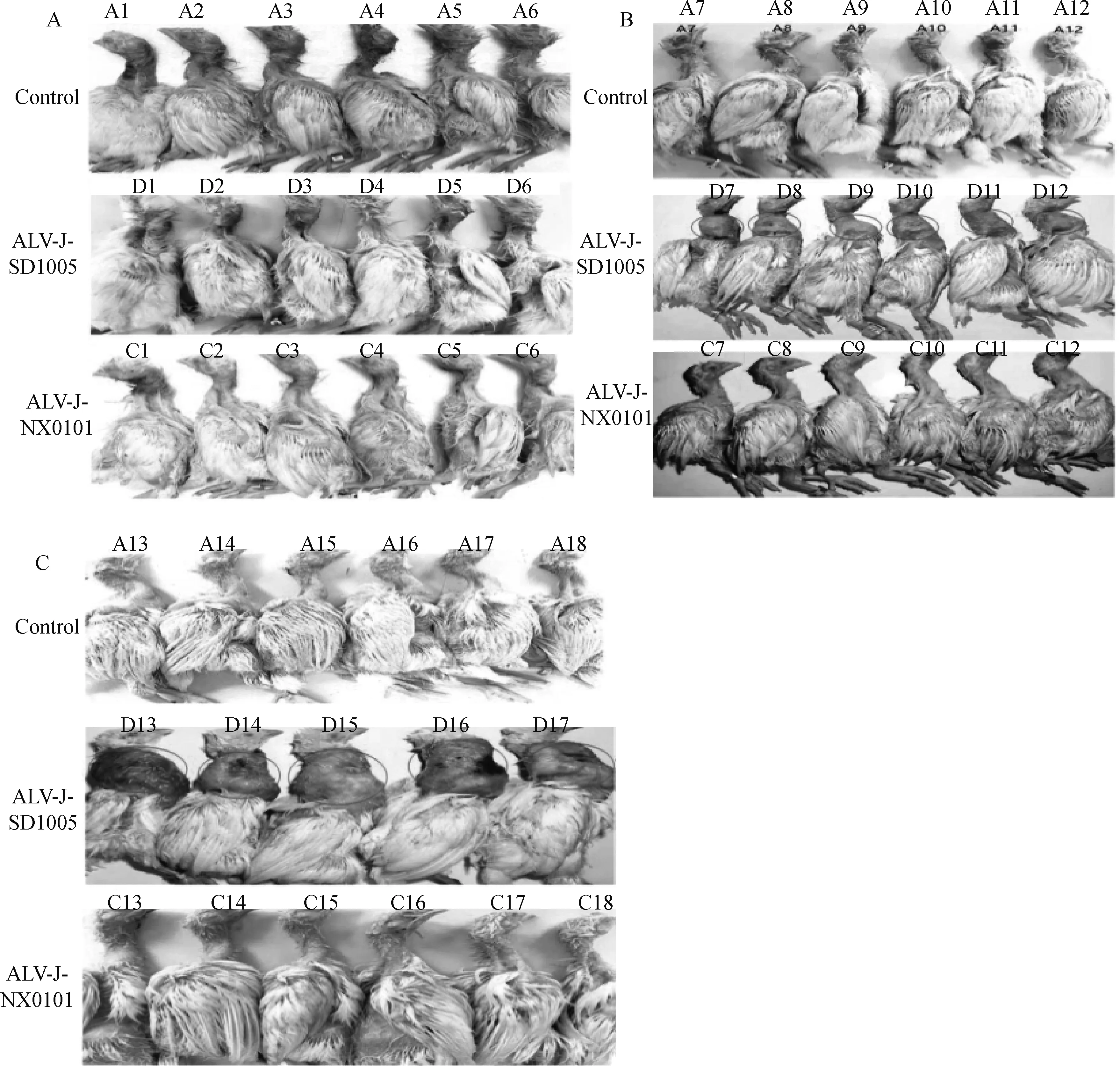
图1 两株ALV-J毒株感染雏鸡后7 dpi(A)、14 dpi(B)和21 dpi(C)肿瘤病变比较Fig.1 Comparison of tumors caused by two ALV-J strains at 7 dpi(A), 14 dpi (B)and 21 dpi(C)
2.2 两株ALV-J毒株在感染鸡组织内增殖能力存在差异
2.2.1 病毒血症 对感染后7、14、21 d的全部鸡只采集血液,用ALV P27抗原检测ELISA试剂盒检测病毒血症,结果见图2。结果显示,相较对照组,感染后7 d ALV-J-SD1005组和ALV-J-NX0101组鸡只血液中病毒含量显著增加;14和21 d两组鸡只血液内病毒均快速增多,达到较高水平;而ALV-J-SD1005组病毒含量较ALV-J-NX0101组有进一步增加趋势,但统计差异不显著。表明两株ALV-J病毒感染雏鸡均可导致严重的病毒血症。

不同小写字母表示组间差异显著(P<0.05),相同小写字母表示组间差异不显著(P>0.05)。下同The different letters indicate statistically significant differences among groups (P<0.05). The same letters indicate no statistically significant differences among groups (P>0.05). The same as below图2 两株ALV-J毒株感染雏鸡后不同时间病毒血症比较Fig.2 Comparison of viremia caused by two ALV-J strains in chickens at different DPI
2.2.2 鸡颈部纤维组织病毒含量 对感染病毒后的鸡只颈部皮下纤维组织检测病毒载量,结果如图3。发现感染病毒后7、14、21 d ALV-J-SD1005组鸡皮下纤维组织病毒载量急剧升高,而ALV-J-NX0101组增加缓慢,与ALV-J-SD1005组之间存在明显区别,表明两株病毒在鸡体组织细胞内增殖能力存在明显差别。

图3 两株ALV-J毒株感染雏鸡后不同时间颈部皮下纤维组织病毒载量Fig.3 Viral loads of ALV-J in cervical subcutaneous fibrous tissue of the infected chickens at different DPI
2.3 I型干扰素及其相关基因的动态表达
利用荧光定量检测法对ALV-J感染雏鸡肝组织中I型干扰素及其相关基因进行检测,结果如图4。 鸡5基因的表达在ALV-J-SD1005毒株感染初期7~14 d显著提高,后期(21 d)下降但仍高于对照组;而在ALV-J-NX0101病毒感染后显著被抑制,持续至21 d。鸡7基因的表达变化与鸡5趋于一致,即在ALV-J-SD1005毒株感染后7~21 d均显著提高,在ALV-J-NX0101病毒感染后被显著抑制。
I型干扰素基因-和-的表达在ALV-J-SD1005和ALV-J-NX0101两株病毒感染后大都呈现表达抑制的变化,所不同的是-和-基因在ALV-J-SD1005感染后14 d出现异常升高。上述结果可以看出,两株病毒感染所诱发的鸡先天性抗病毒反应明显不同,这对两株病毒增殖和致病差异具有特定意义。

图4 两株ALV-J感染雏鸡后不同时间鸡MDA5(A)、IRF7(B)、IFN-α(C)、IFN-β(D)基因的动态表达Fig.4 Dynastical expressions of MDA5 (A), IRF7 (B), IFN-α (C), IFN-β (D) genes in two ALV-J infected chickens at different DPI
2.4 细胞增殖相关基因的动态表达
利用荧光定量检测法对感染雏鸡肝中肿瘤增殖相关基因进行检测,发现ALV-J-SD1005组和ALV-J-NX0101组鸡25在感染后7 d表达显著降低;而在14和21 d,ALV-J-SD1005组表达出现显著升高,ALV-J-NX0101组始终处于较低水平,显著低于对照组和ALV-J-SD1005组(图5A),结合先前纤维肉瘤检测结果,推测这可能与纤维肉瘤快速增生有关。
与对照组相比,转化相关蛋白53基因在两株病毒ALV-J-SD1005和ALV-J-NX0101感染后7 d没有得到显著表达,随着感染时间延长,ALV-J-SD1005组53基因表达得到显著提高,而ALV-J-NX0101组始终没有明显变化;到21 d两组间出现极为明显的差异,而ALV-J-NX0101组与对照组53基因表达始终处于较低的水平,且两组间没有显著差异(图5B)。
肿瘤增殖基因14-3-3的表达在ALV-J-SD1005和ALV-J-NX0101两株病毒感染后出现下降趋势,但ALV-J-SD1005组得到更为显著的抑制,在感染后14和21 d均显著低于ALV-J-NX0101组,而ALV-J-NX0101组14-3-3的表达出现前期显著降低,后期恢复的变化(图5C)。
抗肿瘤基因1的表达在ALV-J-SD1005和ALV-J-NX0101两株病毒感染后出现明显不同,ALV-J-SD1005组在感染后7至21 d没有出现明显变化,而ALV-J-NX0101组感染后7 d表达量显著升高,至21 d维持较高的表达水平(图5D)。
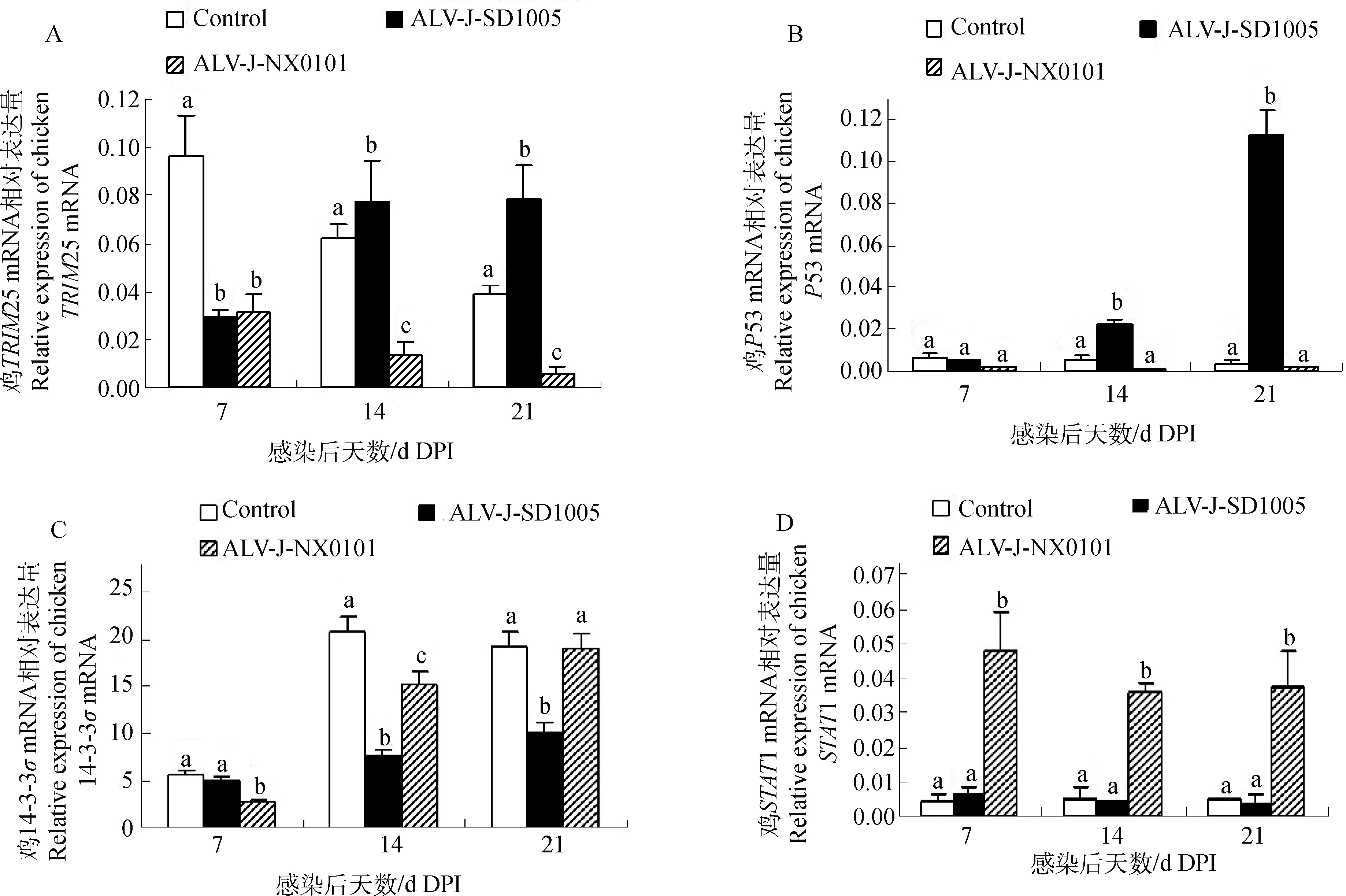
图5 两株ALV-J感染雏鸡后不同时间鸡TRIM25(A)、P53(B)、14-3-3σ(C)、STAT1(D)基因的动态表达Fig.5 Dynastical expressions of TRIM25 (A), P53 (B), 14-3-3σ (C), STAT1 (D) genes in ALV-J infected chickens at different DPI
3 讨 论
ALV-J-NX0101毒株是2001年从宁夏父母代种鸡场分离的毒株,大量人工致病试验表明,该毒株可引起生长滞缓、免疫抑制和髓样细胞瘤,但肿瘤发生时间较长,一般在感染60 d后。ALV-J-SD1005毒株是2011年报道的从山东地方“817”肉鸡中分离的致纤维肉瘤J亚群ALV毒株,该毒株与早期报道的ALV-J毒株具有明显不同的致病特点:发病急、产生肿瘤快,以纤维组织增生为主,病毒含有肿瘤基因等,因而早期诊断和预防尤为关键。本研究利用该毒株与早年分离的ALV-J-NX0101毒株进行感染比较,发现两个毒株在致肿瘤病变程度、肿瘤产生时间、生长滞后和死亡率方面存在较大差异,显示ALV-J-SD1005毒株更强的致病性和危害性。血液和皮下纤维组织病毒含量检测发现ALV-J-SD1005毒株在两种组织中含量更高,显示其比经典ALV-J-NX0101毒株具有更快的病毒复制能力。相对这些致病特点和病毒特征变化,更令人感兴趣的是感染鸡只先天性免疫反应和抗肿瘤反应发生怎样的改变?因为它们可以为该病的诊断和防治提供新的思路。
I型干扰素包括-/是机体重要抑制病毒复制的免疫因子,其产生和含量高低决定机体对病毒复制抑制能力高低。研究发现,病毒感染过程中会诱发I型干扰素反应,其中5介导的7/信号通路在鸡-诱生过程中发挥重要作用。通过动态监测57/-/发现,两株病毒除ALV-J-SD1005毒株14 dpi致-和-升高外,在整个试验期均导致感染鸡只-/显著下降,为病毒的快速复制提供有利条件;而5/7的表达却呈现不同的差异:ALV-J-NX0101毒株导致5/7表达显著下调,而ALV-J-SD1005毒株却出现显著上调,前者的变化可能与病毒感染抑制I型干扰素生成反应有关,后者除受病毒感染直接作用外,还受25表达变化的影响。
25既是一种先天性抗病毒免疫分子,也是细胞周期调控关键因子。它通过自身泛素化连接酶活性,调控多个靶蛋白的生物活性和功能。哺乳动物中的研究表明,25可通过对RNA病毒识别受体RIG-I蛋白发生K63泛素化而激活I型干扰素生成反应。尽管在鸡体内没有RIG-I受体,但另一种受体MDA5蛋白可以代替RIG-I受体从而介导I型干扰素生成。本课题组前期通过构建鸡25过表达质粒和RNA干扰质粒进行转染试验发现,25参与ALV-A感染诱发的I型干扰素生成反应,这种反应与5介导的信号通路有关。在本研究中,发现鸡25的表达在ALV-J-NX0101毒株感染过程中被显著抑制,5、7、-/均亦显著降低,显示25也参与ALV-J-NX0101毒株诱发的5介导的I型干扰素生成反应。而在ALV-J-SD1005毒株感染过程中25的表达出现前期显著降低、后期显著升高的变化,这可能与25在ALV-J-SD1005毒株致纤维肉瘤产生过程中的调节作用有关。
哺乳动物中的研究发现,25可通过对14-3-3蛋白发生K48泛素化而使14-3-3蛋白发生降解、解除细胞分裂G2期抑制,促进细胞增殖。有研究报道表明,在人乳腺癌、子宫内膜癌、肺癌的形成和发展过程中25出现显著表达,体外试验证实25过表达有助于这些癌细胞的分裂增殖。本研究发现,25在ALV-J-SD1005毒株致纤维肉瘤产生过程中(14~21 dpi)表达显著升高,而抑癌基因14-3-3的表达显著下降,53基因的表达显著升高,推测正是ALV-J-SD1005毒株所致纤维肉瘤的产生和/或生长诱导鸡25的高表达,一定程度上影响了5、7等的高表达。而25在纤维肉瘤产生过程中的高表达及其作用,值得进一步关注。这将为阐释ALV-J致肿瘤产生机制、探索新的诊断标识提供新的思路。
4 结 论
ALV-J-NX0101毒株感染后21 d内出现病毒快速增殖,但未见组织增生病变;25、5、7、-/基因表达显著下降,1基因表达显著升高,53基因变化不明显,14-3-3前期表达降低、后期变化不明显。而ALV-J-SD1005毒株能够诱发感染鸡只纤维组织快速增生、病毒快速复制,纤维组织增生过程(14~21 d)中25、53、5和7基因的表达显著升高,14-3-3、-基因的表达显著下降。本研究为深入理解ALV-J病毒感染和致瘤机制、探索ALV-J感染新分子诊断标识提供重要科学依据。
