双组分调控系统介导革兰阴性菌耐药的作用机制
2022-07-07于永峰董文豪邹荣华吴晓妮宫晓炜陈启伟
于永峰,权 衡,董文豪,邹荣华,吴晓妮,宫晓炜,陈启伟
(中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046)
近年来,由于抗生素、饲料添加剂、消毒剂在畜牧生产中的过度使用,很多养殖场已成为耐药菌和耐药基因的重要贮库。这不但加剧了动物源性耐药菌的产生与传播,而且严重危害了我国畜牧业的健康快速发展。出于对人病兽防,关口前移政策的理解,遏制食品性和食源性动物源耐药菌株的传播路径已十分迫切。大肠杆菌(,)、肠炎沙门菌(Enteritidis,. Enteritidis)、肺炎克雷伯菌(,)、铜绿假单胞菌(,)、鲍曼不动杆菌(,)、鸭疫里默氏杆菌(,)等都是临床上已知重要的革兰阴性致病菌,广泛存在于养殖场、屠宰场以及生肉商场等地。这些细菌经常能够单独或者混合感染牛、猪、鸡、鸭等,从而导致动物出现严重的腹泻、流产、呼吸困难及神经症状。据报道,在我国的广西、河南和兰州等地区,已连续多年从畜禽体内分离到这些菌株的耐药株,甚至是多重耐药菌株(multidrug-resistant,MDR)或泛耐药菌株(the emergence of pan-drug-resistant,PDR)。此外,在作者的前期研究中还发现可能是替加环素耐药基因() 的天然存储库。这表明,携带抗生素耐药基因的“超级细菌”已经严重危害了畜牧业的发展,同时给临床治疗带来了巨大的挑战,导致出现无药可用的窘境和跨物种传播的风险,必须引起人们的高度重视。
目前已知的革兰阴性菌的抗生素耐药性可以通过多种机制产生(图1)。这些机制大致可分为两类:内在的抗性和获得性的抗性。内在的抗性机制包括:改变细菌外膜通透性、脂多糖的修饰和自身外排泵的活化等;而获得性抗性机制则涉及抗性基因的水平转移、质粒或转座子介导的修饰酶基因的获取等。这些耐药机制广泛存在于临床常见的致病菌中,其中,大部分机制都直接或者间接受双组分调控系统(two-component regulatory systems,TCS)的调节。TCS是细菌维持胞内平衡的重要机制之一,几乎存在于所有细菌内,使细菌能够感知环境的变化并作出相应的反应。虽然大部分TCS的作用是发起对简单刺激的响应,例如营养限制、氧气浓度改变、磷酸盐限制、渗透压改变等,但依然存在很多TCS能够直接或间接降低细菌对抗生素的敏感性。那么TCS是如何感知抗生素并调控相应基因表达的?这些基因又是怎样介导细菌耐药的?就此,本文从TCS的基本结构和调控机理、TCS在革兰阴性菌产生耐药过程中的调控作用进行综述,这对于阐明革兰阴性菌耐药机制及开发新的防治药物具有重要意义。
1 经典TCS的基本结构和调控机理
经典的TCS由一对相互作用的蛋白质组成,这包括一个存在于膜上的感受器组氨酸激酶(histidine protein kinase,HK)和一个存在于细胞质的反应调节蛋白(response regulator protein,RR)。当然,除了典型的TCS,很多细菌内还存在各种各样非典型的TCS,而这些非典型的TCS中HK和RR并非是唯一的,例如弗朗西斯菌属中的QseC和QseB/PmrA,其不同于经典的TCS,这里的HK是QseC,而RR是QseB和PmrA。无论是经典的TCS还是非经典的TCS,其中,HK都是一种跨膜蛋白,而且几乎所有的HK都含有2个跨膜区(TM1、TM2)。此外,在HK的N-端有一个能感受外界信号的输入区,在C-端有一个由约250个氨基酸残基组成的转导区,该区具有磷酸激酶的功能,其磷酸化位点一般是保守的His残基(H)。这些结构域由一系列跨膜螺旋连接,跨膜螺旋的数量因TCS而异。此外,转导区中还含有5个由5~10个氨基酸残基组成的高度保守区。一般认为,当受到外界环境的某种刺激时,HK会使其互作蛋白RR发生磷酸化,进而激活或阻遏靶基因。不仅如此,HK还能使与其相关联的RR蛋白表现出磷酸酶活性,从而使RR蛋白去磷酸化。TCS中已发现的RR已有400多种,同源性分析表明,这些RR之间具有20%~30%的相似性。它们的N-端都含有一个约由110个氨基酸组成的信号接收区,其中,有一个保守的天冬氨酸残基(Asp)是发生磷酸化的位点。RR的C端是具有某种输出或效应器活性的结构域,称为输出区。在信号转导的过程中,由HK自磷酸化产生的磷酸集团会被转移到RR保守N端结构域的Asp残基上,从而激活RR可变C端的输出结构域,使其通过结合靶基因的启动子来调节基因的表达(图2)。通过这种磷酸化信号传导通路,细菌能够有效地感知周围环境的变化(营养、pH、渗透压、抗生素等),从而使其能够对动态环境进行快速、高效的反应。
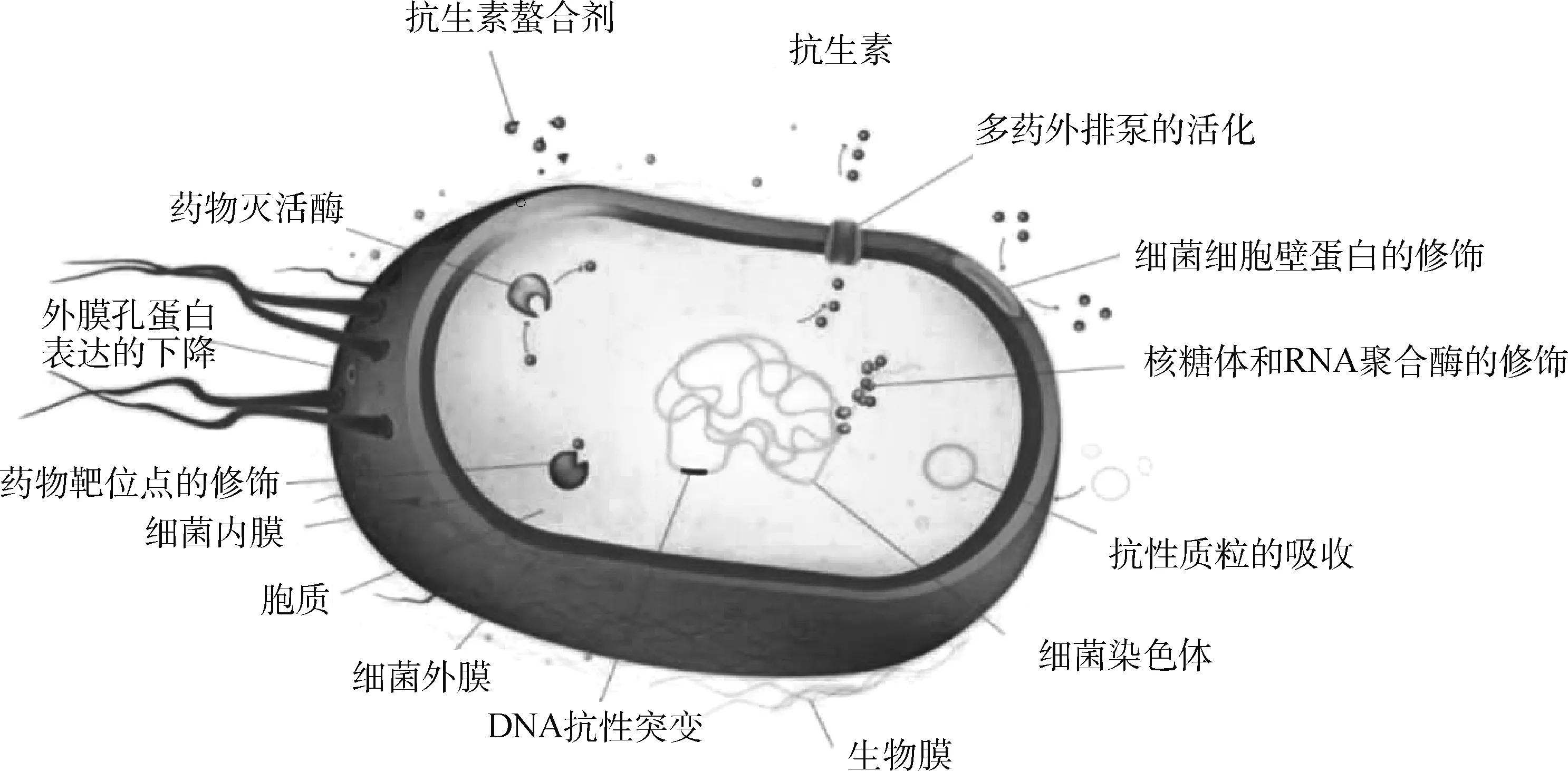
图1 革兰阴性菌的关键耐药机制[16]Fig.1 Key resistance mechanisms in gram-negative pathogenic bacteria[16]
2 TCS在革兰阴性菌产生耐药性过程中的作用
大多数情况下,TCS会直接对抗生素作出反应,如自身外排泵(efflux pump, EP)的活化等。而少数情况下TCS会参与到环境骤变或其他压力刺激的调节中,导致细胞生理变化,从而间接使细菌对抗生素产生抗药性。研究数据表明,TCS参与革兰阴性菌耐药性生成的主要机制包括外排泵的活化、生物被膜(biofilms,BF)的形成、外膜孔蛋白(outer membrane porin, OMP)扩散通道的减少、脂质A(lipid A)的修饰等(图3)。例如,在中,PmrA/PmrB在抗生素的刺激下能够调节lipid A的磷酸乙醇胺修饰,经过修饰的lipid A会让细菌表面的负电荷减少,从而使多黏菌素无法结合到细菌表面;EvgA/EvgS能够使编码MDR外排泵的基因上调数百倍,让对阿奇霉素的抗性提高64倍;CpxA/CpxR可以改变膜的通透性,下调OMP的表达,减少药物流入等。此外,. Enteritidis中RcsC/RcsB可参与荚膜多糖生物合成、调控III型分泌系统、调节主要菌毛蛋白MrkA的产生以及赋予菌体抵抗低pH环境的能力等。
2.1 TCS调控细菌外排泵的活化
细菌外排泵(bacteria efflux pump,EPs)是存在于细菌外膜上的一组转运蛋白。到目前为止,已经发现了八种与细菌耐药相关的外排泵:ABC(ATP结合盒)超家族转运蛋白、MATE(多药及毒性化合物外排家族)、AbgT(对氨基苯甲酰-谷氨酸转运蛋白)、RND(耐药-结节-分化)家族、DMT(药物/代谢物转运蛋白超家族)、SMR(小型多重耐药家族)、MFS(主要易化子超家族)和PACE(蛋白细菌抗菌化合物外排)。EP所转运的底物可单一,也可以多种多样,即可以专一地外排一种底物,也可以排出多种不同的物质。所以,当抗生素入侵到细菌内部时,EP就会被激活,激活后的EP可以识别并向胞外特异性的排出一种或多种抗生素,从而使菌株产生耐药性。

图2 双组分调控系统(TCS)信号传导基本过程Fig.2 The basic process of signal conduction in two-component regulatory systems
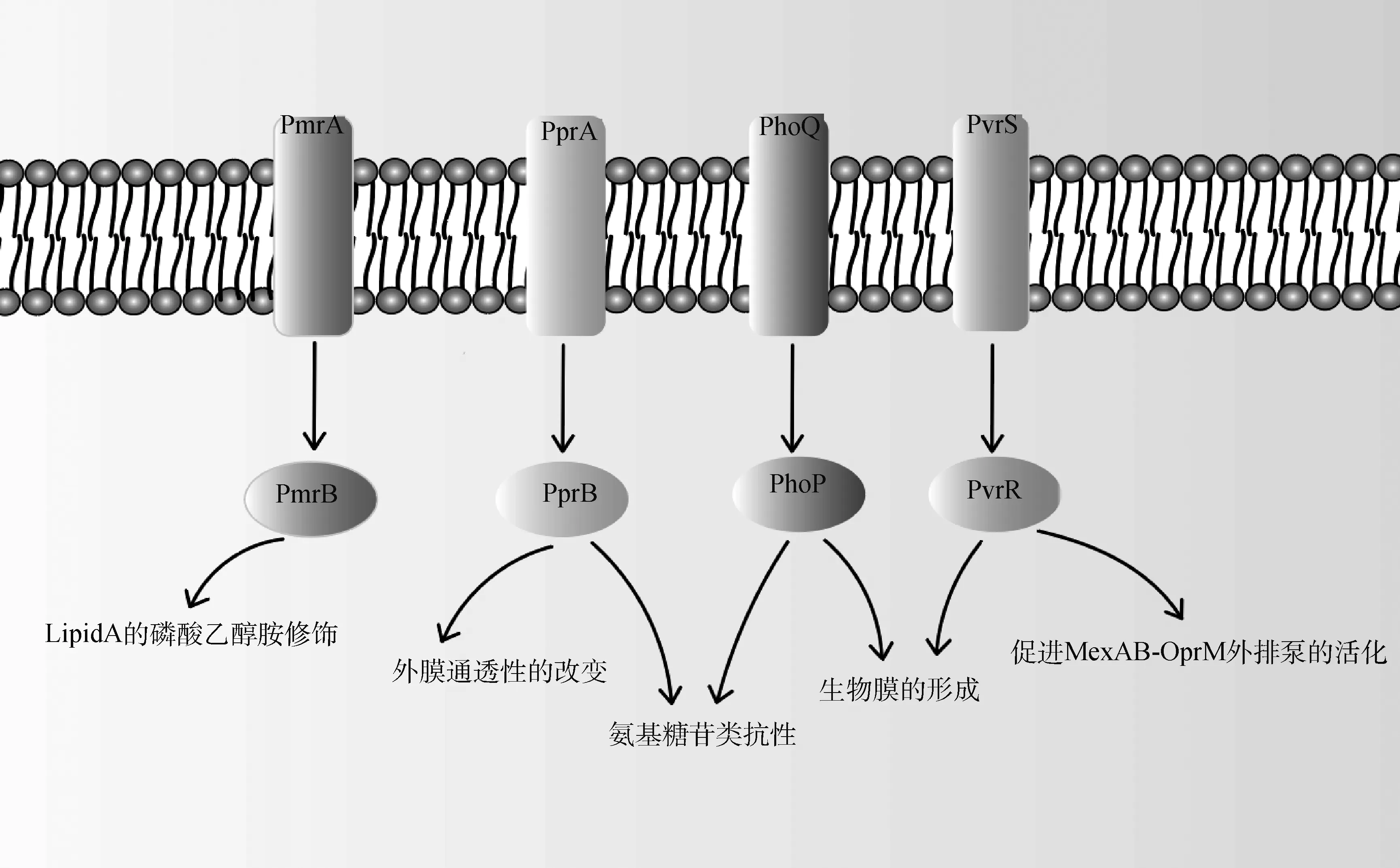
图3 双组分调控系统(TCS)在促进细菌耐药形成过程中的作用Fig.3 The role of the two-component regulatory systems in promoting the formation of bacterial resistance
2004年,Marchand等首次在中发现AdeR/AdeS能够调节AdeABC多药耐药性EP的产生。在AdeR/AdeS中,AdeS是该菌adeABC操纵子表达所必需的基因,而adeABC正是编码RND、MDR外排系统的基因。此外,通过对比AdeR/AdeS缺失株的转录数据后发现,adeABC的表达量发生了明显的下降。同时,AdeR/AdeS缺失株对亚胺培南(imipenem)、卡那霉素(kanamycin)、庆大霉素(gentamycin)、环丙沙星(ciprofloxacin)、四环素(tetracycline)、替加环素(tigecycline)、氯霉素(chloramphenicol)和溴化乙锭(ethidium bromide)的MIC值也都出现了显著降低。除此之外,中的EvgA/EvgS和YhiU/YhiV;Enteritidis 中的CusS/CusR和BaeS/BaeR等TCS都与EP的活化相关(见表1)。据报道,有超过10%的细菌基因组中存在大量编码EP的基因,EP的广泛存在表明它是细菌产生耐药性的重要原因之一。在鼠伤寒沙门菌中,BaeS/BaeR可以通过正向调控靶基因、、、、和的转录表达,并直接调控marR的表达,从而影响菌株对氟喹诺酮类药物的耐药性。同时,EP的过表达还是抗微生物治疗过程中频繁失败的标志之一。正如上面所提及的,TCS能够广泛参与到EP过表达的调控中,所以说TCS在调控细菌EP活化的过程中发挥着重大作用。
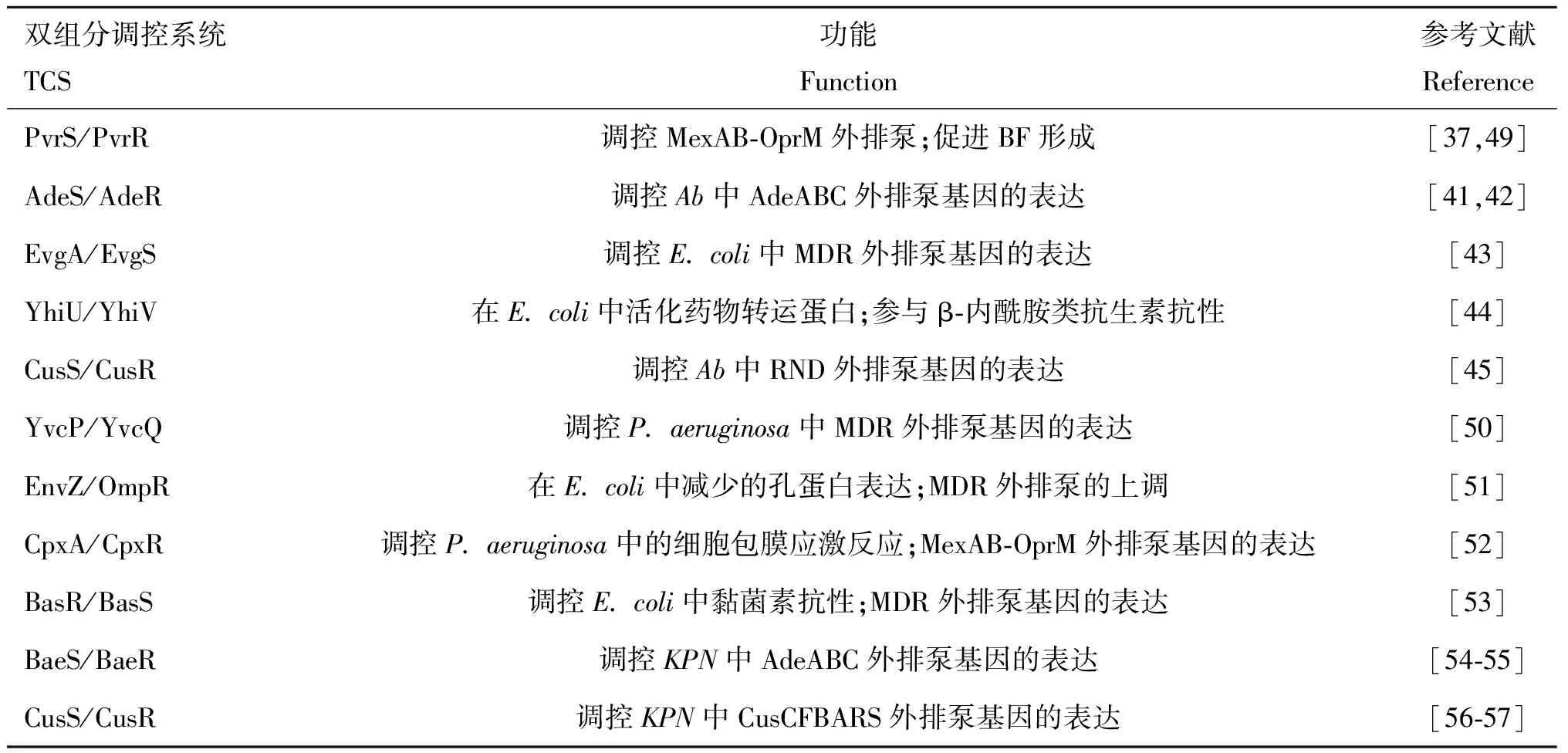
表1 介导活化EPs的TCS
2.2 TCS调控细菌外膜Lipid A的修饰
临床中常见的带正电荷的抗生素,如多黏菌素B(polymyxin B)、黏菌素(colistin)、氨基糖苷类(aminoglycosides)以及宿主阳离子抗菌肽 (cationic antimicrobial peptide,CAMP),它们的杀菌机制主要是利用其自身的正电荷与革兰阴性菌外膜上带负电荷的Lipid A通过静电作用结合,导致膜破裂,使得药物或肽进入细菌。然而,为了在杀菌压力中存活下来,病原菌采取了相应的抵抗机制。比如,细菌可以通过Lipid A 的共价修饰来逆转这种状态。经过Lipid A的修饰,其外膜带正电荷,可降低或消除抗生素的作用。而修饰Lipid A的3种最常见方式是添加4-氨基阿拉伯糖 (L-Ara4 N)、磷酸乙醇胺 (PEtN) 或棕榈酸。其中棕榈酸修饰仅会降低膜流动性,并不影响电荷。
TCS在Lipid A的修饰中起主要调控作用。在许多革兰阴性细菌物种中,如、、等,存在着两种经典的修饰Lipid A的TCS,即PhoP/Q和PmrA/B。这两对TCS在不同的革兰阴性菌中对Lipid A进行修饰的途径不同。比如,虽然PhoQ均是位于内膜中的HK,能够在低浓度的Mg或聚阳离子肽的存在下被激活,进而激活PhoP。在. Enteritidis中,激活后的PhoP可以进一步激活PmrA/B,进而分别激活pmrCAB和arnBCADTEF-pmrE操纵子,从而添加PEtN和L-Ara4 N以修饰Lipid A。而在中,arnBCADTEF-pmrE操纵子可以由PhoP或PmrA/B直接激活。此外,PmrA/B还能够通过感知低pH或高Fe水平,独立于PhoP/Q而激活。中PmrA/B的高表达可使编码Lipid A磷酸乙醇胺转移酶的pmrC转录增加30倍。不仅如此,PhoP 还可以激活pagB,这是一种编码棕榈酰转移酶的基因,通过添加棕榈酸来修饰Lipid A。
虽然TCS对Lipid A的修饰(如表2)让很多革兰阴性菌获得了对带正电荷抗生素的抗性,增加了临床治疗的难度,但在该修饰过程中众多细节值得深入挖掘并利用。比如,上述提及的修饰机制大多是由修饰酶来完成的,而这些修饰酶大多为膜蛋白, 其活性位点多存在于细菌外膜的外侧或者周质,这就使得以这些修饰酶为靶点开发相应的药物成为可能。此外,Lipid A除了是维持革兰阴性菌细胞外膜渗透性屏障的主要组分,同时也是内毒素的活性成分。这使得Lipid A可以成为一种很好的免疫激活因子,这为Lipid A成为免疫佐剂提供了可能。

表2 介导LPS修饰的TCS
2.3 TCS调控细菌OMP扩散通道的减少
细菌能够通过调控孔蛋白和外排泵的表达来调节许多分子的进出。其中,孔蛋白也称为外膜蛋白(OMP),是嵌入革兰阴性细菌OMP中的β-桶状蛋白,允许分子的被动扩散。孔蛋白还充当噬菌体和细菌素的受体,并与肽聚糖和LPS一起在维持细菌细胞的完整性方面发挥重要作用。因此,OMP表达水平的改变,进而导致外膜通透性的改变,已成为革兰阴性菌产生MDR机制的主要原因。也正因为临床常见的β-内酰胺类(beta-lactam antibiotics)、氨基糖苷类、碳青霉烯类(carbapenems)和氟喹诺酮类(fluoroquinolones)等亲水性抗生素都是通过孔蛋白进入细胞的。因此,通过TCS下调孔蛋白的表达,可以有效减少药物渗透,从而降低细菌对多种抗生素的敏感性。
一般认为33~36 ku的外膜蛋白(Omp33-36)可作为水通道。此前有学者对碳青霉烯类抗生素具有抗性的JC10/01菌株进行分析,发现该菌株有Omp33-36的缺失。此后,通过过表达该菌株中Omp33-36,发现该蛋白能够明显降低JC10/01菌株对亚胺培南和美罗培南(meropenem)的MIC,这印证了OMP对耐药性的产生至关重要。
EnvZ/OmpR,是一对存在于、和等革兰阴性菌中经典的TCS。在这个TCS中,EnvZ主要通过感知渗透压变化而调节OmpR,从而根据环境中某些化学物质的水平调节OMP孔蛋白OmpC和OmpF的表达水平。已发现这些OMP表达水平的降低可使得多种革兰阴性菌对β-内酰胺类抗生素产生高水平抗性。除此之外,在中,CzcR/CzcS和CopR/CopS能够响应环境中金属离子的存在。其中CzcS感应锌、钴、镉和铜金属离子,CopS感应铜金属离子;CzcR和CopR能够抑制OrpD孔蛋白的表达,从而导致耐β-内酰胺类抗生素的的广泛产生和大流行,使得在治疗该细菌感染时,效果不理想。的两种TCS,即CpxA/CpxR和PhoB/PhoR,它们也能抑制KpnO孔蛋白的表达,从而降低包括氯霉素、阿米卡星、萘啶酸和四环素在内的抗生素的敏感性。
OMP除了与细菌的毒力和代谢密切相关之外,它还是细菌引起机体免疫反应的重要免疫刺激物。这使得当TCS调控OMP表达量下降后,不仅使菌株变得耐药,还会在一定程度上使菌株更难被免疫系统识别和清除。所以说,TCS调控所带来的耐药菌株的危害并不仅仅是在耐药性方面。
部分调控细菌OMP的TCS见表3。

表3 调控细菌OMP的TCS
2.4 TCS调控细菌BF的形成
BF是附着于有生命或无生命物体表面被细菌胞外大分子包裹的有组织的细菌群体,是许多细菌感染治疗的主要障碍。这种结构对于细菌生存至关重要,它可以在一定程度上保护细胞免受环境影响、抵消内部高膨胀压力、充当渗透屏障,还可以将信息从细胞周围环境最终传输到其内部的基因组中。
现有数据显示,有的TCS(表4)在感受到外界特异性刺激信号后能够上调编码BF的基因,从而促进BF生成。例如中的SagS/SagR、BfiS/BfiR、BfmS/BfmR和MifS/MifR等。在该调控机制中,SagS通过接收浮游状态下的细菌特异性信号,进而将信号传递给BF特异性的TCS BfiS/BfiR,从而促进与菌体附着相关的微调控RNA RsmZ的表达,并实现最初依附到BF发展进程的转变。此外,在这个级联调控机制中,SagS可以通过激活第2个TCS,即BfiS/BfiR,促进微调控RNA RsmZ的表达,从而实现完成BF从附着期到扩散期的发育过程。上述的4对TCS的缺失使得的BF在3个不同的发育阶段被终止。其中,SagS和BfiS的缺失让BF的形成停滞于附着阶段,而BfmR和MifR的缺失让BF分别在其发育成熟的Ⅰ和Ⅱ阶段停滞。
此外,中的GacS/GacA也是BF形成必不可少的,不同于其他的TCS,GacS不能发生自磷酸化,必须由传感器激酶RetS激活,RetS能够对GacS起到激酶和磷酸酶的作用。除此之外还有很多TCS也能间接地参与到BF的生成过程中,比如Rcs/Pvr、PprA/PprB和PilR/PilS,它们能够调节IV型菌毛的表达,而这些菌毛是表面黏附和BF形成的先决条件。副猪嗜血杆菌和双基因缺失后,形成生物被膜的能力明显弱于野毒株。生物被膜作为细菌生长的一种自我保护状态,它的表达在很大程度上影响着细菌的毒力和生存能力。同时,由于TCS在生存过程中的调控作用,使得BF的形成获得了更高的灵活性,增加了菌株应对环境刺激的能力。而目前抗细菌BF的药物仍未达到预期的治疗效果。
3 讨 论
TCS是细菌适应外界环境或宿主内环境的自身调节机制,这是一个自动的、智能的调节过程。有研究表明,自动调节会导致“短期记忆”或“学习行为”。这意味着一旦细菌曾经感知过某一刺激信号,就会形成对该刺激的记忆,并且在随后的暴露接触中对信号作出更快或更广泛的反应。此外,虽然TCS的自动调节机制既能促进基因表达,也能抑制基因表达。但是,在常见的革兰阴性菌中,促进机制较常见,较少有抑制机制,该现象可能与细菌受外界刺激信号的类型相关。
细菌内部存在的TCS的种类很多,如表3所列,同一种TCS,如 PmrA/PmrB,在不同的细菌中发挥着相同的调控作用,而CusS/CusR,却在不同细菌中发挥着相近而又不相同的生物学功能。同时,图3表明有的TCS涉及两个或多个完全不同的生理过程,不同的TCS之间还会存在垂直或者水平的调控机制,使得该机制在细菌内形成了一个结构复杂的调控网络。在所统计的TCS之外,还有很多未发现的或者功能未验证的TCS,在作者前期研究中发现,所产生耐药现象并不都是因为菌株携带耐药基因或药物靶位点的突变导致,而是存在另外的一些耐药机制来协同发挥作用的。当添加两种外排泵抑制剂(CCCP和PAβN)后,将与不同种类的抗生素相互作用,利用q-RT-PCR检测菌株中外排基因与抗生素的相关性,发现在菌株中主要存在RND和MFS两种发挥作用的外排泵系统。比较基因组学分析后发现染色体中存在三对假定的TCS(296_08465296_0847、296_05850296_05845、296_06485296_06480),通过缺失株的构建及MIC检测,发现TCS (296_06485296_06480)与的耐药紧密相关。

表4 介导BF形成的TCS
虽然上文提及的TCS能够介导细菌多种类型的耐药机制,使得耐药现象更加普遍。但是,以组氨酸为基础的TCS作为细菌内部长期稳定存在的调控机制,与真核细胞内以丝氨酸或苏氨酸为基础的信号传导系统有很大的不同。同时,很多不同种属的细菌中存在结构和功能高度同源的TCS。TCS的这些特点为其在未来成为抗细菌药物靶位点提供了可能,并且可以同时对多种细菌产生杀伤作用。其次,由于TCS能够在细菌内形成复杂的调控网络,所以针对于TCS的药物不仅能够针对一条调控途径,还能够通过广泛影响调控网络从而在整体上影响细菌活性。再次,细菌内存在很多直接或间接受TCS调控的抗性基因,所以靶向TCS药物还可以作为很好的辅助治疗药物。虽然目前尚未报道成熟的以TCS为靶位点的药物,但科学家们在对TCS中的RR DNA结合域、自磷酸化位点以及ATP结合域的研究中所取得的进展,为这一想法实施提供了坚实的基础。
总之,细菌TCS的发现, 加深了人们对微生物体内复杂调控网络的理解。当然,TCS中还存在很多未知而又神秘的地方等待人们去探索。同时,笔者相信在不久的未来,一定可以通过对TCS的深入研究来实现造福人类的美好愿望。
