改良恶性风险指数联合哥本哈根指数鉴别诊断卵巢肿瘤良恶性的价值
2022-07-06李小利刘传金徐博雁
李小利 潘 志 刘传金 徐博雁
卵巢肿瘤临床症状无特异性,常规超声早期检出率仅15%,但早期生存率可达90%,晚期5 年生存率仅28%,严重威胁女性生命健康[1-2]。因此,早期准确诊断卵巢恶性肿瘤至关重要。恶性风险指数(RMI)是基于超声、癌抗原125(CA125)水平及绝经状态联合计算的预测模型,对卵巢肿瘤具有一定鉴别诊断价值[3]。文献[4]报道,改良RMI 可进一步提高卵巢肿瘤的鉴别价值。哥本哈根指数(CPH-I)是基于CA125 水平、人附睾蛋白4(HE4)及年龄联合计算的卵巢恶性肿瘤风险预测模型[5]。本研究通过探讨改良RMI联合CPH-I在卵巢肿瘤良恶性鉴别诊断中的价值,以期为临床早期诊断及鉴别诊断提供参考。
资料与方法
一、临床资料
选取2017 年10 月至2020 年10 月我院收治的经手术病理证实的206例卵巢肿瘤患者,根据病理结果分为良性组152例和恶性组54例。恶性组患者年龄21~76岁,平均(52.25±4.69)岁,体质量指数(BMI)18~28 kg/m2,平均(23.12±3.56)kg/m2;病理Ⅰ、Ⅱ、Ⅲ、Ⅳ期者分别为8、12、30、4例;淋巴结转移者10例,未转移者44 例,肿瘤最大径5~15 cm,平均(8.75±2.17)cm;绝经31 例,未绝经23 例。良性组患者年龄20~75岁,平均(51.08±4.12)岁;BMI 18~28 kg/m2,平均(23.45±3.62)kg/m2,肿瘤最大径4~13 cm,平均(7.24±1.97)cm;绝经83例,未绝经69例。排除妊娠期及哺乳期妇女、合并其他恶性肿瘤者及双侧卵巢切除者。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.超声检查:使用西门子Acuson Sequoia 彩色多普勒超声诊断仪,经腹部探头频率2.5~6.0 MHz;经阴道探头频率5.0~9.0 MHz。患者同时行经阴道及经腹部超声检查。①经阴道超声检查:嘱患者排空膀胱,取截石位,探头缓慢置入阴道穹窿,观察子宫、附件区与盆腔壁腹膜脏器表面转移结节存在情况。②经腹部超声检查:适度充盈膀胱,依次显示子宫、双附件区,观察有无腹水,以及大网膜、腹腔、腹膜其他脏器表面是否存在转移灶。记录患者是否存在双侧病变、多房囊性、实性部分、腹盆腔游离液体,以及腹盆腔有无转移征象。以上每项记1分,各项累加为超声评分。
2.RMI 计算方法[6]:①RMI1=超声分数(U)×M×CA125,其中超声评分为0 分时U=0,超声评分为1 分时U=1,超声评分≥2 分时U=3;绝经前M=1,绝经后(距离末次月经时间≥1 年或年龄≥50 岁的子宫切除患者)M=3;RMI2=U×M×CA125,其中超声评分为0分或1分时U=1,超声评分≥2 分时U=4;绝经前M=1,绝经后M=4;③RMI3=U×M×CA125,其中超声评分为0分或1分时U=1;超声评分≥2 分时,U=3;绝经前M=1,绝经后M=3;④RMI4=U×M×CA125×肿物直径(S),其中超声评分为0 分或1 分时U=1,超声评分≥2 分时U=4;绝经前M=1,绝经后M=4;肿瘤最大径<7 cm 时S=1,肿瘤最大径≥7 cm 时S=2。当RMI1、RMI2、RMI3均>200,RMI4>450时判为恶性。
3.改良RMI 计算方法:对RMI1、RMI2、RMI3、RMI4 中鉴别诊断价值最高的指数进行改良,改良RMI=(U+R)×M×CA125×S,其中R 为血流评分,记为0~5分,分别对应肿瘤内无血流、0.55≤血流阻力指数(RI)<1.00、0.50≤RI<0.55、0.45≤RI<0.50、0.40≤RI<0.45、RI<0.40[7]。改良RMI>190时判为恶性。
4.实验室检查:采集患者空腹肘静脉血,CA125、HE4 水平均使用ELISA 法进行检测(试剂盒由深圳新产业生物医学有限公司提供),严格按照说明书操作。CPH-I=-14.0647+1.0646×log(HE4)+0.6050×log(CA125)+0.2672×年龄/10,预测概率值>7%判为恶性[5]。
5.联合诊断标准:改良RMI 与CPH-I 中任意一项诊断为恶性判为恶性;两项均诊断为良性判为良性。
三、统计学处理
应用SPSS 22.0 统计软件,计数资料以例或率表示,采用χ2检验。一致性分析采用Kappa检验。P<0.05 为差异有统计学意义。
结 果
良恶性卵巢肿瘤超声图像见图1,2。
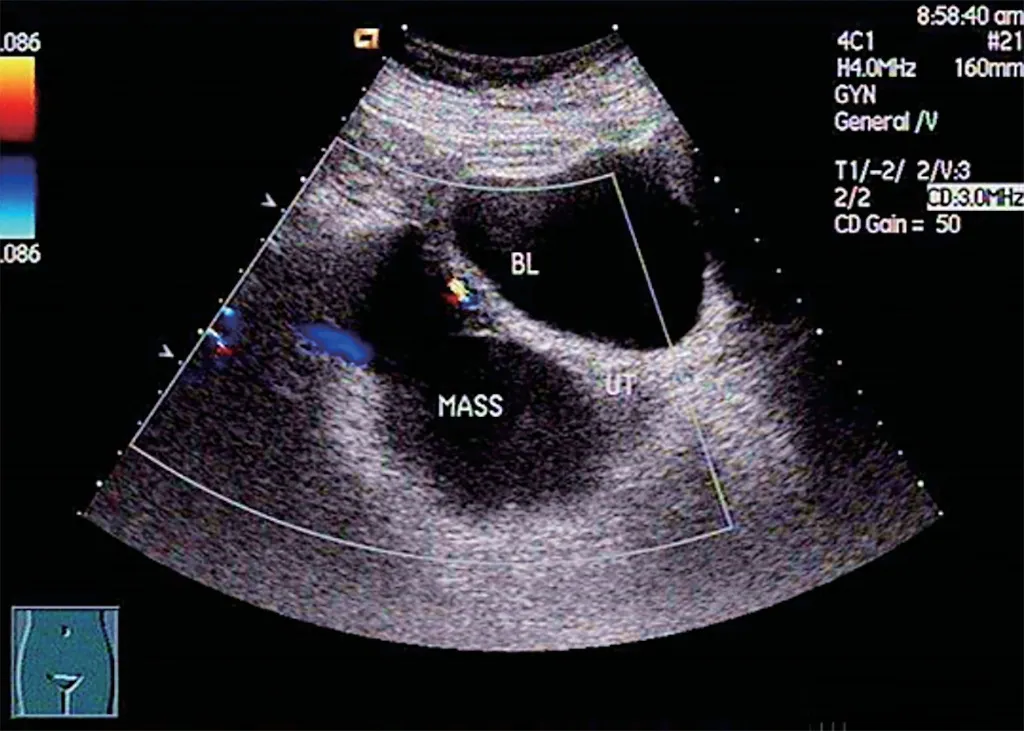
图1 卵巢良性肿瘤声像图示形态规则,边界清晰,包膜完整(MASS:肿瘤;BL:膀胱;UT:子宫)

图2 卵巢恶性肿瘤声像图示形态不规则,边界模糊,包膜不完整,内部可见融合性团块(MASS:肿瘤)
一、RMI对卵巢肿瘤良恶性的诊断
RMI1 准确诊断卵巢肿瘤恶性42 例,良性107 例;RMI2 准确诊断恶性43 例,良性109 例;RMI3 准确诊断恶性42 例,良性109例;RMI4准确诊断恶性44例,良性111例;与病理结果的一致性均一般(Kappa=0.402、0.431、0.418、0.460,均P<0.05)。见表1。
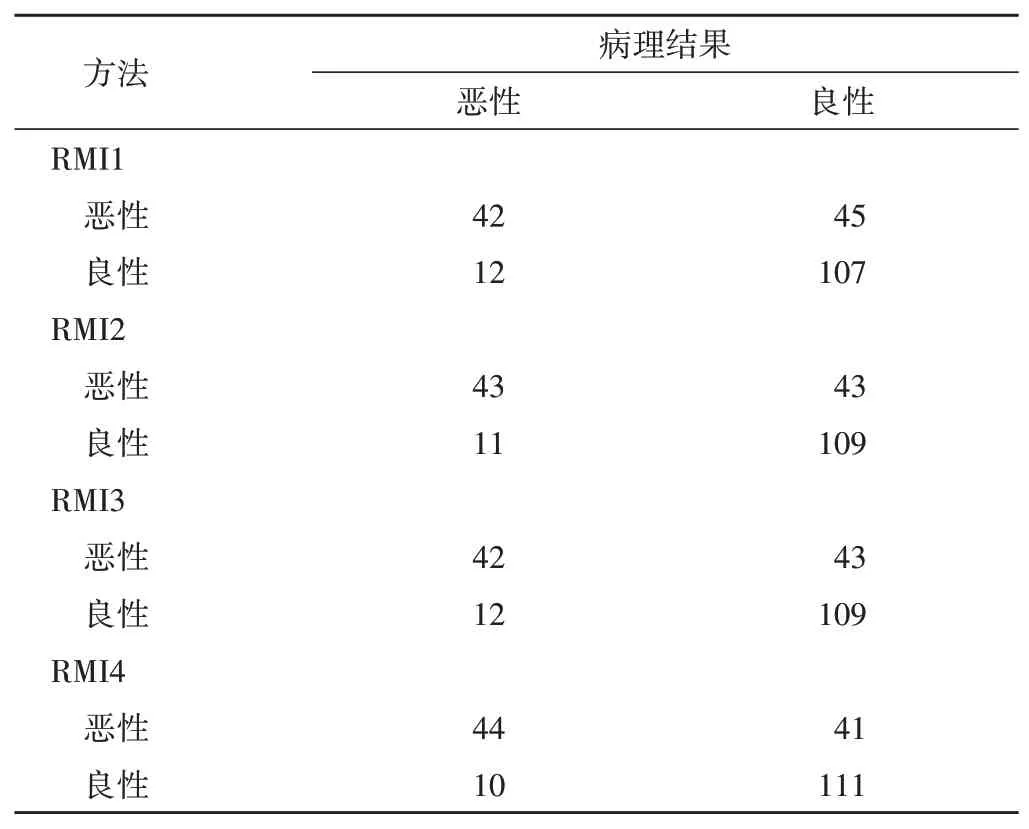
表1 RMI对卵巢肿瘤良恶性的诊断结果 例
二、RMI对卵巢肿瘤良恶性的鉴别诊断价值比较
以病理结果为金标准,RMI4 鉴别诊断卵巢肿瘤良恶性的敏感性、特异性、阳性预测值、阴性预测值及准确率均最高。见表2。

表2 RMI对卵巢肿瘤良恶性的鉴别诊断价值比较 %
三、改良RMI、CPH-I单独及联合对卵巢肿瘤良恶性的诊断结果
对诊断价值最高的RMI4 进行改良,结果显示改良RMI 准确诊断卵巢肿瘤恶性48 例,良性136 例;CPH-I 准确诊断恶性46例,良性136例;改良RMI联合CPH-I准确诊断恶性50例,良性139 例,与病理结果的一致性均较好(Kappa=0.739、0.713、0.798,均P<0.05)。见表3。

表3 改良RMI、CPH-I单独及联合对卵巢肿瘤良恶性的诊断结果 例
四、改良RMI、CPH-I 单独及联合对卵巢肿瘤良恶性的鉴别诊断价值比较
以病理结果为金标准,改良RMI 联合CPH-I 鉴别诊断卵巢肿瘤良恶性的敏感性、特异性、阳性预测值、阴性预测值及准确率均最高,与其单独应用比较差异均有统计学意义(均P<0.05)。见表4。
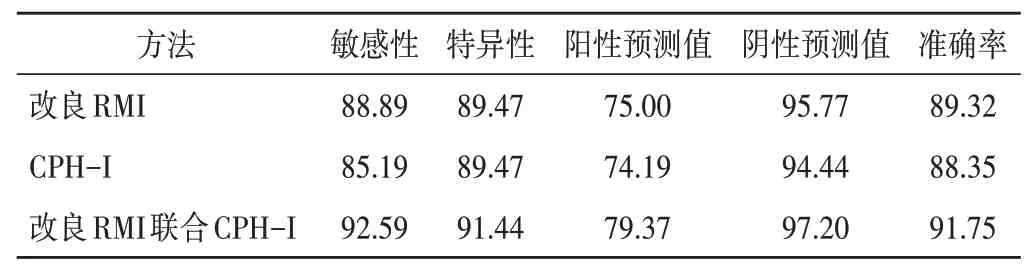
表4 改良RMI、CPH-I单独及联合对卵巢肿瘤良恶性的鉴别诊断价值比较 %
讨 论
卵巢隐匿于盆腔深处,病变早期临床症状(腹胀、消化不良、腰痛等)无特异性,进展至晚期症状逐渐明显,但缺乏有效治疗方法,严重威胁女性生命健康。超过60%的卵巢肿瘤患者发现时已为晚期,而晚期5 年生存率仅28%[8]。目前临床关于卵巢恶性肿瘤的发病原因尚未明确,但多认为可能与遗传及内分泌因素有关。手术切除、放化疗等综合治疗方法虽对卵巢癌的扩散及转移具有一定作用,但预后差,且预后与卵巢癌的临床分期、治疗程度、病灶残留及转移均密切相关。超声检查、肿瘤标志物检测及临床资料评估等均对卵巢肿瘤良恶性的诊断有一定参考价值,但仍存在较多误诊及漏诊情况[9]。为进一步提高卵巢肿瘤良恶性的早期诊断准确率,有学者[10]将超声、肿瘤标志物水平、绝经状态及患者年龄进行联合提出了卵巢恶性肿瘤风险预测模型。RMI 是基于超声、CA125 水平及绝经状态联合计算的预测模型,其对卵巢恶性肿瘤的预测及诊断价值已经证实[11]。但有文献[12]指出,绝经后卵巢恶性上皮肿瘤发生率高,彩色多普勒超声显示恶性肿瘤血流速度及阻力较均低。因此在RMI 基础上结合血流阻力指数进行改良可一定程度提高其诊断价值。本研究结果显示,RMI1、RMI2、RMI3、RMI4 对卵巢肿瘤良恶性鉴别均具有的一定诊断价值,但与病理结果的一致性均一般(Kappa=0.402、0.431、0.418、0.460)。为进一步提高RMI 对卵巢肿瘤良恶性的诊断价值,本研究对诊断价值最高的RMI4 进行改良,结果显示,改良RMI 鉴别卵巢肿瘤良恶性的敏感性、特异性分别为88.89%、89.47%,与病理结果的一致性较好(Kappa=0.739,P<0.05)。提示改良RMI诊断卵巢肿瘤良恶性的价值更高。
CPH-I 是基于血清CA125 水平、HE4 水平及患者年龄联合计算得出的预测模型。于甜甜等[13]研究指出,CPH-I基于两种肿瘤标志物水平及年龄对卵巢肿瘤良恶性进行综合评估,具有独立于超声及绝经状态评估的优势,且在临床应用中更方便。本研究结果显示,CPH-I 与改良RMI 对卵巢肿瘤良恶性的诊断价值基本相当,虽然改良RMI和CPH-I对卵巢肿瘤良恶性的诊断价值较高,但仍存在假阳性及假阴性现象,分析可能原因与彩色多普勒超声显示恶性肿瘤血流速度及阻力较低,以及血清CA125水平特异性有关[14]。因此,本研究进一步将改良RMI和CPH-I 联合应用鉴别卵巢肿瘤良恶性,结果发现联合应用的诊断敏感性、特异性、准确率分别为92.59%、91.44%、91.75%,均高于单独应用(均P<0.05),且与病理结果的一致性较好(Kappa=0.798,P<0.05),提示联合诊断的价值更高。
综上所述,基于超声征象的改良RMI联合CPH-I对卵巢肿瘤良恶性的鉴别诊断具有较好价值,但本研究为单中心回顾性研究,且样本量较小,今后仍需进一步行多中心、大样本量、前瞻性研究验证。
