急性心肌梗死患者经皮冠状动脉介入治疗后远期主要不良心血管事件预测模型的构建
2022-07-05李琴檀鑫姜文溪袁梦倪慧王媛杜杰
李琴,檀鑫,姜文溪,袁梦,倪慧,王媛,杜杰*
急性心肌梗死(acute myocardial infarction,AMI)是冠心病的严重类型,也是导致冠心病患者死亡、残疾主要原因[1-2]。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是 AMI患者的主要治疗方法。多项研究证明,尽管PCI可改善AMI患者的远期预后,但主要不良心血管事件发生风险仍然很高[3-4]。2017年欧洲心脏病学会(EsC)《急性sT段抬高型心肌梗死指南》[5]及2020年EsC《非sT段抬高型急性冠脉综合征指南》[6]均建议应用风险评分对AMI患者进行风险分层,早期风险分层对于最佳二级预防药物的选择具有重要意义[7]。目前预测AMI患者主要不良心血管事件的风险模型主要为全球急性冠状动脉事件注册(global registry of acute coronary events,GRACE)评分,包括年龄、收缩压、心率、入院就诊时是否有心搏骤停、心电图sT段偏移、心功能Killip分级、肌酐、心肌酶8个指标,而其虽然包含肌酐与心肌酶两种生物标志物,但仍缺乏反映体内炎症和氧化应激等与疾病病理、生理相关的实验室检查指标,其预测准确性不足以制订出患者个性化的管理策略[8]。因此,需要联合多种生物标志物并从各方面综合评估AMI患者的预后,从多角度解释组织或器官损伤状态及病理机制,进一步提高预后风险评估的准确性[9-10]。本研究通过评估并整合AMI患者PCI后发生远期主要不良心血管事件的危险因素,构建简单且有效的个性化风险预测模型对患者进行早期风险分层,从而制订个性化的管理策略,以期改善AMI患者远期预后,提高患者生存率,降低患者主要不良心血管事件发生率。
本研究创新性:
(1)依托于中国最大的心血管疾病临床数据库之一,纳入大样本量的急性心肌梗死(AMI)患者,因此本研究队列的人群更具有代表性,研究结果更具有普适性;(2)本研究为了筛选反映患者个体化预后的指标,采用了Lasso回归筛选出与远期主要不良心血管事件密切相关的病理生理学指标。与既往常用的逐步向前或向后回归相比,Lasso回归具有更强的过滤能力,能更好地识别影响AMI患者经皮冠状动脉介入治疗(PCI)后预后的关键变量;(3)与全球急性冠状动脉事件注册(GRACE)评分相比,新预测模型的优点在于纳入的变量更少、预测效能更好,更适合在中国临床诊疗中推广;(4)本研究依据AMI患者随访2.4年期间的数据,构建的新模型可用于识别远期主要不良心血管事件高危人群,对于制定个性化的管理策略至关重要。
1 资料与方法
1.1 一般资料 回顾性分析2019年1—7月于首都医科大学附属北京安贞医院入院诊断为AMI并进行PCI的1 130例患者的临床资料,将符合纳入、排除标准的962例患者随机分为60%的开发队列(577例)和40%的验证队列(385例),见图1。纳入标准:患者临床症状、心电图、心肌酶符合《急性心肌梗死诊断和治疗指南》[11]中AMI的诊断标准并进行PCI。排除标准:院内死亡、恶性肿瘤、左心室射血分数(LVEF)<30%或LVEF数据缺失、估算肾小球滤过率(eGFR)<30%或eGFR数据缺失、GRACE评分数据缺失、失访患者。本研究临床资料均来自临床电子病历系统,已获得首都医科大学附属北京安贞医院伦理委员会批准(伦理审批编号:2022078X),并获得了所有患者的知情同意。

图1 研究样本纳入流程图Figure 1 Flow chart of study sample enrollment
1.2 研究方法
1.2.1 方法 由两位临床医师通过临床电子病历系统收集、录入患者临床信息并进行分析,如有分歧则请第3位经验丰富的上级临床医师进行评价、校正。对患者进行出院后随访,随访以电话询问为主,1次/年,随访时间截至2021-12-28,记录患者随访期间主要不良心血事件发生情况。主要不良心血管事件包括全因死亡、非致死性心肌梗死、非致死性卒中、恶性心律失常、新发心力衰竭或心力衰竭加重再入院、非计划内的血运重建。
1.2.2 临床资料 通过临床电子病历系统收集患者的一般资料和实验室检查指标,包括年龄、性别、入院就诊时是否有心搏骤停、心电图sT段偏移情况、心功能Killip分级、发病时间、门球时间、术后心肌梗死溶栓(TIMI)分级、高血压发生情况、高脂血症发生情况、糖尿病发生情况、心房颤动发生情况、缺血性脑卒中发生情况、既往心肌梗死、既往PCI、收缩压、心率、LVEF、左心室舒张末期容积、左心室收缩末期容积、GRACE评分、肌酐、心肌酶、eGFR、尿素、尿酸、白细胞计数、血红蛋白(Hb)、中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、红细胞分布宽度、钠、钾、氯、白蛋白、超敏C反应蛋白、游离三碘甲状腺原氨酸、游离甲状腺素、糖化血清白蛋白、糖化血红蛋白、纤维蛋白原、D-二聚体、纤维蛋白原降解产物、B型利钠肽。
1.2.3 GRACE评分 GRACE评分包括年龄、收缩压、心率、入院就诊时是否有心搏骤停、心电图sT段偏移、心功能Killip分级、肌酐、心肌酶共8个项目,根据2020年EsC《非sT段抬高型急性冠脉综合征指南》给出的GRACE评分表[6]对纳入患者入院时的每项数据进行评分。
1.3 分组 根据是否发生远期主要不良心血管事件将962例患者分为事件组122例与非事件组840例;根据是否为sT段抬高型心肌梗死将AMI患者分为sT段 抬 高 型 心 肌 梗 死(sT-segment elevation myocardial infarction,sTEMI)组452例与非sT段抬高型心肌梗 死(non sT-segment elevation myocardial infarction,NsTEMI)组510例。
1.4 统计学方法 采用stata15.0软件进行统计学分析,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以〔M(Q1,Q3)〕表示,两组间比较采用非参数检验;计数资料以相对数表示,两组间比较采用χ2检验。分别对开发队列和验证队列使用10个数据集进行多重插补,预测模型在每个数据集中进行训练,使用Lasso回归分析筛选AMI患者发生远期主要不良心血管事件的危险因素,采用多因素Logistic回归分析构建预测模型并绘制列线图。绘制预测模型预测AMI患者PCI后发生远期主要不良心血管事件的受试者工作特征(ROC)曲线,应用C指数(C index)评价其预测效能。使用净重分类改善指标(NRI)和综合判别指数(IDI)对预测模型与GRACE评分进行比较,评估改善效能。以P<0.05为差异有统计学意义。
2 结果
2.1 事件组与非事件组患者临床资料比较 纳入的962例AMI患者中男782例、女180例,平均年龄为(58.0±11.2)岁,中位随访时间为2.4年。事件组与非事件组年龄、心电图sT段偏移比例、心功能Killip分级≥Ⅱ级比例、术后TIMI分级≤2级比例、糖尿病发生率、缺血性脑卒中发生率、既往心肌梗死比例、既往PCI比例、心率、LVEF、GRACE评分、eGFR、尿素、Hb、红细胞分布宽度、白蛋白、游离三碘甲状腺原氨酸、糖化血清白蛋白、糖化血红蛋白、D-二聚体、纤维蛋白原降解产物、B型利钠肽比较,差异均有统计学意义(P<0.05)。两组患者男性比例、发病时间、门球时间≤90 min比例、高血压发生率、高脂血症发生率、心房颤动发生率、收缩压、左心室舒张末期容积、左心室收缩末期容积、肌酐、心肌酶、尿酸、白细胞计数、NLR、PLR、钠、钾、氯、超敏C反应蛋白、游离甲状腺素、纤维蛋白原比较,差异均无统计学意义(P>0.05)。见表1。
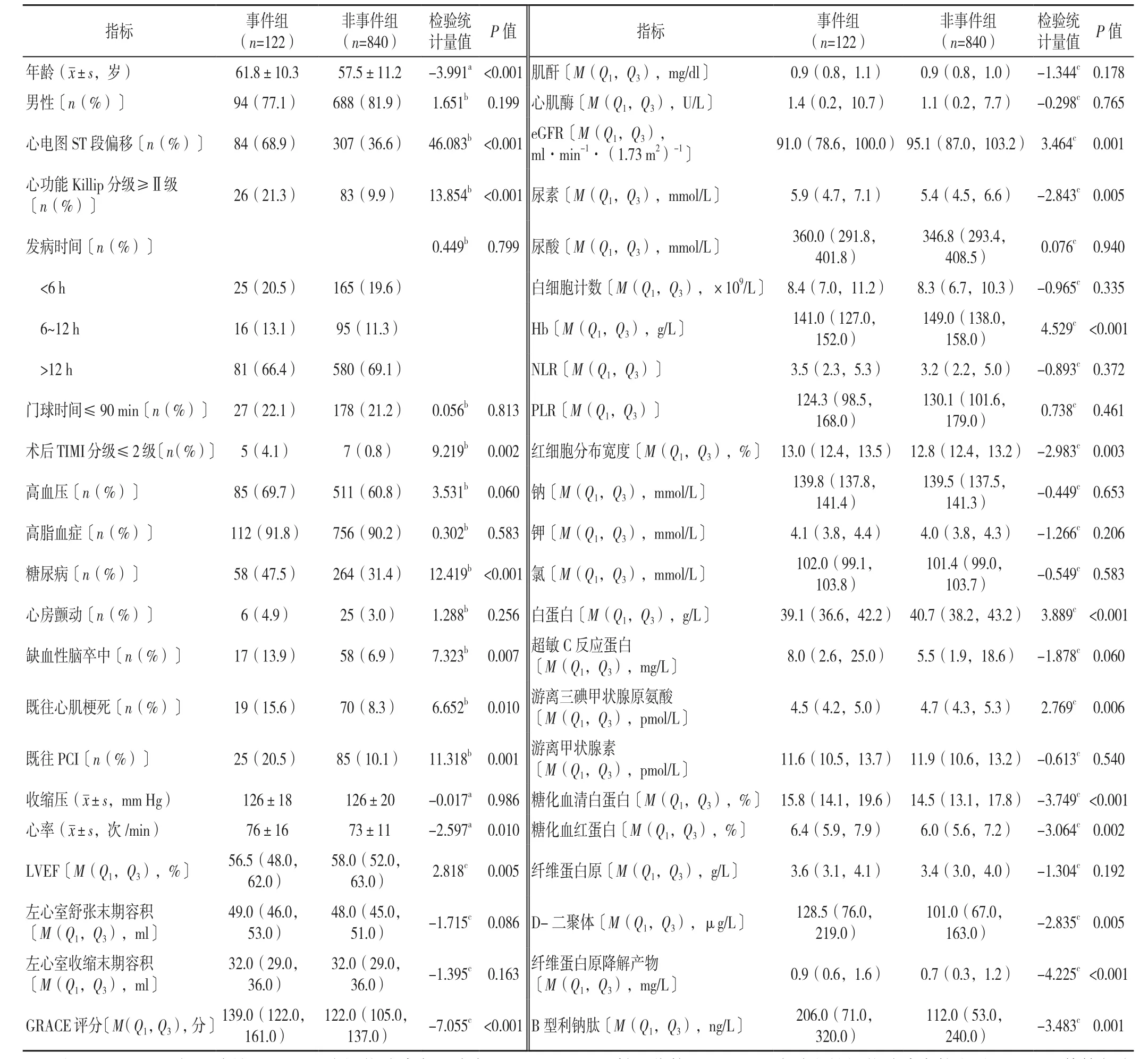
表1 事件组与非事件组患者临床资料比较Table 1 Comparison of clinical data between two groups of AMI patients divided by long-term MACEs prevalence
2.2 开发队列和验证队列患者临床资料比较 开发队列和验证队列患者年龄、男性比例、心电图sT段偏移比例、心功能Killip分级≥Ⅱ级比例、发病时间、门球时间≤90 min比例、术后TIMI分级≤2级比例、高血压发生率、高脂血症发生率、糖尿病发生率、心房颤动发生率、缺血性脑卒中发生率、既往心肌梗死比例、既往PCI比例、收缩压、心率、LVEF、左心室舒张末期容积、左心室收缩末期容积、GRACE评分、心肌酶、eGFR、尿素、尿酸、白细胞计数、Hb、NLR、PLR、红细胞分布宽度、钠、钾、氯、白蛋白、超敏C反应蛋白、游离三碘甲状腺原氨酸、游离甲状腺素、糖化血清白蛋白、糖化血红蛋白、纤维蛋白原、D-二聚体、纤维蛋白原降解产物及远期主要不良心血管事件发生率比较,差异均无统计学意义(P>0.05)。开发队列肌酐、B型利钠肽低于验证队列,差异均有统计学意义(P<0.05)。见表2。

表2 开发队列和验证队列患者临床资料比较Table 2 Comparison of basic demographics and laboratory parameters in development and validation sub-cohorts of AMI patients after PCI
2.3 AMI患者PCI后发生远期主要不良心血管事件风险预测模型的构建
2.3.1 Lasso回归筛选预测变量 以开发队列中AMI患者PCI后是否发生远期主要不良心血管事件(赋值:否=0,是=1)为因变量,以患者的临床特征、体格检查、实验室检查指标为自变量〔分类变量(赋值:否=0,是=1);连续变量(赋值:实测值)〕进行Lasso回归分析。通过Lasso回归对纳入的43个变量进行降维处理,使用三倍交叉验证计算λ值,最终选择在最小均方预测误差(mean squared prediction error,MsPE)的一个标准偏差内的λ值作为最优值,见图2。最终Lasso回归分析从43个变量中筛选出5个非零系数的预测变量(心电图sT段偏移、糖尿病、LVEF、eGFR、Hb)。

图2 采用Lasso回归进行预测变量的筛选Figure 2 selection of potential predictors of long-term MACEs in AMI patients after PCI by Lasso regression
2.3.2 多因素Logistic回归分析模型构建 以AMI患者PCI后是否发生远期主要不良心血管事件(赋值:否=0,是=1)为因变量,以Lasso回归筛选出的5个预测变量心电图sT段偏移(赋值:否=0 ,是=1)、糖尿病(赋值:无=0 ,有=1)、LVEF(赋值:实测值)、eGFR(赋值:实测值)、Hb(赋值:实测值)为自变量构建多因素Logistic回归模型,结果显示心电图sT段偏移、糖尿病、LVEF、Hb是AMI患者PCI后发生远期主要不良心血管事件的影响因素(P<0.05),见表3。构建的预测模型的回归方程为:logit(P)=3.596-0.023×X1-0.014×X2-0.036×X3+0.726×X4+1.372×X5(X1 表示Hb,X2表示eGFR,X3表示LVEF,X4表示糖尿病,X5表示心电图sT段偏移)。根据预测变量绘制AMI患者PCI后发生远期主要不良心血管事件风险的预测模型列线图,即Nomogram,见图3。每个预测变量对应列线图分值横轴上的某一具体分值,将5个预测变量所对应的分数相加,即得到总分,通过总分对应列线图最下方的不良心血管事件风险预测值,由图可知总分越高的患者发生远期主要不良心血管事件的可能性越大。
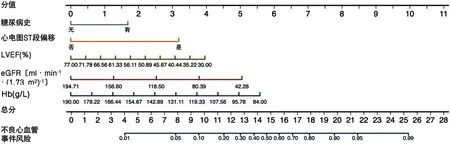
图3 AMI患者PCI后发生远期主要不良心血管事件风险的预测模型列线图Figure 3 Nomogram in predicting long-term MACEs in AMI patients after PCI

表3 AMI患者PCI后发生远期主要不良心血管事件影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of the factors associated with the risk of long-term MACEs in patients with AMI after PCI
2.3.3 风险预测模型评价 预测模型的验证主要基于模型的区分度,通过绘制预测模型预测AMI患者PCI后发生远期主要不良心血管事件的ROC曲线评估模型的区分度。开发队列的ROC曲线下面积(AUC)为0.774〔95%CI(0.710,0.834)〕,验证队列的AUC为0.751〔95%CI(0.686,0.815)〕,见图4A、4B。
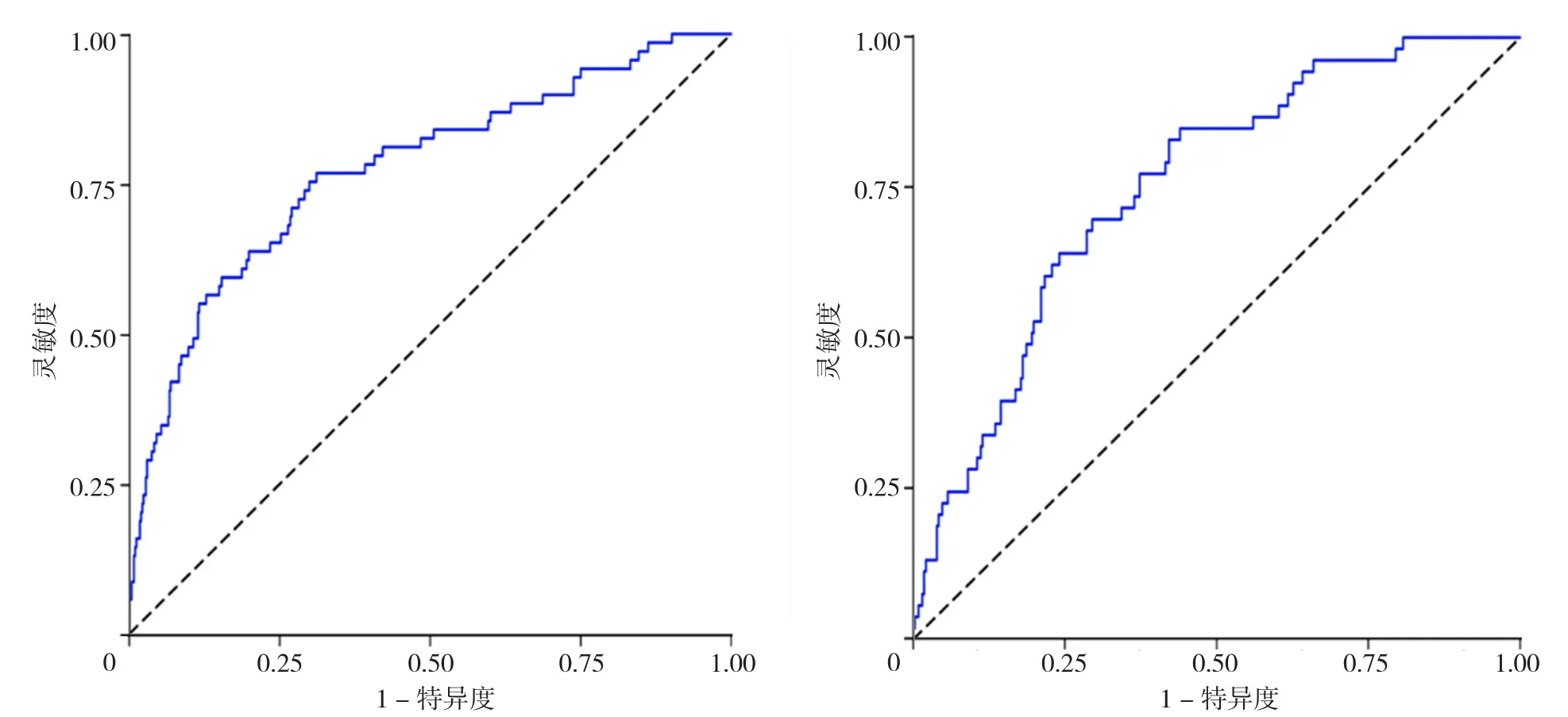
图4 模型预测AMI患者PCI后发生远期主要不良心血管事件的ROC曲线Figure 4 ROC curve of the model for predicting long-term MACEs in AMI patients after PCI
2.4 应用Lasso回归筛选变量在sTEMI组与NsTEMI组构建预测模型 以Lasso回归筛选的5个预测变量心电图sT段偏移(赋值:否=0,是=1)、糖尿病(赋值:无=0,有=1)、LVEF(赋值:实测值)、eGFR(赋值:实测值)、Hb(赋值:实测值)为自变量,以患者是否发生远期主要不良心血管事件(赋值:否=0,是=1)为因变量,分别在sTEMI与NsTEMI两亚组患者中进行多因素Logistic回归分析构建预测模型,结果显示,心电图sT段偏移、糖尿病、eGFR、Hb是sTEMI患者PCI后发生远期主要不良心血管事件的影响因素(P<0.05);心电图sT段偏移、糖尿病、Hb是NsTEMI患者PCI后发生远期主要不良心血管事件的影响因素(P<0.05,见表4)。
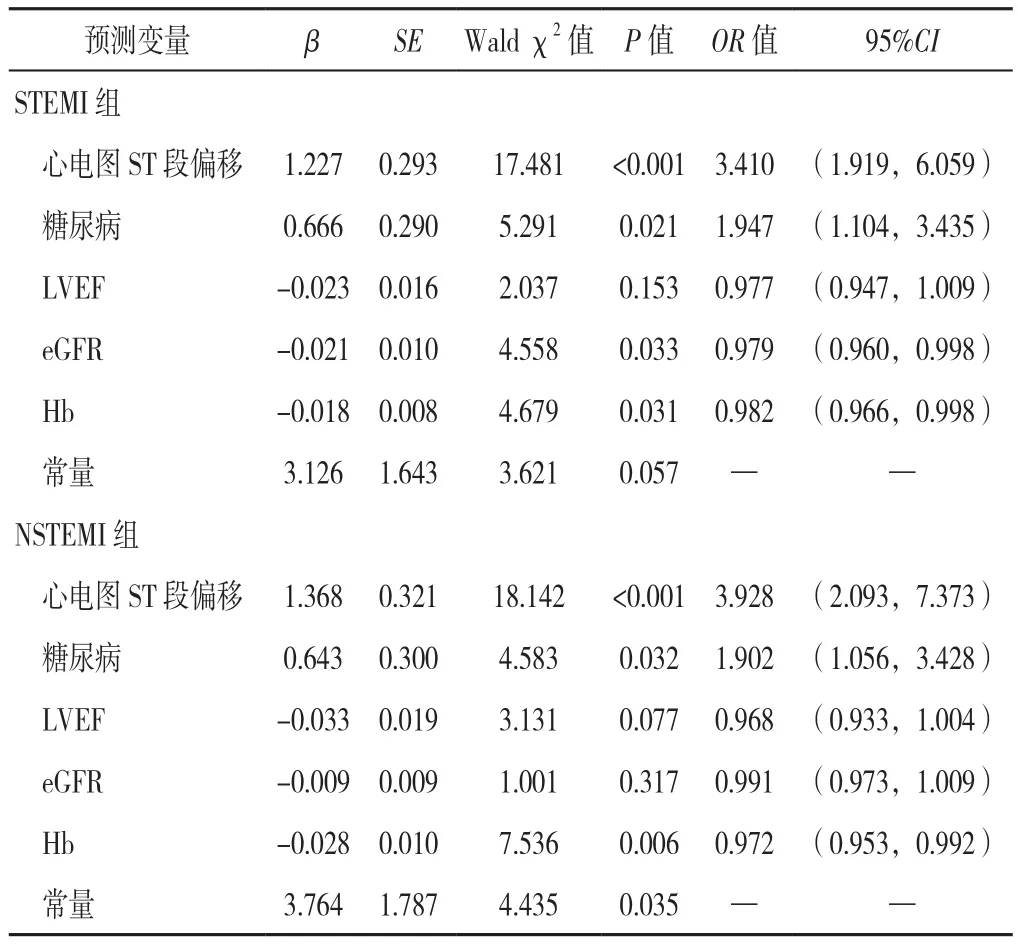
表4 sTEMI组与NsTEMI组患者PCI后发生远期主要不良心血管事件影响因素的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of the factors associated with the risk of long-term MACEs in patients with sTEMI or non-sTEMI after PCI
2.5 预测模型与GRACE评分预测效能比较 将Lasso回归确定的预测变量在AMI患者及sTEMI、NsTEMI患者中构建的预测模型与GRACE评分进行预测效能评估,结果显示,AMI、sTEMI、NsTEMI中NRI分别为0.493〔95%CI(0.303,0.682)〕、0.459〔95%CI(0.195,0.724)〕、0.455〔95%CI(0.181,0.728〕,IDI分 别为 0.055〔95%CI(0.028,0.081)〕、0.042〔95%CI(0.015,0.070〕、0.069〔95%CI(0.022,0.116)〕。3组患者中预测模型的预测效能均优于GRACE评分,差异有统计学意义(P<0.05),见表5。将在AMI患者中构建的预测模型、GRACE评分在全研究队列中绘制AMI患者PCI后发生远期主要不良心血管事件的ROC曲线,结果显示,AUC分别为0.748〔95%CI(0.702,0.793)〕,0.697〔95%CI(0.648,0.746)〕,ΔAUC=0.050,P=0.015;IDI=0.055〔95%CI(0.028,0.081),P<0.001;NRI=0.493〔95%CI(0.303,0.682)〕,P<0.001。见图5。

表5 分别在AMI患者及sTEMI、NsTEMI患者中构建的预测模型与GRACE评分效能比较Table 5 Efficacy evaluation of the predictive model and GRACE score in AMI,sTEMI and non-sTEMI patients after PCI

图5 预测模型、GRACE评分预测AMI患者PCI后发生远期主要不良心血管事件的ROC曲线Figure 5 ROC curve of the model and GRACE score for predicting MACEs in AMI patients after PCI
3 讨论
AMI是严重致命性疾病,病死率高且预后差,尽管PCI能尽快恢复梗死动脉相关心肌血流灌注,改善患者预后,但PCI后患者出现主要不良心血管事件的风险仍很高,主要包括心源性死亡、心力衰竭、卒中、血运重建、恶性心律失常等[12-14]。研究表明,AMI患者PCI后不良预后与多项指标相关,如LVEF、Killip分级、Hb、红细胞分布宽度等[15-17]。为了更好地个性化评估患者预后,本研究使用Lasso回归筛选出5个与远期主要不良心血管事件最相关的危险因素:心电图sT段偏移、糖尿病、LVEF、eGFR、Hb,尽管eGFR在多因素Logistic回归分析时没有统计学意义,但考虑显著性水平的两面性及Lasso回归变量的临床实用性,仍参照既往研究将其纳入预测模型中[18-19],并对变量赋值后构建新的预测模型,可用于预测AMI患者PCI后的远期预后,有利于患者早期风险分层。此外,本研究将开发队列与验证队列进行临床资料比较、分析时,虽然肌酐和B型利钠肽在验证队列中略高于开发队列,但既往一项同样采用Lasso回归分析建模的研究中发现丙氨酸氨基转移酶与血红蛋白在验证队列中高于开发队列,并未影响模型效能,并且本研究中两队列远期主要不良心血管事件发生率是均衡的(12.0%与13.8%,P=0.409),因此本研究认为肌酐和B型利钠肽在两组间的差异对结果可能无影响[20],构建的模型有较强的可信度。
心电图sT段变化的导联数目和sT段压低的程度均能反映心肌缺血、缺氧的程度,与心电图正常的患者相比,AMI伴有心电图sT段偏移的患者并发症更多,病死率更高[21]。一项纳入7 684例NsTEMI患者的研究表明,与心电图显示无缺血性变化或T波倒置的患者相比,心电图sT段压低的患者在出院后30 d内的死亡率与不良心血管事件的发生率更高[22]。研究显示糖尿病是不良心血管事件的危险因素,长期高血糖可引起血管内皮损伤、炎性反应、氧化应激、血栓形成等,进而加重心血管疾病恶化[23-24]。一项纳入1 717例急性冠脉综合征患者、中位随访时间为2年的研究同样提示糖尿病是不良心血管事件的独立危险因素[25]。与单纯AMI患者相比,合并糖尿病的患者长期死亡率是无糖尿病患者的1.5倍[26]。对于LVEF降低的AMI患者,心排出量降低导致心肌供血不足,增加了血栓形成风险,接受PCI的AMI患者LVEF降低时远期不良心血管事件的发生风险明显升高[27]。一项纳入352例AMI患者、中位随访时间为30.5个月的研究也提示LVEF是AMI患者不良心血管事件的独立预测因子[28]。10.9%的AMI患者存在肾功能不全,一项中国的多中心研究显示,低eGFR是AMI患者不良心血管事件的独立预测因素[29]。Hb是AMI患者的一个潜在的独立预后指标[30]。研究显示15%的AMI患者存在贫血,且贫血是高再住院率和高病死率的危险因素[31]。低Hb水平使血液中红细胞携氧量减少,进而导致心脏供氧量减少,刺激心脏泵血以满足心肌耗氧的需求,最终导致交感过度兴奋,心肌需氧量进一步增加,而AMI患者由于冠状动脉狭窄甚至堵塞导致心肌供氧不足,低Hb水平将致使缺氧进一步加重[32]。最新研究结果显示,中国接受PCI的AMI患者术前Hb低与术后不良心血管事件的发生率显著相关[33]。本研究结果显示,心电图sT段偏移、糖尿病、LVEF、Hb是AMI患者PCI后发生远期主要不良心血管事件的影响因素;心电图sT段偏移、糖尿病、eGFR、Hb是sTEMI患者PCI后发生远期主要不良心血管事件的影响因素;心电图sT段偏移、糖尿病、Hb是NsTEMI患者PCI后发生远期主要不良心血管事件的影响因素,与上述研究结果基本一致。
GRACE评分是针对急性冠脉综合征患者开发的模型,旨在预测患者院内死亡及6个月全因死亡和非致死性心肌梗死复合终点事件发生风险。该模型构建时间早,并非针对急性心肌梗死患者,此外,其构建初期纳入亚洲人群较少,考虑到患者特征和管理模式上的地域差异,其在中国急性心肌梗死患者中的适用性仍需进一步评估。
本研究采用Lasso回归筛选出的预测变量能够反映AMI患者病理生理变化。从预测变量在模型中的权重占比中可以推断出对预测模型贡献由大到小的变量依次为心电图sT段偏移、糖尿病、LVEF、Hb、eGFR,这些变量能够反映患者的病理、生理过程,如心肌缺血、缺氧,内皮损伤,贫血等。预测模型与GRACE评分预测AMI患者PCI后发生远期主要不良心血管事件的效能比较结果显示,预测模型与GRACE评分相比纳入变量更少、预测效能更好,能更好地预测AMI患者的预后。
本研究局限性:(1)为单中心观察性研究,需要进一步外部验证以评估模型性能;(2)研究仅使用电子病历中的变量,其他可能与结局相关的变量如新型生物标志物未纳入。
综上所述,本研究为PCI后AMI患者构建了一个易于应用的预后风险预测模型,可用于预测AMI患者PCI后的远期预后,有利于实现对患者的早期风险分层。未来需要进行更大规模的多中心研究以验证模型的应用价值。
作者贡献:李琴、檀鑫、姜文溪、王媛、杜杰进行文章的构思与设计,研究的实施与可行性分析,论文的修订,负责文章的质量控制及审校,对文章整体负责,监督管理;李琴、姜文溪负责研究的统计学处理,结果的分析与解释;李琴、袁梦、倪慧负责数据收集及患者随访;李琴、檀鑫、姜文溪负责撰写论文。
本文无利益冲突。
