基于16S rRNA 测序分析游泳运动对小鼠肠道菌群的影响
2022-07-05廖沁曾来生陈杨刘星蒋鑫萍杨淙茗谢雨曾山谢家和
廖沁,曾来生,陈杨,刘星,蒋鑫萍,杨淙茗,谢雨,曾山,谢家和,
(1.赣南医学院,赣州 341000;2.赣南医学院第一附属医院心内科赣南医学院心脑血管疾病防治教育部重点实验室国家老年疾病临床医学研究中心江西分中心,赣州 341000)
人类肠道微生物区系包含数千种不同的细菌分类群,以及各种古生菌、真核微生物和病毒,总计300 多万个基因, 并蕴藏着巨大的新陈代谢能力[1]。 胃肠道中的微生物在营养吸收、维生素合成、能量获取、 炎症调节和宿主免疫反应中发挥重要作用[2-3]。 反过来,许多内在和外在因素可以影响肠道微生物,比如妊娠[4]、年龄[5]、饮食[6-7]等因素。 另外肠道—脑轴[8]、肠道—肌轴[8]和肠道—肝轴[9]的发现,表明肠道微生物和宿主外周组织之间存在双向通信。
众所周知,运动对心肺健康、肌肉力量、葡萄糖代谢、免疫系统和心理健康都有积极的影响[10]。 研究表明, 运动和肠道微生物区系组成之间存在联系[11]。越来越多的研究揭示了微生物区系对运动成绩、康复和疾病模式的各种指数有间接影响,例如通过肌动因子和其他细胞因子发出信号, 调节下丘脑—垂体—肾上腺轴的激活, 以及影响与运动相关的代谢途径[12-14]。 研究还表明了运动个体肠道微生物区系组成的特殊特征[13]以及运动对久坐人群肠道微生物区系组成的影响[14]。研究还明确了运动对不同年龄不同性别个体的肠道微生物区系的有益影响[15-17]。
然而, 这些结果只能证实运动和微生物种群之间的关联, 并不能确定运动和肠道菌群改变的因果关系。 此外研究大多集中在运动员和社会人群,由于性别、年龄、运动模式和强度等因素的差异,导致实验结果存在一定的争议性。 在人体内发现有氧运动影响肠道菌群[18],但是鲜有研究报道游泳运动对小鼠肠道菌群的改变。 本实验将探究游泳运动对小鼠肠道菌群的影响, 进而从肠道菌群的角度对运动给人体带来的改变提供理论依据。
1 材料与方法
1.1 实验动物 健康8 周龄的雄性C57BL/6 雄鼠,体重(27.72±0.91)g,购自北京维通利华实验动物技术有限公司浙江仓, 动物许可证号:SCXK (浙)2019-0001。 小鼠按12 h∶12 h 人工明暗周期,早上六点开灯,动物房温度(24±1)℃,4 只/笼饲养在赣南医学院SPF 级动物房, 给予充足的水和标准饲料喂养。 小鼠随机分为游泳组和静坐组,每组8只。
1.2 游泳方案 在30~32 ℃的150 cm × 70 cm 的锥形水缸中装满>25 cm 的水,第一天游泳持续10 min,每天递加10 min,直至一周后游泳90 min,总计28 d。上午下午各一趟。所有游泳时间均在9:00 AM-11:00 AM,及3:00 PM-5:00 PM。 同时,将静坐组的小鼠关在笼子里作为对照。
1.3 肠道菌群样本取材 游泳运动结束四周后,将待取样的小鼠放进干净的铺有无菌滤纸的笼子里,小鼠排便后立即收集粪便样本,单个小鼠收集3~5 粒粪便置于无菌的EP 管。 每只小鼠更换新的无菌滤纸和笼子。 取得粪便后液氮速冻,-80 ℃保存,用于肠道菌群16s rRNA 测序。
1.4 小鼠粪便微生物总DNA 提取和16S rRNA 基因测序
1.4.1 肠道菌群样本DNA 提取 肠道样本用E.Z.N.A.Stool DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)试剂盒提取DNA,并通过2%琼脂糖凝胶电泳检测DNA 提取质量,同时采用紫外分光光度计对DNA 进行定量。
1.4.2 16S rRNA 的扩增 16S rRNA 基因指的是基因组中编码核糖体16S rRNA 分子对应的序列。 该基因全长约1542 bp, 由9 个可变区和10 个保守区组成(可变区为V1 到V9),其中保守区反映了生物物种间的亲缘关系, 而可变区则表明物种间的差异,且变异程度与细菌的系统发育密切相关,被认为是最适于细菌系统发育和分类鉴定的指标。对16s rRNA 的V3-V4 可变区进行PCR 扩增,扩增引物为341F:5'-CCTACGGGNGGCWGCAG-3'和805R:5'-GACTA CHVGGGTATCTAATCC-3';V4可变区扩增引物为515F:5'-GTGYCAGCMGCCG CGGTAA-3' 和806R:5'- GGACTACHVGGGTWTC TAAT-3';V4-V5 可变区扩增引物为F:5’-GTGC CAGCMGCCG CGG-3’和R:5’-CCGTCAATTCMTT TRAGTTT-3’; 以及古菌的扩增引物为F:5’-GYG CASCAGKCG MGAAW-3’和R:5’-GGACTACHVG GGTWTCTAA T-3’。PCR 产物经2%琼脂糖凝胶电泳确证。
1.4.3 文库构建和上机测序 PCR 产物由AMPure XT beads (Beckman Coulter Genomics, Danvers,MA, USA)纯化,Qubit(Invitrogen, USA)定量。扩增子池用于测序, 扩增子文库的大小和数量分别在Agilent2100 生物分析仪(Agilent,美国)和Illumina(Kapa Biosciences, Woburn, MA,美国)的文库定量试剂盒上进行评估。使用NovaSeq6000 测序仪进行2×250bp 的双端测序, 相应试剂为NovaSeq 6000 SPReagentKit(500cycles)。
1.5 数据处理与统计分析
1.5.1 筛选与质控 样品在Illumina NovaSeq 平台上按照制造商的建议进行测序, 由LC-Bio 提供。根据样品独特的条形码, 将配对端序列分配给样品,并将建库引入的barcode 和引物序列去除。 使用FLASH 合并匹配端读取。
1.5.2 生信分析 根据fqtrim(v0.94),在特定的过滤条件下对原始读数据进行质量过滤, 以获得高质量的clean 标签。 使用Vsearch 软件对嵌合序列进行过滤(v2.3.4)。 利用DADA2 进行解调,然后使用ASVs (Amplicon Sequence Variants)的概念构建类OTU(Operational Taxonomic Units)表,获得最终的feature 特征表以及特征序列,进一步进行多样性分析、物种分类注释和差异分析等。 多样性和多样性通过归一化到相同的随机序列来计算。 然后根据SILVA(release 132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。 Alpha 多样性用于分析样本物种多样性的复杂性,通过QIIME2 计算5 个指标,包括Chao1、Observed、species,Goods coverage、Shannon、Simpson。 Beta 多样性基于QIIME2 计算。采用Blast 进行序列比对, 每个代表性序列用SILVA 数据库对特征序列进行注释。其他图是用R包(V3.5.2)实现的。
1.5.3 统计学分析 采用SPSS 25.0 软件进行统计分析。 实验结果以(±s)表示,两组间比较采用t 检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 运动对肠道菌群物种组成丰度的分析 图1是两组基于一致性进行绘制的稀释曲线, 曲线趋于平缓,证明本实验测序数据量已饱和,即测序数据合理,可以反映样本中大多数的微生物信息。 进而对两组小鼠肠道粪便的样本进行测序, 统计运动后OUT 数量, 用Venn 图展示不同组之间共有和差异的OTU 数目。 由图2 可知,静坐组OTU 数目为1658,运动组数目为821,共有数目为707。结果表明运动组OTU 数目明显降低, 提示游泳运动可能降低菌群丰富度。
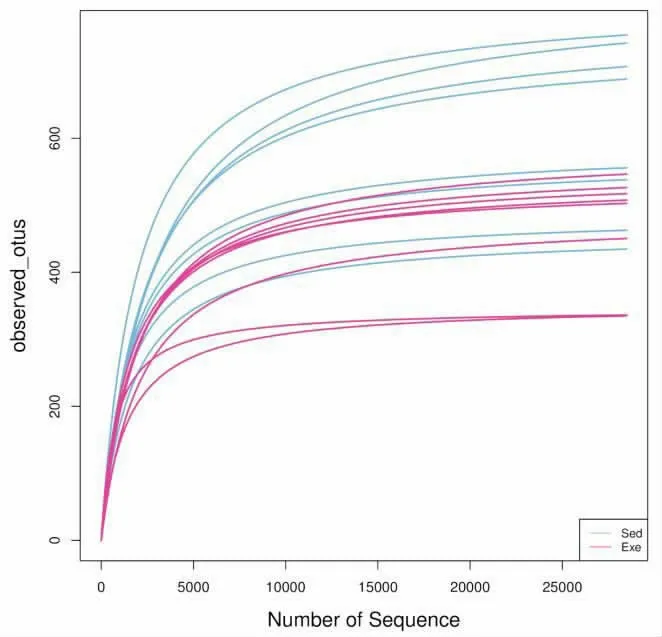
图1 静坐组和运动组的稀释曲线

图2 静坐组和运动组肠道菌群OUT 的Venn 图
2.2 运动对肠道菌群Alpha 多样性的分析 α 多样性是度量单个样本内有多少种微生物物种, 以及每个物种所占比例的指标, 关注的是样本自身的菌群丰富度和均匀度。 静坐组和运动组的肠道菌群微生物的Alpha 多样性分析表明,图3 显示反映样本中物种丰富度的Observed species 有统计学差异(P<0.05)。
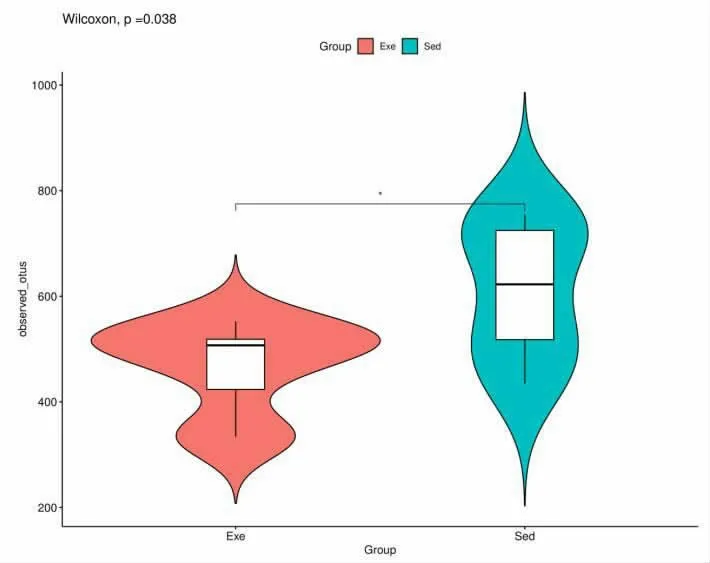
图3 静坐组和运动组肠道菌群Alpha 多样性比较
2.3 运动对肠道菌群Beta 多样性的分析 Alpha多样性与Beta 多样性一起构成了总体多样性或一定环境群落的生物异质性,Beta 多样性是指不同环境群落之间的物种差异性。 图4 是通过主成分PCA(Principal Component Analysis)对静坐组和运动组的肠道菌群进行分析。 结果显示静坐组菌群明显聚集,并且与运动组有一定的距离,说明两组之间有一定的差异。 于是对两组的肠道菌群进行门水平分析,结果如图5 所示,静坐组和运动组的前三优势菌群都是拟杆菌门, 厚壁菌门以及变形菌门。 这表明运动对肠道菌群的结构组成没有明显影响,但是运动导致拟杆菌门丰度降低,厚壁菌门以及变形菌门丰度增加。
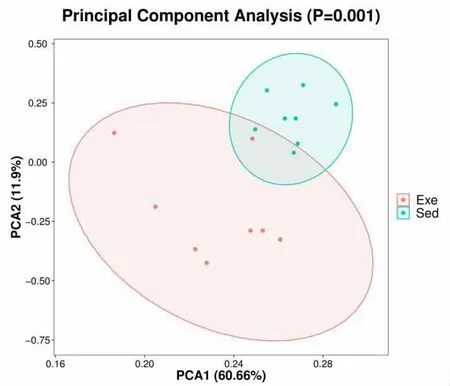
图4 静坐组和运动组肠道菌群的PCA 分析
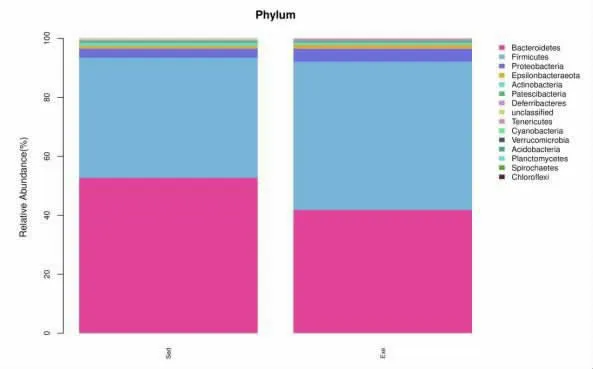
图5 静坐组和运动组肠道菌群门水平相对丰度比较
进一步对肠道菌群进行属水平分析,结果见图6。 与静坐组的优势菌群相比,运动组的拟杆菌属、杜氏藻属下降,但是有益菌乳酸菌属、毛螺菌属明显上升。
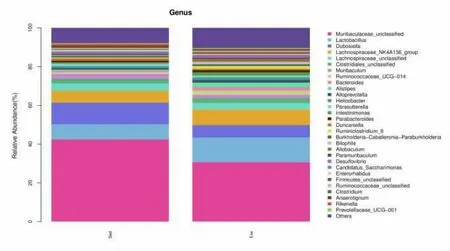
图6 静坐组和运动组肠道菌群属水平相对丰度比较
2.4 显著差异菌群分析 为了进一步探究运动和静坐组之间的差异物种, 对肠道菌群物种进行LEfSe (Linear Discriminant Analysis Effect Size)分析,寻找生物标记物。 结果如图7 所示,主要展示了LDA score 大于预设值(>2)的显著差异物种,即不同组间显著差异物种的影响程度,数值越大,差异越显著。 此外运动组属水平上迟缓埃格特菌属、另枝菌属、克里斯滕森菌属、真杆菌属、瘤胃球菌-UCG-013、瘤胃球菌-UCG-014 以及异杆菌属丰度明显高于静坐组, 在科水平上真杆菌科和瘤胃球菌科的丰度也高于静坐组。
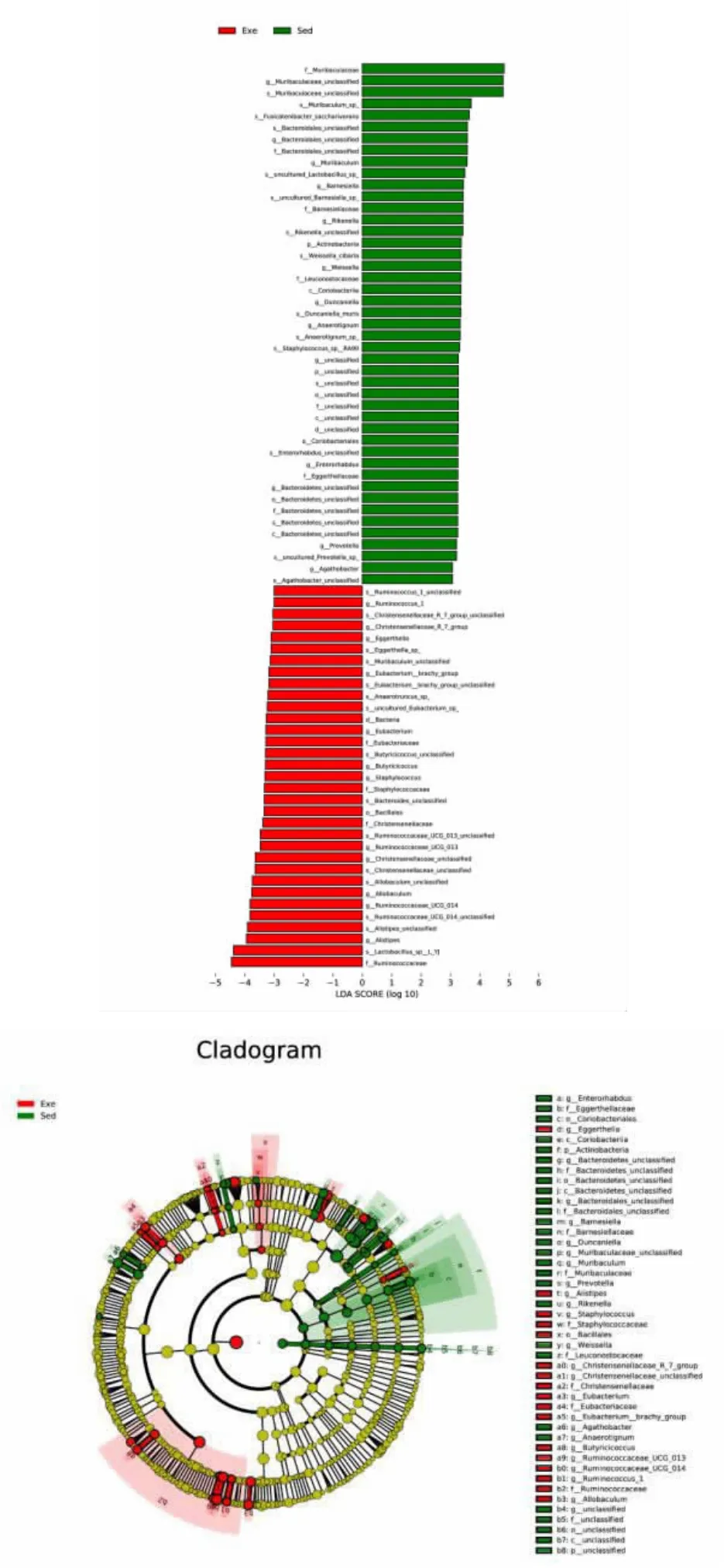
图7 LEfSe 及LDA 值分布柱状图
2.5 肠道菌群功能预测 对两组肠道菌群进行KEGG 功能分析,并筛选出具有显著性组间差异的通路。 根据组间t-test 差异检验,有统计学意义的通路结果见图8。运动组集中在UDP-N-acetyl-Dglucosamine biosynthesis I、superpathway of polyamine biosynthesis I、1,4 -dihydroxy -6 -naphthoate biosynthesis II、peptidoglycan maturation、superpathway of glycol metabolism and degradation、pyrimidine deoxyribonucleotides de novo biosynthesis III等通路。 而静坐组集中在superpathway of Lthreonine biosynthesis、superpathway of β-Dglucuronide and D -glucuronate degradation、superpathway of 5 -aminoimidazole ribonucleotide biosynthesis、superpathway of hexuronide and hexuronate degradation 等通路。
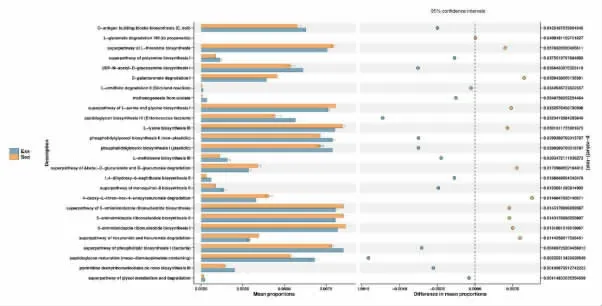
图8 t-test 组间通路差异分析图
3 讨论
3.1 游泳运动对小鼠肠道菌群微生物组成的影响运动可以影响人体肠道菌群的数量和构成[19],Carbajo 等[20]研究证明运动可以改变大鼠的肠道菌群。 本研究同样发现,游泳运动改变了小鼠肠道菌群的丰度及比例。 运动组小鼠的菌群丰富度降低,体现在有害菌的减少以及有益菌的增加。 其中拟杆菌门丰度降低, 而厚壁菌门和变形菌门的丰度增加。 与肥胖相关的肠道微生物区系的特征是拟杆菌的减少[21]。 Akoi 等[22]发现厚壁菌门/拟杆菌门的比值和运动量正相关。 肠道厚壁菌门可以产生丁酸盐抵抗患结肠癌的风险[23]。而有益的肠道变形菌门在人类非酒精性肝病中降低[24]。本研究证明了游泳运动可以调节菌群构成和种类, 抑制致病菌的产生,增加益生菌的定植。
在菌属水平上,和静坐组相比,运动组的乳酸菌属和毛螺菌属明显上升。 其他研究也证实运动导致乳酸菌和毛螺菌表达增加[25-26]。 乳酸菌是功能已经确认的益生菌, 可以改善啮齿类动物在力竭运动后的肠道屏障性能[27]和抗氧化状态[28],并减轻炎症反应[29]。另有学者发现老年缺血性心肌病患者乳酸菌水平显著降低[30]。而毛螺菌属可以介导过敏反应[31]、增加食欲[32]以及抵抗儿童腹泻[33]。我们的实验说明游泳运动可以影响和改善宿主肠道菌群的结构和功能。 但是值得注意的是,这种菌群的变化可能是暂时的, 或许需要长期重复的运动来使肠道菌群发生持久的改变。
另外我们还发现了运动组肠道菌群的迟缓埃格特菌属、另枝菌属、真杆菌属、Ruminococcaceae-UCG-013、Ruminococcaceae-UCG-014、 克里斯滕森菌属以及异杆菌属丰度也明显高于静坐组。 研究报道低水平的迟缓埃格特菌和老年人的脆弱指数正相关[34],并且与生物学年龄呈正相关,与实际年龄无关[35]。而另枝菌属在线粒体障碍模拟的衰老模型中表达增加[36],不过我们的实验结果表明游泳运动过后小鼠肠道中另枝菌属表达也升高, 结合其他不同的独立实验, 我们推测同样的菌群在不同的模型中的表达和作用也有所区别。Ruminococcaceae-UCG-013 在鸡球虫病感染中明显 降 低[37], 而Ruminococcaceae-UCG-014 的 增 加可以减缓焦虑情绪[38],使人体免受负面情绪的干扰。 自闭症患者治疗前后的肠道菌群也有上述改变[39]。我们的实验同样观察到游泳运动的小鼠更为兴奋并且有活力, 这或许提示小鼠上述表型的改变和运动优化肠道菌群的组成有关。 在不同的人群和多项研究中, 肠道克里斯滕森菌的相对丰度和身体质量指数(BMI)成负相关,并且与肥胖和炎症性肠病等疾病有关[40]。 另外异杆菌可以参与3-羟基十八烯酸对结肠炎的治疗[41]。在科水平上真杆菌科和瘤胃球菌科的丰度在运动组也显著增加。真杆菌科持续存在于纤维溶解的肠道群落中,是健康肠道微生物区系的重要组成部分, 而在炎症性肠病患者中可以观察到它们的耗竭。 此外瘤胃球菌科因其对人体的有益作用而广为人知, 比如与长寿[42]、心脏代谢[43]、骨关节炎[44]、肺癌[45]和帕金森病[46]等有关。以上结果证明运动有助于提高肠道菌群的健康程度, 或许运动可以通过调节肠道微生物从而防治胃肠道,神经和心血管等疾病。
3.2 游泳运动对小鼠肠道菌群微生物基因功能的影响 肠道菌群的功能和宿主之间存在紧密联系,肠道微生物除能够合成蛋白质外, 还可以合成多种维生素, 其代谢产物还会在肠道内有一定的作用,这与机体的免疫息息相关[47]。 本实验根据KEGG功能分析发现, 运动组表达增加的通路主要集中在葡萄糖无氧氧化途径,乳酸代谢,蛋白质合成,脂代谢和信号传导, 而正常组丰度增加的通路主要有葡萄糖有氧氧化途径和遗传信息。 说明运动时,机体需要更多的能量来维持消耗,包括利用蛋白质脂肪等,并且由于瞬时大量的运动,部分葡萄糖更多地参与了无氧氧化。 我们的研究还发现运动会激活部分信号传导通路, 进而促进肠道菌群发挥代谢作用, 并以此来调控其他器官或组织对运动的反应。
综上所述, 运动作为非药物和无创的治疗手段,在改善肠道菌群结构和组成、调节人体肠道微环境的稳态等方面具有积极的作用和独特的意义。 本实验证明了游泳运动可以增加小鼠肠道菌群中健康的细菌种类、微生物多样性、能量代谢能力和微生物相关的代谢物。 游泳运动还可以通过调节菌群变化进而改善负面情绪。 本研究可以让人们对运动和肠道微生物有进一步的认识, 并对运动对人体的好处有更深刻的理解。 有望为全民体育运动提供理论指导。 但是本实验还存在样本量不够,小鼠和人体的肠道存在一定差异的问题。因此仍需要更深层次地去探讨运动和肠道菌群的关系。
