卵巢早衰患者淋巴细胞亚群、MIF水平对激素替代治疗预后的影响
2022-07-02杨静伊婷易金玲
杨静,伊婷,易金玲
卵巢早衰(premature ovarian failure,POF)主要特征为激素分泌减退、卵巢功能过早衰竭,可引起失眠、烦躁、心悸等一系列症状,造成患者不适,且病情进展后可影响育龄期女性的生育能力,患者需积极接受治疗[1]。因POF不可治愈,目前临床治疗POF主要采用激素替代治疗(hormone replacement therapy,HRT),可补充激素,提高卵泡活性,延缓患者病情进展,被证实疗效确切[2]。但POF患者行HRT治疗时间较长,可产生激素依赖,增加子宫内膜癌风险,并影响长期治疗效果[3]。针对此情况,探讨预后相关的影响因子,对改进治疗措施有重要意义。研究证实,免疫因素在POF发病及病情进展中均发挥重要作用[4]。推测淋巴细胞亚群水平与POF病情有关,并可影响患者预后。此外,巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)被证实与POF患者免疫紊乱有关[5]。推测MIF表达水平也可能影响POF患者预后。基于此,本研究进一步观察POF患者淋巴细胞亚群、MIF水平对HRT预后的影响。
1 资料与方法
1.1 一般资料
前瞻性选取新疆医科大学第五附属医院2018年1月至2020年1月收治的116例POF患者作为研究对象,年龄26~37岁,平均(31.52±4.61)岁;闭经时间3~11个月,平均(6.46±1.49)个月;孕次0~2次,平均(1.42±0.46)次;已婚102例,未婚14例。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
1.2 入选标准
纳入标准:① 符合POF诊断标准[6];② 发病前患者月经状况正常;③ 经检测患者雌二醇(estradiol,E2)水平<25 pg/mL,促卵泡生成素(follicle stimulating hormone,FSH)水平>40 IU/L,促黄体生成素(luteinizing hormone,LH)水平>30 IU/L;④ 经检测患者肝、肾功能正常,可耐受HRT治疗。排除标准:① 入组前2个月内接受过盆腔手术的患者;② 入组前2个月内服用过激素类药物的患者;③ 对本研究药物有过敏反应的患者;④ 合并妇科肿瘤的患者;⑤ 合并其他因素引起的闭经。
1.3 方法
1.3.1 基线资料 于治疗前,收集患者基线资料,包括年龄、闭经时间、孕次、婚姻状况、卵巢阻力指数(resistance index,RI)、卵巢最大血流速度(peak systolic velocity,PSV)、E2、FSH、LH水平。卵巢RI及PSV检测采用迈瑞DC-N3S彩色多普勒超声系统。E2、FSH、LH检测:抽取患者HRT治疗前空腹肘静脉血3 mL,以8.5 cm离心半径、3 000 r/min的速度离心10 min,取血清,采用美国ABI公司提供的性激素检测试剂盒检测E2、FSH、LH水平,检测方法选用酶联免疫吸附试验。
1.3.2 淋巴细胞亚群及MIF水平检测 采血及取血清操作同性激素检测。采用美国ABI公司提供的淋巴细胞亚群检测试剂盒检测CD3+、CD4+、CD8+、CD4+/CD8+、CD19+水平,检测方法选用荧光免疫法。采用美国ABI公司提供的MIF试剂盒检测MIF水平,检测方法选用酶联免疫吸附试验。
1.3.3 HRT预后评估 患者均应用克龄蒙进行治疗,以治疗3个月为1疗程。于治疗1个疗程后,参照《中华妇产科学》[6]中有关内容评估疗效。显效:患者症状体征明显改善,月经状况基本恢复正常,性激素水平较治疗前改善≥90%;有效:患者症状体征改善,月经状况恢复,50%≤性激素水平较治疗前改善<90%;无效:未达到上述标准或有恶化。其中无效患者划分为预后不良,显效+有效患者划分为预后良好。
1.4 统计学方法
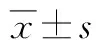
2 结果
2.1 两组基线资料、淋巴细胞亚群及MIF水平比较
116例POF患者中,有26例(22.41%)预后不良,有90例(77.59%)预后良好;预后不良组CD8+、MIF水平高于预后良好组,CD4+/CD8+水平低于预后良好组,差异有统计学意义(P<0.05);两组年龄、闭经时间、孕次、婚姻状况、卵巢RI、卵巢PSV、E2、FSH、LH、CD3+、CD4+、CD19+水平比较,差异无统计学意义(P>0.05),详见下页表1。

表1 两组基线资料、淋巴细胞亚群及MIF水平比较
2.2 回归分析检验淋巴细胞亚群、MIF水平对HRT预后的影响
将初步基线资料比较结果显示差异有统计学意义的CD8+、CD4+/CD8+、MIF水平纳入作为自变量,均为连续变量无需赋值,将HRT预后作为因变量(1=预后不良,0=预后良好);经回归分析检验结果显示,CD8+、MIF表达上调是HRT预后不良的危险因素(OR>1,P<0.05);CD4+/CD8+表达上调是HRT预后不良的保护因素(OR<1,P<0.05),详见表2。

表2 回归分析检验淋巴细胞亚群、MIF水平对HRT预后的影响
2.3 淋巴细胞亚群、MIF水平预测HRT预后不良的ROC结果
将HRT治疗前CD8+、CD4+/CD8+、MIF水平作为检验变量,将HRT预后作为作为状态变量(1=预后不良,0=预后良好),绘制ROC(见图1)发现,CD8+、CD4+/CD8+、MIF水平用于预测HRT治疗后预后不良的AUC分别为:0.856、0.831、0.815,均>0.80,均有一定预测价值,cut-off值分别取31.000%、1.750、112.400 pg/mL时可获得最佳预测效能,各检验变量对应的cut-off值、特异度、敏感度等相关参数详见下页表3。
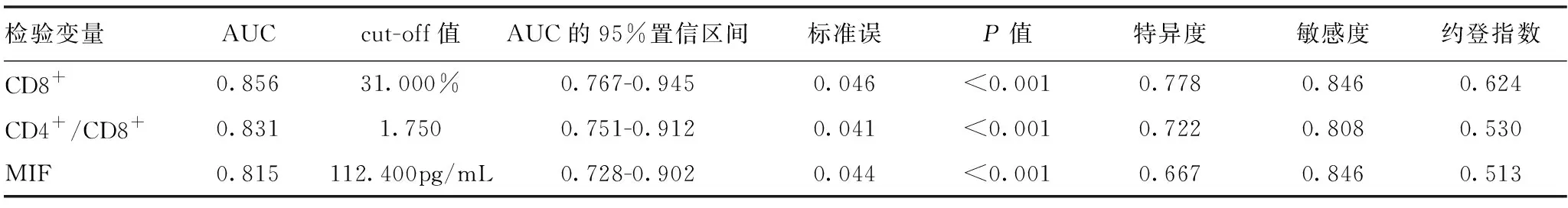
表3 淋巴细胞亚群、MIF水平预测HRT预后不良的ROC检验结果
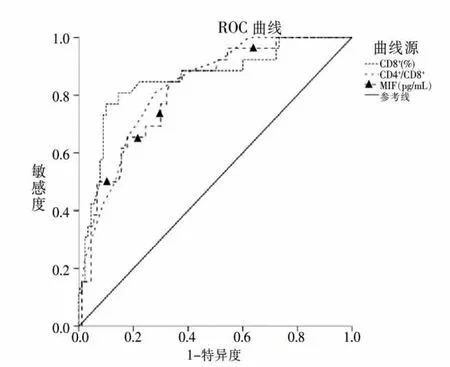
图1 淋巴细胞亚群、MIF水平预测HRT预后不良的ROC曲线图
3 讨论
POF发病因素目前尚未明确,既往研究认为POF发生可能与遗传、药物、感染、代谢因素等多种因素均有关,在多种因素作用下,患者卵泡消耗速度过快或数量减少,造成孕激素、雌激素合成分泌量不足,进而引起多种症状[7-8]。近年来大量研究指出,自身免疫紊乱在POF发病及病情进展中均发挥重要作用[9-10]。免疫系统通过复杂机制直接或间接参与卵泡发育,在免疫系统异常状态下,卵巢组织可受到系统攻击,靶细胞功能受损,进而可导致卵巢功能衰竭[11]。但现有研究尚未对免疫相关指标与POF患者治疗预后的关系进行分析,仍待进一步探讨。
本研究通过观察POF患者HRT预后,并探讨免疫相关指标与POF患者治疗预后的关系,以期为临床治疗POF提供一定参考意见。结果显示,116例POF患者HRT预后不良占比达22.41%,说明POF患者行HRT获益仍不理想。初步比较预后不良组和预后良好组基线资料后,经回归分析检验结果显示,CD8+、MIF表达上调是HRT预后不良的危险因素,CD4+/CD8+表达上调是HRT预后不良的保护因素。分析原因在于,CD8+是抑制/杀伤性T细胞的标志,即细胞毒性T细胞,主要功能是杀伤靶细胞,其表达水平上调可反馈为机体存在炎症或感染[12]。在POF患者中,CD8+水平可反馈患者存在自身免疫性卵巢炎,CD8+水平越高,患者自身免疫性卵巢炎程度越严重,行HRT的预后不良风险越高[13]。CD4+/CD8+水平可反馈免疫调节变化,比值降低多为CD4+水平降低,CD8+水平升高,可反馈为患者机体存在炎症感染,免疫功能失衡、免疫系统受损,自身免疫性卵巢炎难以得到及时控制,卵巢功能损伤进展较快,行HRT后,患者有预后不良风险[14-15]。反之,CD4+/CD8+比值偏低可反馈患者免疫系统功能受损较轻,预后风险较轻。
MIF是内分泌免疫物质,集合了细胞因子、生长因子、酶及激素等的特性,可在致炎因子刺激下过量释放,主要功能为抑制活化的巨嗜细胞游走、促进巨嗜细胞增殖[16]。MIF通过抑制活化巨嗜细胞游走,造成患者机体免疫功能紊乱,可促进POF病情进展[17];通过激活巨嗜细胞增殖、作为促炎介质,诱导白细胞介素-1β、肿瘤坏死因子-α等炎症因子释放,并上调黏附分子表达,促使炎症因子聚集[18-19]。此外,MIF可反向调节糖皮质激素,抑制糖皮质激素发挥抗炎功能,从而进一步促进局部炎症进展[20]。因此MIF表达上调可反馈为POF患者机体免疫紊乱较严重,并存在炎症损伤,患者卵巢功能不易恢复,预后不良风险较高。
基于上述分析,推测淋巴细胞亚群、MIF水平可用于预测HRT预后不良风险,绘制ROC发现,CD8+、CD4+/CD8+、MIF水平用于预测HRT预后不良的AUC均>0.80,均有一定预测价值,证实推测成立。临床可根据POF患者治疗前CD8+、CD4+/CD8+、MIF水平,划分高危患者,对有预后不良风险的POF患者,可在常规HRT基础上结合中药汤剂、针灸等疗法,以提高POF患者的短期治疗获益[21]。而因本研究未能观察POF患者炎症因子及体液免疫指标,结论尚有局限,未来还应纳入多项指标,进一步分析POF患者HRT预后不良的相关预测指标,并完善治疗措施。
综上所述,POF患者行HRT有一定预后不良风险,CD8+、CD4+/CD8+、MIF水平与HRT预后不良密切相关,并可作为预测指标。
